4.3 电解池 课件 (4)
文档属性
| 名称 | 4.3 电解池 课件 (4) |  | |
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 10:01:02 | ||
图片预览


文档简介
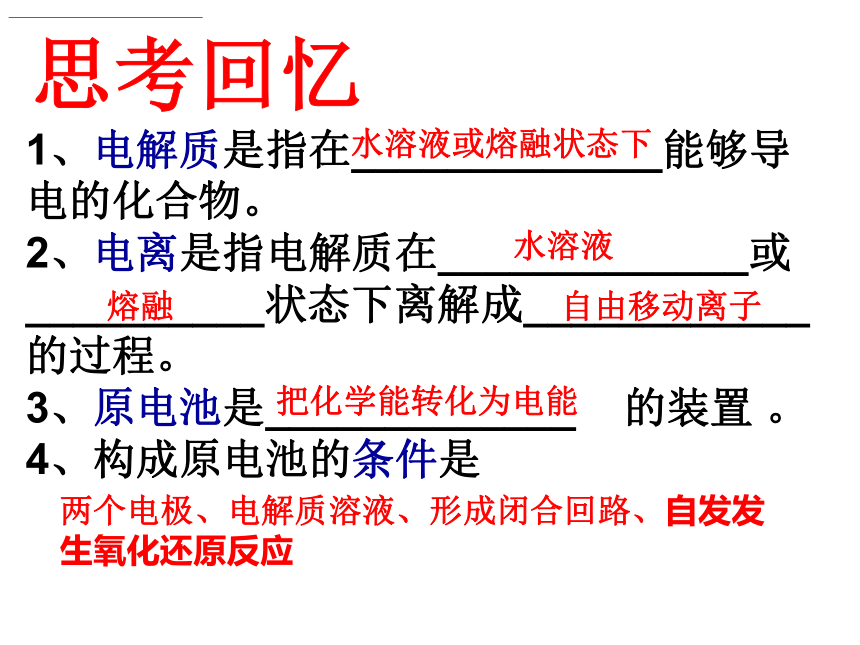
课件19张PPT。第四章 电化学基础第三节 电解池思考回忆1、电解质是指在_____________能够导电的化合物。
2、电离是指电解质在_____________或__________状态下离解成____________的过程。
3、原电池是_____________ 的装置 。
4、构成原电池的条件是
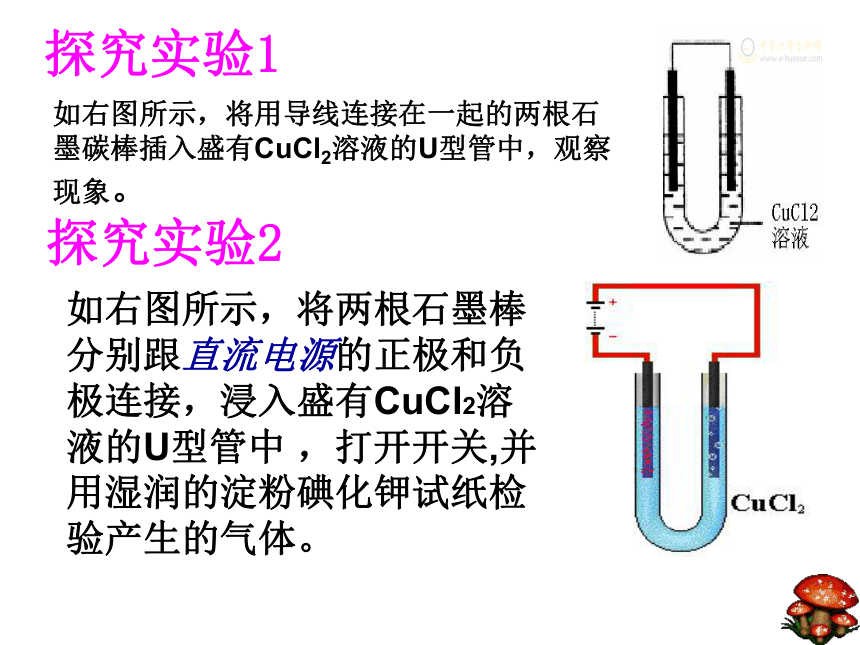
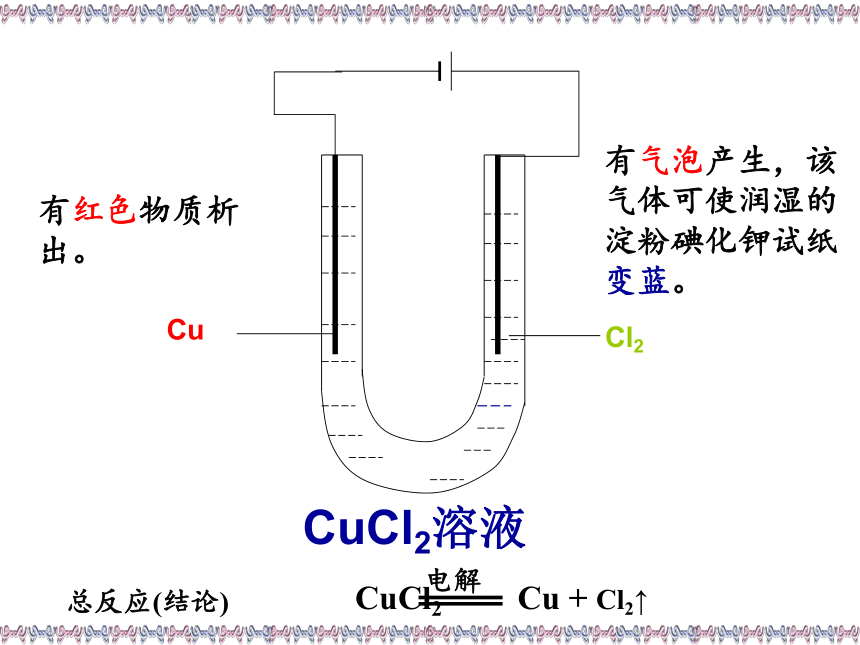
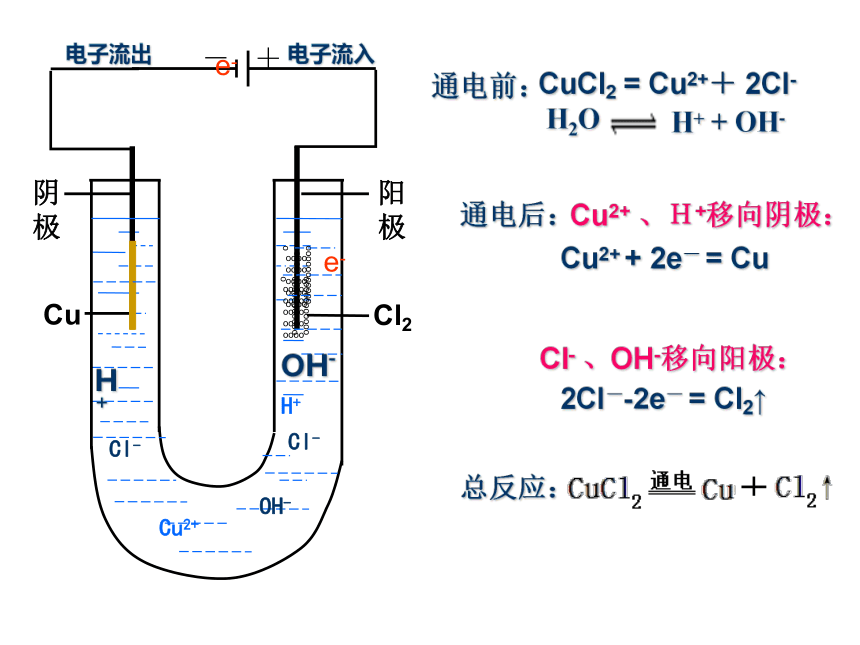
水溶液或熔融状态下水溶液熔融自由移动离子把化学能转化为电能两个电极、电解质溶液、形成闭合回路、自发发生氧化还原反应探究实验2如右图所示,将两根石墨棒分别跟直流电源的正极和负极连接,浸入盛有CuCl2溶液的U型管中 ,打开开关,并用湿润的淀粉碘化钾试纸检验产生的气体。如右图所示,将用导线连接在一起的两根石墨碳棒插入盛有CuCl2溶液的U型管中,观察现象。探究实验1CuCl2溶液有红色物质析出。有气泡产生,该
气体可使润湿的淀粉碘化钾试纸变蓝。总反应(结论)电解思考交流向氯化铜溶液中通入直流电的前后思考1:通电前氯化铜溶液中含有哪些微粒? 离子如何运动?
思考2:在通电时这些微粒又如何移动?
思考3:在通电条件下,阳极和阴极各发生什么反应?阳离子:Cu2+ H+ 阴离子:Cl- OH-Cu2+ H+向阴极区移动; Cl- OH-向阳极区移动Cl-→Cl2↑ 氧化反应 H2O H+ + OH- CuCl2= Cu2++2Cl-
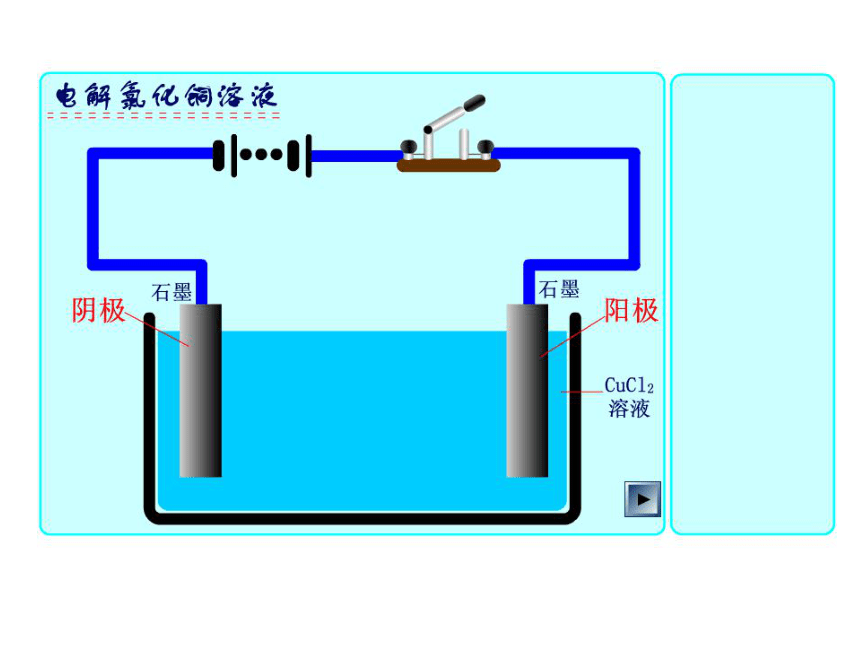
阴极:Cu2+→Cu 还原反应阳极:Cu2+- +e-e-电子流出Cl-Cl-电子流入通电前: CuCl2 = Cu2++ 2Cl-通电后: Cu2+ 、H+移向阴极: 2Cl--2e- = Cl2↑ Cu2+ + 2e- = Cu Cl- 、OH-移向阳极: 总反应: 阳极阴极H+H+OH-OH-- +e- 构成电解池的条件是什么?(1) 外接直流电源;(2) 有两个电极;(3) 有电解质溶液或熔融态的电解质;(4) 形成闭合回路。+Cu2+- +Cl-Cl-H+OH-(阴极、阳极)1.电解: 使直流电通过电解质溶液而在阴、阳两极引起 氧化还原反应的过程,叫做电解。4.构成电解池的条件:①直流电源;②电解质溶液或熔融电解质;2.电解池:电能转变为化学能的装置。一、电解原理③形成闭合回路。碳碳阴极阳极3.电解的本质:在电流的作用下,在阴、阳两极上引起氧化还原反应 +电源-
阳极 阴极
CuCl2溶液
电子流出电子流入小结 电解的工作原理:(注:电子只在外电路定向移动,不能从溶液中移动)失电子得电子氧化反应 还原反应2Cl—2e-=Cl2Cu2++2e-=Cu与电源正极连与电源负极连阳离子移向阴离子移向根据下表对原电池与电解池进行的比较,思考交流并填写表格电极产物反思为什么不是氧气呢?为什么不产生氢气呢?说明:得失电子的能力不同失电子能力:Cl->OH-得电子能力:Cu2+>H+放电
能力放电
次序离子放电顺序: ①活性材料作电极时:金属在阳极失电子被氧化成阳离子进人溶液,阴离子不容易在电极上放电。
②用惰性电极(Pt、Au、石墨、钛等)时:溶液中阴离子的放电顺序(由易到难)是:S 2->I ->Br ->Cl ->OH ->NO3 -等含氧酸根离子Ag+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca+>K+
注:电镀时通过控制条件, Fe2+和Zn2+得电子的能力强于H+ 无论是惰性电极还是活性电极都不参与电极反应,发生反应的是溶液中的阳离子。
阳离子在阴极上放电顺序是:阳极:阴极:只在熔融状态下放电,在水溶液中永远不放电。5.电解池电极反应规律(1)阴极:得电子,还原反应
①(一般)电极本身不参加反应
②均为电解质溶液中阳离子“争”得电子(2)阳极:失电子,氧化反应
①若为金属活性电极,电极失电子
②若为惰性电极,电解质溶液中阴离子“争”失电子 比较离子的放电能力,然后根据阴极还原、阳极氧化得出电极产物还
原
反
应氧化
反
应阳离子阴离子看电极 析溶液 判流向 定放电1.分析下图,哪个是原电池,哪个是电解池①③⑤⑥⑦C2 、如下图所示,哪个是原电池? ;哪个是电解池?
电极反应式分别为:
Fe极: ;发生 反应。
Zn极: ;发生 反应。
A极: ;发生 反应。
B极: ;发生 反应。NaCl溶液AB(1) 判断电源以及甲、乙、丙三池中的电极名称,并分别书写电极反应式
(2)对该装置的有关叙述正确的是?
A. P是电源的正极
B. F极上发生的反应为:4OH- - 4e-=2H2O+O2↑
C.电解时,甲、乙、丙三池中,除E、F两极外,其余电极均参 加了反应
D.通电后,甲池的PH减小,而乙、丙两池溶液的PH不变3.如图所示:通电后A极上析出Ag 再见!
2、电离是指电解质在_____________或__________状态下离解成____________的过程。
3、原电池是_____________ 的装置 。
4、构成原电池的条件是
水溶液或熔融状态下水溶液熔融自由移动离子把化学能转化为电能两个电极、电解质溶液、形成闭合回路、自发发生氧化还原反应探究实验2如右图所示,将两根石墨棒分别跟直流电源的正极和负极连接,浸入盛有CuCl2溶液的U型管中 ,打开开关,并用湿润的淀粉碘化钾试纸检验产生的气体。如右图所示,将用导线连接在一起的两根石墨碳棒插入盛有CuCl2溶液的U型管中,观察现象。探究实验1CuCl2溶液有红色物质析出。有气泡产生,该
气体可使润湿的淀粉碘化钾试纸变蓝。总反应(结论)电解思考交流向氯化铜溶液中通入直流电的前后思考1:通电前氯化铜溶液中含有哪些微粒? 离子如何运动?
思考2:在通电时这些微粒又如何移动?
思考3:在通电条件下,阳极和阴极各发生什么反应?阳离子:Cu2+ H+ 阴离子:Cl- OH-Cu2+ H+向阴极区移动; Cl- OH-向阳极区移动Cl-→Cl2↑ 氧化反应 H2O H+ + OH- CuCl2= Cu2++2Cl-
阴极:Cu2+→Cu 还原反应阳极:Cu2+- +e-e-电子流出Cl-Cl-电子流入通电前: CuCl2 = Cu2++ 2Cl-通电后: Cu2+ 、H+移向阴极: 2Cl--2e- = Cl2↑ Cu2+ + 2e- = Cu Cl- 、OH-移向阳极: 总反应: 阳极阴极H+H+OH-OH-- +e- 构成电解池的条件是什么?(1) 外接直流电源;(2) 有两个电极;(3) 有电解质溶液或熔融态的电解质;(4) 形成闭合回路。+Cu2+- +Cl-Cl-H+OH-(阴极、阳极)1.电解: 使直流电通过电解质溶液而在阴、阳两极引起 氧化还原反应的过程,叫做电解。4.构成电解池的条件:①直流电源;②电解质溶液或熔融电解质;2.电解池:电能转变为化学能的装置。一、电解原理③形成闭合回路。碳碳阴极阳极3.电解的本质:在电流的作用下,在阴、阳两极上引起氧化还原反应 +电源-
阳极 阴极
CuCl2溶液
电子流出电子流入小结 电解的工作原理:(注:电子只在外电路定向移动,不能从溶液中移动)失电子得电子氧化反应 还原反应2Cl—2e-=Cl2Cu2++2e-=Cu与电源正极连与电源负极连阳离子移向阴离子移向根据下表对原电池与电解池进行的比较,思考交流并填写表格电极产物反思为什么不是氧气呢?为什么不产生氢气呢?说明:得失电子的能力不同失电子能力:Cl->OH-得电子能力:Cu2+>H+放电
能力放电
次序离子放电顺序: ①活性材料作电极时:金属在阳极失电子被氧化成阳离子进人溶液,阴离子不容易在电极上放电。
②用惰性电极(Pt、Au、石墨、钛等)时:溶液中阴离子的放电顺序(由易到难)是:S 2->I ->Br ->Cl ->OH ->NO3 -等含氧酸根离子Ag+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca+>K+
注:电镀时通过控制条件, Fe2+和Zn2+得电子的能力强于H+ 无论是惰性电极还是活性电极都不参与电极反应,发生反应的是溶液中的阳离子。
阳离子在阴极上放电顺序是:阳极:阴极:只在熔融状态下放电,在水溶液中永远不放电。5.电解池电极反应规律(1)阴极:得电子,还原反应
①(一般)电极本身不参加反应
②均为电解质溶液中阳离子“争”得电子(2)阳极:失电子,氧化反应
①若为金属活性电极,电极失电子
②若为惰性电极,电解质溶液中阴离子“争”失电子 比较离子的放电能力,然后根据阴极还原、阳极氧化得出电极产物还
原
反
应氧化
反
应阳离子阴离子看电极 析溶液 判流向 定放电1.分析下图,哪个是原电池,哪个是电解池①③⑤⑥⑦C2 、如下图所示,哪个是原电池? ;哪个是电解池?
电极反应式分别为:
Fe极: ;发生 反应。
Zn极: ;发生 反应。
A极: ;发生 反应。
B极: ;发生 反应。NaCl溶液AB(1) 判断电源以及甲、乙、丙三池中的电极名称,并分别书写电极反应式
(2)对该装置的有关叙述正确的是?
A. P是电源的正极
B. F极上发生的反应为:4OH- - 4e-=2H2O+O2↑
C.电解时,甲、乙、丙三池中,除E、F两极外,其余电极均参 加了反应
D.通电后,甲池的PH减小,而乙、丙两池溶液的PH不变3.如图所示:通电后A极上析出Ag 再见!
