4.4 金属的电化学腐蚀与防护 课件 (3)
文档属性
| 名称 | 4.4 金属的电化学腐蚀与防护 课件 (3) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 00:00:00 | ||
图片预览






文档简介
课件16张PPT。金属的腐蚀与防护看到图片你们
想到了什么? 全世界每年因金属腐蚀造成的直接经济损失约达70000亿美元,约占各国国内生产总值(GDP)的2%~4%,是地震、水灾、台风等自然灾害造成损失总和的6倍,至于因设备腐蚀损坏而引起的停工减产、产品质量下降、污染环境、危害人体健康甚至造成严重事故的损失,就更无法估计了。那么作为一名理工科学生是不是更应该去了解腐蚀并且有效的做好防护呀?【学习目标】
1、理解金属发生电化学腐蚀的原理以及钢铁电化学
腐蚀发生的条件。
2、掌握金属防护的措施和原理。 请大家参照学案阅读课本思考以下问题:
1、什么是金属的腐蚀?
2、金属的腐蚀可分为哪几类?
3、金属的电化学腐蚀和化学腐蚀的本质是什么?金属的化学腐蚀与电化学腐蚀比较 金属原子失去电子被氧化而消耗的过程:
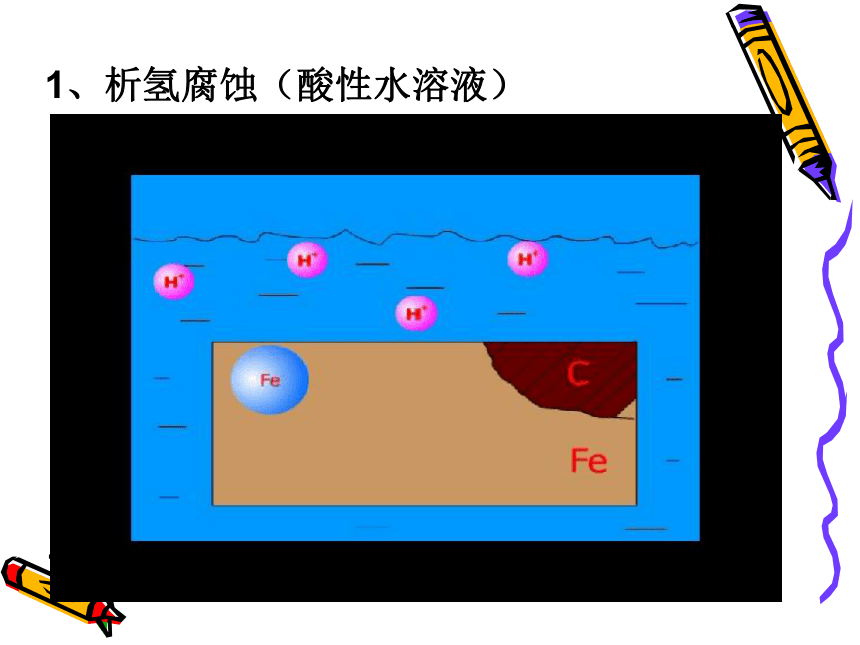
M-ne-=Mn+ 化学腐蚀电化学腐蚀金属和其它物质直接接触发生氧化还原反应而引起的腐蚀不纯金属或合金发生原电池反应,使较活泼的金属失电子被氧化而引起的腐蚀直接发生氧化还原反应发生原电池反应腐蚀过程无电流产生有电流产生金属直接被腐蚀较活泼金属被腐蚀电化学腐蚀>化学腐蚀往往同时发生,但电化学腐蚀更普遍,危害更大1、析氢腐蚀(酸性水溶液)2、吸氧腐蚀(中性或碱性水溶液)类 型析氢腐蚀 吸氧腐蚀 酸性较强 酸性很弱或呈中性 水膜性质 Fe-2e-====Fe2+ 2H++2e-====H2↑ 2H2O+O2+4e-====4OH- 钢铁的析氢腐蚀与吸氧腐蚀负极反应 正极反应 其他反应及
产物 4Fe(OH)2+O2+2H2O====4Fe(OH)3
2Fe(OH)3====Fe2O3·xH2O+(3-x)H2O 普遍性 吸氧腐蚀更普遍 【讨论】
[探究背景1]如图装置中,小试管内为红墨水,具支试管内盛有pH=5的雨水和生铁片。观察到开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管液面。
1.根据信息中的现象,试分析生铁片发生的腐蚀类型及原理。
2.开始时导管内液面下降时正极反应式如何书写?液面回升时正 极反应式如何书写?
3.若具支试管内盛有氯化钠溶液和生铁片会观察到怎样的现象?
[探究背景2] 用不同的细金属丝将三根大小相同的普通铁钉分别固定在如图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间。1.甲中发生的是析氢腐蚀吗?
2.实验结束时,铁钉c几乎没有被腐蚀,原因是什么?
3.实验结束时,铁钉腐蚀最严重的是哪个?
4.通过该实验分析金属腐蚀的快慢与腐蚀条件有何关系?
请根据生活常识以及下图总结金属防护常用的方法,并解释这些方法为什么可以达到防止金属腐蚀的目的。健身器材刷油漆衣架和电线的外面包上一层塑料层某些工具的“机械转动部位”涂油脂(机油),为什么不能用油漆自行车的钢圈和车铃是在钢上镀上一层既耐腐蚀又耐磨的Cr金属腐蚀的防护2、改变金属的内部组织结构:
如将Cr、Ni等金属加进钢里制成合金钢(不锈钢)1、金属表面覆盖保护层 如涂油漆、油脂、塑料、陶瓷等,镀上一层耐腐蚀的金属(Zn、Sn、Cr等),或氧化形成致密的氧化物薄膜作保护层。3、电化学保护法——牺牲阳极的阴极保护法原理:将被保护金属与比其更活泼的金属连接在一起,被保护金属做正极,不反应得到保护;而活泼金属反应作负极被腐蚀。用牺牲锌块的方法来保护船身,锌块必须定期更换示意图3、电化学保护法——外加电流的阴极保护法原理:通电后,电子被强制流向被保护的钢铁设备,抑制钢铁发生失电子作用,从而被保护
常用于防止土壤、海水及河水中的金属设备的腐蚀。【讨论】
1、结合金属腐蚀的本质,分析金属的电化学防护的本质是什么?在电化学防护中是如何做的?(请结合原电池和电解池的原理分析)
2、下列装置中,Fe腐蚀由快到慢的顺序为( ),分析其原因?
A.⑤④③②① B.⑤④①②③
C.⑤③④①② D.①②④③⑤1、电解原理引起的腐蚀 > 原电池原理引起的腐蚀 > 化学腐蚀>防腐措施的腐蚀2、对同一种金属来说,腐蚀的快慢:强电解质溶液 > 弱电解质溶液 > 非电解质溶液
3、活泼性不同的两金属,活泼性差别越大,腐蚀越慢。4、对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。总结
想到了什么? 全世界每年因金属腐蚀造成的直接经济损失约达70000亿美元,约占各国国内生产总值(GDP)的2%~4%,是地震、水灾、台风等自然灾害造成损失总和的6倍,至于因设备腐蚀损坏而引起的停工减产、产品质量下降、污染环境、危害人体健康甚至造成严重事故的损失,就更无法估计了。那么作为一名理工科学生是不是更应该去了解腐蚀并且有效的做好防护呀?【学习目标】
1、理解金属发生电化学腐蚀的原理以及钢铁电化学
腐蚀发生的条件。
2、掌握金属防护的措施和原理。 请大家参照学案阅读课本思考以下问题:
1、什么是金属的腐蚀?
2、金属的腐蚀可分为哪几类?
3、金属的电化学腐蚀和化学腐蚀的本质是什么?金属的化学腐蚀与电化学腐蚀比较 金属原子失去电子被氧化而消耗的过程:
M-ne-=Mn+ 化学腐蚀电化学腐蚀金属和其它物质直接接触发生氧化还原反应而引起的腐蚀不纯金属或合金发生原电池反应,使较活泼的金属失电子被氧化而引起的腐蚀直接发生氧化还原反应发生原电池反应腐蚀过程无电流产生有电流产生金属直接被腐蚀较活泼金属被腐蚀电化学腐蚀>化学腐蚀往往同时发生,但电化学腐蚀更普遍,危害更大1、析氢腐蚀(酸性水溶液)2、吸氧腐蚀(中性或碱性水溶液)类 型析氢腐蚀 吸氧腐蚀 酸性较强 酸性很弱或呈中性 水膜性质 Fe-2e-====Fe2+ 2H++2e-====H2↑ 2H2O+O2+4e-====4OH- 钢铁的析氢腐蚀与吸氧腐蚀负极反应 正极反应 其他反应及
产物 4Fe(OH)2+O2+2H2O====4Fe(OH)3
2Fe(OH)3====Fe2O3·xH2O+(3-x)H2O 普遍性 吸氧腐蚀更普遍 【讨论】
[探究背景1]如图装置中,小试管内为红墨水,具支试管内盛有pH=5的雨水和生铁片。观察到开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管液面。
1.根据信息中的现象,试分析生铁片发生的腐蚀类型及原理。
2.开始时导管内液面下降时正极反应式如何书写?液面回升时正 极反应式如何书写?
3.若具支试管内盛有氯化钠溶液和生铁片会观察到怎样的现象?
[探究背景2] 用不同的细金属丝将三根大小相同的普通铁钉分别固定在如图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间。1.甲中发生的是析氢腐蚀吗?
2.实验结束时,铁钉c几乎没有被腐蚀,原因是什么?
3.实验结束时,铁钉腐蚀最严重的是哪个?
4.通过该实验分析金属腐蚀的快慢与腐蚀条件有何关系?
请根据生活常识以及下图总结金属防护常用的方法,并解释这些方法为什么可以达到防止金属腐蚀的目的。健身器材刷油漆衣架和电线的外面包上一层塑料层某些工具的“机械转动部位”涂油脂(机油),为什么不能用油漆自行车的钢圈和车铃是在钢上镀上一层既耐腐蚀又耐磨的Cr金属腐蚀的防护2、改变金属的内部组织结构:
如将Cr、Ni等金属加进钢里制成合金钢(不锈钢)1、金属表面覆盖保护层 如涂油漆、油脂、塑料、陶瓷等,镀上一层耐腐蚀的金属(Zn、Sn、Cr等),或氧化形成致密的氧化物薄膜作保护层。3、电化学保护法——牺牲阳极的阴极保护法原理:将被保护金属与比其更活泼的金属连接在一起,被保护金属做正极,不反应得到保护;而活泼金属反应作负极被腐蚀。用牺牲锌块的方法来保护船身,锌块必须定期更换示意图3、电化学保护法——外加电流的阴极保护法原理:通电后,电子被强制流向被保护的钢铁设备,抑制钢铁发生失电子作用,从而被保护
常用于防止土壤、海水及河水中的金属设备的腐蚀。【讨论】
1、结合金属腐蚀的本质,分析金属的电化学防护的本质是什么?在电化学防护中是如何做的?(请结合原电池和电解池的原理分析)
2、下列装置中,Fe腐蚀由快到慢的顺序为( ),分析其原因?
A.⑤④③②① B.⑤④①②③
C.⑤③④①② D.①②④③⑤1、电解原理引起的腐蚀 > 原电池原理引起的腐蚀 > 化学腐蚀>防腐措施的腐蚀2、对同一种金属来说,腐蚀的快慢:强电解质溶液 > 弱电解质溶液 > 非电解质溶液
3、活泼性不同的两金属,活泼性差别越大,腐蚀越慢。4、对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。总结
