1.1 化学反应与能量变化 课件 (1)
文档属性
| 名称 | 1.1 化学反应与能量变化 课件 (1) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 10:04:07 | ||
图片预览




文档简介
课件18张PPT。第一章 化学反应与能量第一节 化学反应与能量的变化第 1 课时 焓变 反应热本节知识目录焓变 反应热学习目标定位1.熟知能量转化形式及反应热和焓变的含义、吸热反应和放热反应的本质。
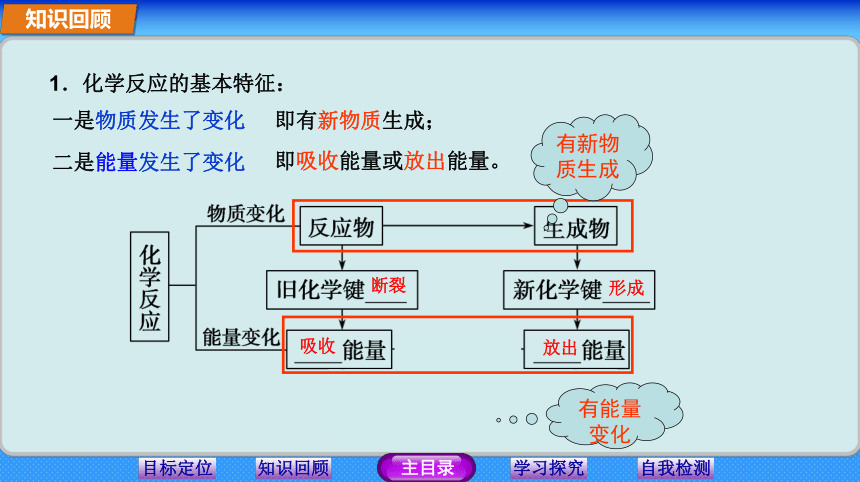
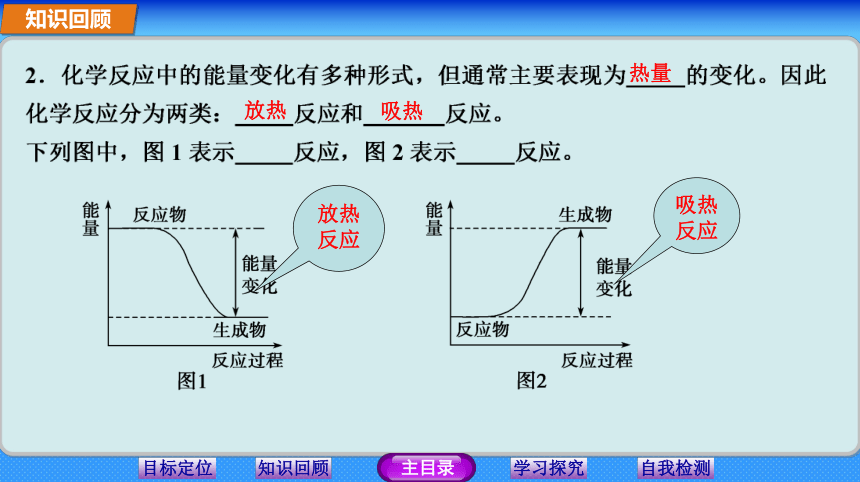
学习重难点:吸热反应和放热反应的本质。知识回顾1.化学反应的基本特征:一是物质发生了变化二是能量发生了变化即有新物质生成;即吸收能量或放出能量。断裂形成吸收放出有新物质生成有能量变化知识回顾热量 放热 吸热 放热反应吸热反应3.有下列反应:
①氧化钙与水反应 ②碳酸氢钠受热分解 ③硫酸与氢氧化钠溶液混合
④燃烧煤炭取暖 ⑤钠与水反应 ⑥胆矾受热失去结晶水,
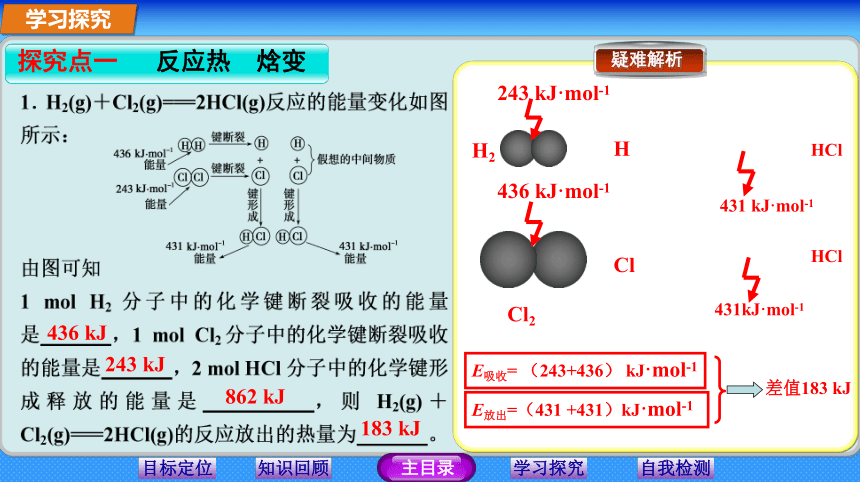
其中为吸热反应的是 ,放热反应的是 。知识回顾②⑥ ①③④⑤ 学习探究436 kJ 243 kJ 862 kJ 183 kJ 436 kJ·mol-1243 kJ·mol-1431 kJ·mol-1Cl2H2431kJ·mol-1HClHClClHE放出=(431 +431)kJ·mol-1E吸收= (243+436) kJ·mol-1差值183 kJ 是在恒压条件下进行的化学反应的热效应 。符号是ΔH ,学习探究 (即:化学反应中生成物所具有的焓与反应物所具有的焓之差)。2. 反应热、焓变的概念焓:指物质所具有的能量称为物质的焓。(1)反应热是化学反应在一定条件下所释放或吸收的热量。单位是(2)焓变学习探究由于反应时吸收环境能量而使反应体系的能量升高 ,故ΔH>0,即ΔH为+。3.ΔH的正、负和吸热、放热反应的关系由于反应后放出热量(释放给环境)而使反应体系的能量降低 ,故ΔH < 0,即ΔH为-。(1)放热反应(2)吸热反应指反应完成时,生成物释放的总能量大于反应物吸收的总能量的反应。指反应完成时,生成物释放的总能量<反应物吸收的总能量的反应。学习探究归纳总结学习探究ID 本题考查化学反应中的能量变化,学习探究I179 A (1)H2+ Cl2==2HCl
断键吸热为436 kJ·mol-1×1 mol+247 kJ·mol-1×1 mol 成键放热为-431 kJ·mol-1×2 mol;差值为
-179 kJ,这就是反应热。本题涉及键能与吸、放热的关系,考查了键能与反应热的定量关系。(2)根据反应H2+X2===2HX中,放出的热量Qp(HX)=E(H—H)+E(X—X)-2·E(H—X)。将表中数据代入可算得:Qp(HCl)请完成课时作业
学习重难点:吸热反应和放热反应的本质。知识回顾1.化学反应的基本特征:一是物质发生了变化二是能量发生了变化即有新物质生成;即吸收能量或放出能量。断裂形成吸收放出有新物质生成有能量变化知识回顾热量 放热 吸热 放热反应吸热反应3.有下列反应:
①氧化钙与水反应 ②碳酸氢钠受热分解 ③硫酸与氢氧化钠溶液混合
④燃烧煤炭取暖 ⑤钠与水反应 ⑥胆矾受热失去结晶水,
其中为吸热反应的是 ,放热反应的是 。知识回顾②⑥ ①③④⑤ 学习探究436 kJ 243 kJ 862 kJ 183 kJ 436 kJ·mol-1243 kJ·mol-1431 kJ·mol-1Cl2H2431kJ·mol-1HClHClClHE放出=(431 +431)kJ·mol-1E吸收= (243+436) kJ·mol-1差值183 kJ 是在恒压条件下进行的化学反应的热效应 。符号是ΔH ,学习探究 (即:化学反应中生成物所具有的焓与反应物所具有的焓之差)。2. 反应热、焓变的概念焓:指物质所具有的能量称为物质的焓。(1)反应热是化学反应在一定条件下所释放或吸收的热量。单位是(2)焓变学习探究由于反应时吸收环境能量而使反应体系的能量升高 ,故ΔH>0,即ΔH为+。3.ΔH的正、负和吸热、放热反应的关系由于反应后放出热量(释放给环境)而使反应体系的能量降低 ,故ΔH < 0,即ΔH为-。(1)放热反应(2)吸热反应指反应完成时,生成物释放的总能量大于反应物吸收的总能量的反应。指反应完成时,生成物释放的总能量<反应物吸收的总能量的反应。学习探究归纳总结学习探究ID 本题考查化学反应中的能量变化,学习探究I179 A (1)H2+ Cl2==2HCl
断键吸热为436 kJ·mol-1×1 mol+247 kJ·mol-1×1 mol 成键放热为-431 kJ·mol-1×2 mol;差值为
-179 kJ,这就是反应热。本题涉及键能与吸、放热的关系,考查了键能与反应热的定量关系。(2)根据反应H2+X2===2HX中,放出的热量Qp(HX)=E(H—H)+E(X—X)-2·E(H—X)。将表中数据代入可算得:Qp(HCl)
