1.2原子结构与元素的性质 课件 (3)
文档属性
| 名称 | 1.2原子结构与元素的性质 课件 (3) |

|
|
| 格式 | zip | ||
| 文件大小 | 943.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 10:06:23 | ||
图片预览








文档简介
课件24张PPT。第一章原子结构与性质第二节 原子结构与
元素的性质
(第2课时)参考答案 第二节 原子结构与元素性质(1) 原子结构与元素周期表 1、D、2、B、3、D、4、C、5、CD、6、AD、7、A、8、B、
9、1)ns;IA和 IIA族元素
2)np;IIIA-VIIA族、零族元素
3)(n-1)d;第IIIB族到VIII族元素
4)ns;IB族和IIB族元素
5)镧系和锕系元素
10、Fr;F;5;Tc
11、MgF2、CaCl2、Na2O、K2S、BeH212、
(A)H He C N O F Na Mg S Cl 7
(B)共价 H+ SO42- 或 SO32-
(C)离子 离子
(D)离子 共价 火碱 烧碱 苛性钠
(E)H2 N2 O2 F2 Cl2 共价
(F)F
(G)碱 酸
(H)离子 纯碱 正盐
(I)3 H2S、HCl、C2H6 HF H2O NH3 CH4
(J)NaHCO3 H2O2
(K)He
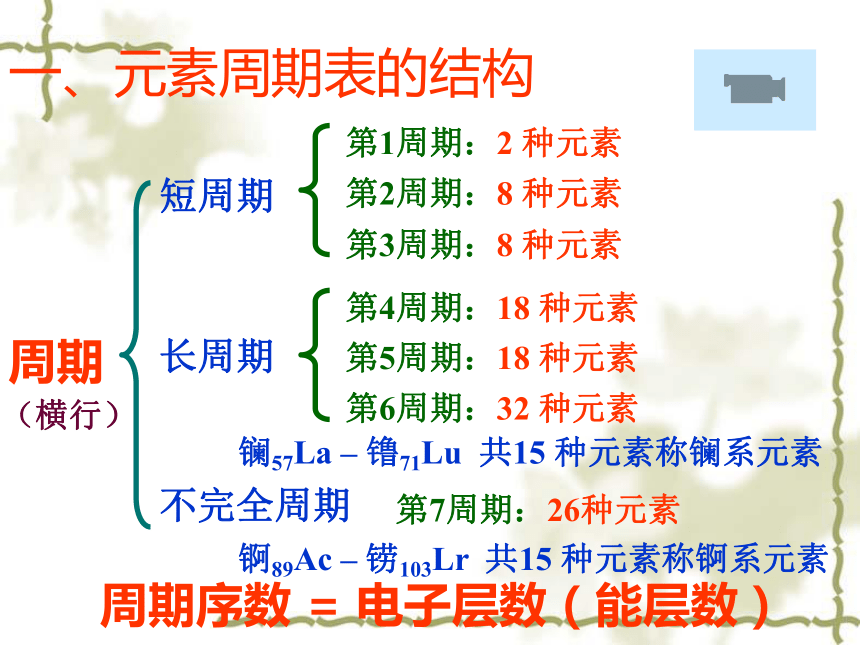
(L)NaOH>H2CO3>H2SO4知识回顾元素周期表的结构 一、元素周期表的结构周期短周期长周期第1周期:2 种元素第2周期:8 种元素第3周期:8 种元素第4周期:18 种元素第5周期:18 种元素第6周期:32 种元素不完全周期第7周期:26种元素镧57La – 镥71Lu 共15 种元素称镧系元素锕89Ac – 铹103Lr 共15 种元素称锕系元素周期序数 = 电子层数(能层数) (横行) 族主族:副族:ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 第VIII 族:稀有气体元素主族序数=最外层电子数=价电子数
=最高正价数(纵行) 零族:共七个主族ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB 共七个副族三个纵行(8、9、10),位于Ⅶ B 与ⅠB中间 一、元素周期表的结构复习回忆元素周期表的结构: 七主七副七周期, Ⅷ族零族镧锕系。1、在周期表中,把 相同的元素,按
的顺序从左到右排成横行,称之为 ,有 个;在把不同横行中
相同的元素,按 递增的顺序由上而下排成纵行,称之为 ,共有
个纵行, 个族。16个族又可分为
主族、 副族、 Ⅷ族、 0族。能层数原子序数递增周期7最外层电子数能层数族18167个7个1个1个课堂练习2、某周期ⅡA族元素的原子序数为x,则同周期的Ⅲ族元素的原子序数是( )
A 只有x+1
B 可能是x+8或x+18
C 可能是x+2
D 可能是x+1或x+11或x+25 课堂练习D知识回顾二、原子结构和性质周期性变化(1)同一周期元素结构和性质具有一定的递变性;从左到右原子半径逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,元素的金属性逐渐 ,非金属性逐渐
,对应氢化物的稳定性逐渐 ;最高价氧化物对应的水化物的酸性逐渐 ;碱性逐渐 ;
(2)同一主族元素结构和性质具有一定的相似性和递变性;同一主族,从上到下:原子半径逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,金属性逐渐 ,非金属性逐渐 ;对应氢化物的稳定性逐渐 ;最高价氧化物对应的水化物的酸性逐渐 ;碱性逐渐 ; 二、原子结构和性质周期性变化复习回忆减小减弱增强减弱减弱增强增强增强增大增强增强增强减弱减弱减弱减弱二、原子结构和性质周期性变化3)同周期元素的主要化合价:
最高正价:+1递增到+7。(氟、氧例外)
负价:-4递增到-1,呈现周期性的变化。最高正价+|负价|=8课堂练习: 3、碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列预言错误的是:
A.在碱金属中它具有最大的原子半径
B.它的氢氧化物化学式为FrOH,是一种极强的碱
C.钫在空气中燃烧时,只生成化学式为Fr2O的氧化物
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸C4、某元素X的气态氢化物化学式为H2X,则该元素的最高价含氧酸的化学式为 ( )
A. H2XO3 B. H3XO4 C. H2XO4 D. HXO4C思考与探究1、以第三周期为例,写出钠、镁、铝、硅、磷、硫、氯、氩基态原子的简化电子排布式并观察原子的核外电子排布变化有什么规律?最外层电子排布从1个电子(ns1)到
8个电子(ns2np6)呈周期性变化.结论:随着核电荷数的增加,核外电子的排布发生周期性的变化。知识回顾二、原子结构和性质周期性变化(一)原子的电子排布与族的划分在周期中有18个纵列,除零族元素中He (1s2)与其它稀有气体ns2np6不同外,一般说来,其它每个族序数和价电子数是相等的.
主族元素:族序数=原子的最外层电子数
=价电子数
副族元素:大多数族序数=(n-1)d+ns的电子数
=价电子数 (二)原子的电子构型和元素的分区S 区元素:最外层构型是ns1和ns2。IA和 IIA族元 素。除H外,其余为活泼金属。p区元素:最外层电子构型从ns2np1~ns2np6的元素。即IIIA~VIIA族、零族元素。除H外,所有非金属元素都在p区。 ds区元素:包括IB族和IIB族元素,最外层电子数皆为1~2个,均为金属元素 。f区元素:包括镧系和锕系元素。最外层电子数基本相同,化学性质相似。d区元素:包含第IIIB族到VIII族元素。最外层电子数皆为1~2个,均为金属元素,性质相似。5、已知某元素在周期表中位于第五周期、ⅥA族位置上。试写出该元素基态原子的价电子排布式、电子排布式并分析该元素在哪区? 由于是ⅥA族, 4d必是全充满的,所以价电子排布为5s25p4,电子排布式[Kr]4d105s25p4课堂练习属P区1.已知一元素的价层电子结构为3d54s2,试确定其在周期表中的位置及所属区。 第四周期,ⅦB族、d区。2.试确定32号元素在周期表中的位置及所属区。 第四周期,ⅣA族、P区 3.判断处于第三周期,ⅣA族元素的价层
电子结构、原子序数。 [Ne]3s23p2,第14号元素练习:二、元素周期律元素的性质随( )的递增发生周期性的递变,称为元素的周期律。 核电荷数学与问 元素周期表中的同周期主族元素从左到右,原子半径的变化趋势如何?应如何理解这种趋势?周期表中的同主族元素从上到下,原子半径的变化趋势如何?应如何理解这种趋势?1、原子半径(一)原子半径:1、影响因素:2、规律:(1)电子层数不同时,电子层数越多,原子半径越大。二、元素周期律原子半径的大小取决于1、电子的能层数
2、核电荷数(2)电子层相同时,核电荷数越大,原子半径越小。(3)电子层、核电荷数都相同时,电子数越多,
原子半径越大。课堂练习1:
比较下列微粒的半径的大小:
(1)Ca AI
(2) Na+ Na
(3) Cl- Cl
(4)K+ Ca2+ S2- CI- ><>S2->CI->K+>Ca2+课堂练习2:
具有相同电子层结构的三种微粒An+、Bn-、C
下列分析正确的是( )
A.原子序数关系:C>B>A
B.微粒半径关系: Bn-> An+
C. C微粒是稀有气体元素的原子.
D. 原子半径关系是:A
元素的性质
(第2课时)参考答案 第二节 原子结构与元素性质(1) 原子结构与元素周期表 1、D、2、B、3、D、4、C、5、CD、6、AD、7、A、8、B、
9、1)ns;IA和 IIA族元素
2)np;IIIA-VIIA族、零族元素
3)(n-1)d;第IIIB族到VIII族元素
4)ns;IB族和IIB族元素
5)镧系和锕系元素
10、Fr;F;5;Tc
11、MgF2、CaCl2、Na2O、K2S、BeH212、
(A)H He C N O F Na Mg S Cl 7
(B)共价 H+ SO42- 或 SO32-
(C)离子 离子
(D)离子 共价 火碱 烧碱 苛性钠
(E)H2 N2 O2 F2 Cl2 共价
(F)F
(G)碱 酸
(H)离子 纯碱 正盐
(I)3 H2S、HCl、C2H6 HF H2O NH3 CH4
(J)NaHCO3 H2O2
(K)He
(L)NaOH>H2CO3>H2SO4知识回顾元素周期表的结构 一、元素周期表的结构周期短周期长周期第1周期:2 种元素第2周期:8 种元素第3周期:8 种元素第4周期:18 种元素第5周期:18 种元素第6周期:32 种元素不完全周期第7周期:26种元素镧57La – 镥71Lu 共15 种元素称镧系元素锕89Ac – 铹103Lr 共15 种元素称锕系元素周期序数 = 电子层数(能层数) (横行) 族主族:副族:ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 第VIII 族:稀有气体元素主族序数=最外层电子数=价电子数
=最高正价数(纵行) 零族:共七个主族ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB 共七个副族三个纵行(8、9、10),位于Ⅶ B 与ⅠB中间 一、元素周期表的结构复习回忆元素周期表的结构: 七主七副七周期, Ⅷ族零族镧锕系。1、在周期表中,把 相同的元素,按
的顺序从左到右排成横行,称之为 ,有 个;在把不同横行中
相同的元素,按 递增的顺序由上而下排成纵行,称之为 ,共有
个纵行, 个族。16个族又可分为
主族、 副族、 Ⅷ族、 0族。能层数原子序数递增周期7最外层电子数能层数族18167个7个1个1个课堂练习2、某周期ⅡA族元素的原子序数为x,则同周期的Ⅲ族元素的原子序数是( )
A 只有x+1
B 可能是x+8或x+18
C 可能是x+2
D 可能是x+1或x+11或x+25 课堂练习D知识回顾二、原子结构和性质周期性变化(1)同一周期元素结构和性质具有一定的递变性;从左到右原子半径逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,元素的金属性逐渐 ,非金属性逐渐
,对应氢化物的稳定性逐渐 ;最高价氧化物对应的水化物的酸性逐渐 ;碱性逐渐 ;
(2)同一主族元素结构和性质具有一定的相似性和递变性;同一主族,从上到下:原子半径逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,金属性逐渐 ,非金属性逐渐 ;对应氢化物的稳定性逐渐 ;最高价氧化物对应的水化物的酸性逐渐 ;碱性逐渐 ; 二、原子结构和性质周期性变化复习回忆减小减弱增强减弱减弱增强增强增强增大增强增强增强减弱减弱减弱减弱二、原子结构和性质周期性变化3)同周期元素的主要化合价:
最高正价:+1递增到+7。(氟、氧例外)
负价:-4递增到-1,呈现周期性的变化。最高正价+|负价|=8课堂练习: 3、碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列预言错误的是:
A.在碱金属中它具有最大的原子半径
B.它的氢氧化物化学式为FrOH,是一种极强的碱
C.钫在空气中燃烧时,只生成化学式为Fr2O的氧化物
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸C4、某元素X的气态氢化物化学式为H2X,则该元素的最高价含氧酸的化学式为 ( )
A. H2XO3 B. H3XO4 C. H2XO4 D. HXO4C思考与探究1、以第三周期为例,写出钠、镁、铝、硅、磷、硫、氯、氩基态原子的简化电子排布式并观察原子的核外电子排布变化有什么规律?最外层电子排布从1个电子(ns1)到
8个电子(ns2np6)呈周期性变化.结论:随着核电荷数的增加,核外电子的排布发生周期性的变化。知识回顾二、原子结构和性质周期性变化(一)原子的电子排布与族的划分在周期中有18个纵列,除零族元素中He (1s2)与其它稀有气体ns2np6不同外,一般说来,其它每个族序数和价电子数是相等的.
主族元素:族序数=原子的最外层电子数
=价电子数
副族元素:大多数族序数=(n-1)d+ns的电子数
=价电子数 (二)原子的电子构型和元素的分区S 区元素:最外层构型是ns1和ns2。IA和 IIA族元 素。除H外,其余为活泼金属。p区元素:最外层电子构型从ns2np1~ns2np6的元素。即IIIA~VIIA族、零族元素。除H外,所有非金属元素都在p区。 ds区元素:包括IB族和IIB族元素,最外层电子数皆为1~2个,均为金属元素 。f区元素:包括镧系和锕系元素。最外层电子数基本相同,化学性质相似。d区元素:包含第IIIB族到VIII族元素。最外层电子数皆为1~2个,均为金属元素,性质相似。5、已知某元素在周期表中位于第五周期、ⅥA族位置上。试写出该元素基态原子的价电子排布式、电子排布式并分析该元素在哪区? 由于是ⅥA族, 4d必是全充满的,所以价电子排布为5s25p4,电子排布式[Kr]4d105s25p4课堂练习属P区1.已知一元素的价层电子结构为3d54s2,试确定其在周期表中的位置及所属区。 第四周期,ⅦB族、d区。2.试确定32号元素在周期表中的位置及所属区。 第四周期,ⅣA族、P区 3.判断处于第三周期,ⅣA族元素的价层
电子结构、原子序数。 [Ne]3s23p2,第14号元素练习:二、元素周期律元素的性质随( )的递增发生周期性的递变,称为元素的周期律。 核电荷数学与问 元素周期表中的同周期主族元素从左到右,原子半径的变化趋势如何?应如何理解这种趋势?周期表中的同主族元素从上到下,原子半径的变化趋势如何?应如何理解这种趋势?1、原子半径(一)原子半径:1、影响因素:2、规律:(1)电子层数不同时,电子层数越多,原子半径越大。二、元素周期律原子半径的大小取决于1、电子的能层数
2、核电荷数(2)电子层相同时,核电荷数越大,原子半径越小。(3)电子层、核电荷数都相同时,电子数越多,
原子半径越大。课堂练习1:
比较下列微粒的半径的大小:
(1)Ca AI
(2) Na+ Na
(3) Cl- Cl
(4)K+ Ca2+ S2- CI- ><>S2->CI->K+>Ca2+课堂练习2:
具有相同电子层结构的三种微粒An+、Bn-、C
下列分析正确的是( )
A.原子序数关系:C>B>A
B.微粒半径关系: Bn-> An+
C. C微粒是稀有气体元素的原子.
D. 原子半径关系是:A
