2.3分子的性质 课件 (4)
文档属性
| 名称 | 2.3分子的性质 课件 (4) |  | |
| 格式 | zip | ||
| 文件大小 | 4.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 10:06:16 | ||
图片预览



文档简介
课件31张PPT。第三节 分子的性质选修三 ● 第二章 分子结构与性质第一课时
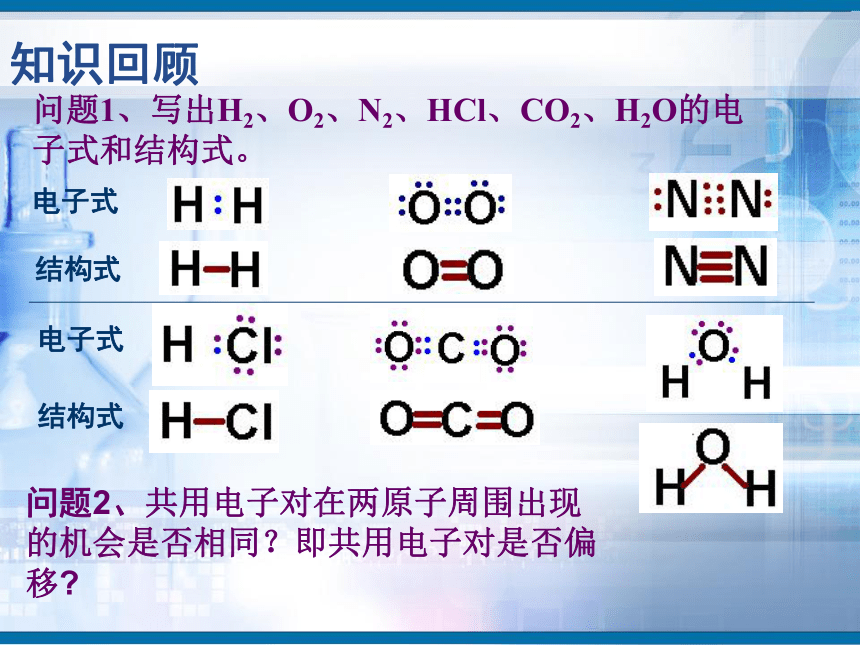
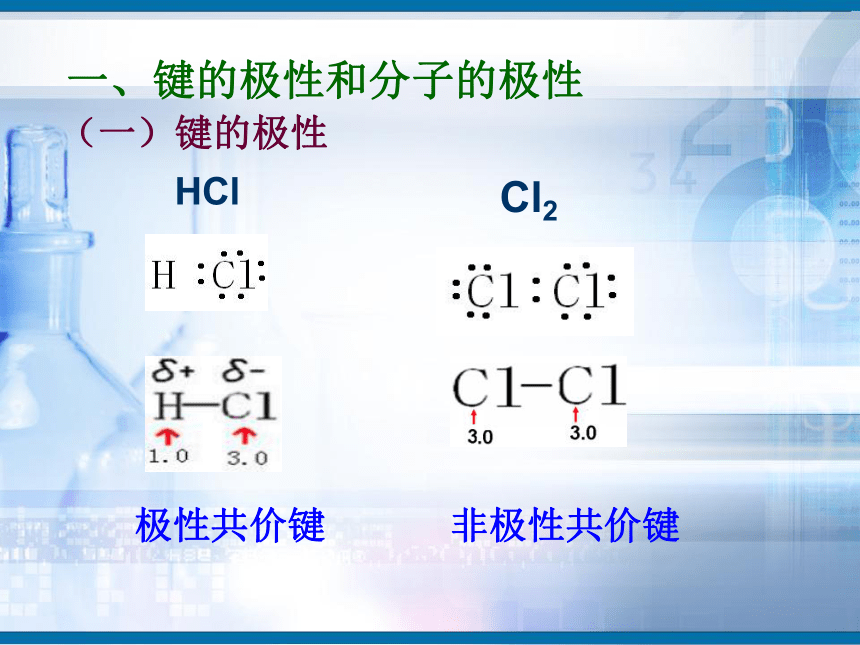
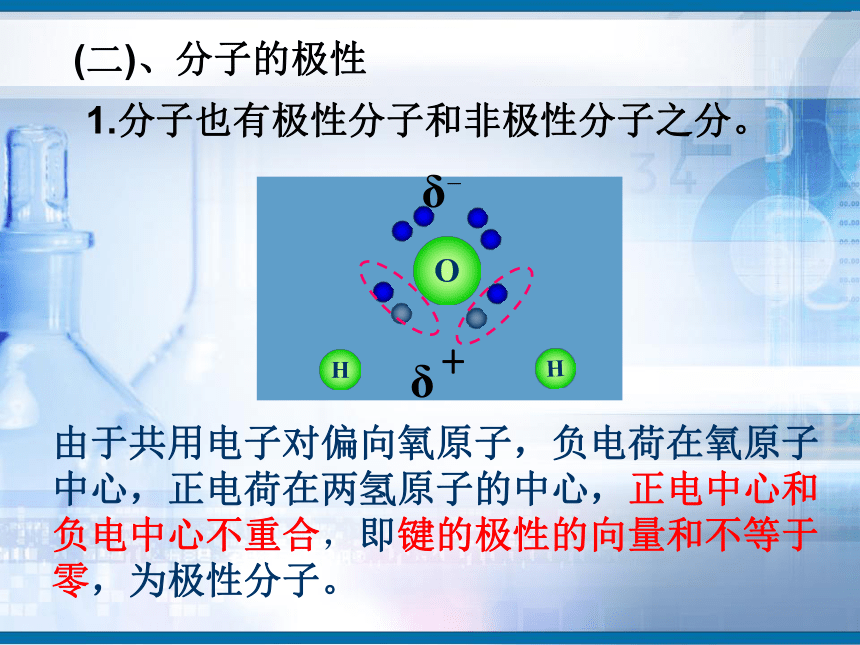
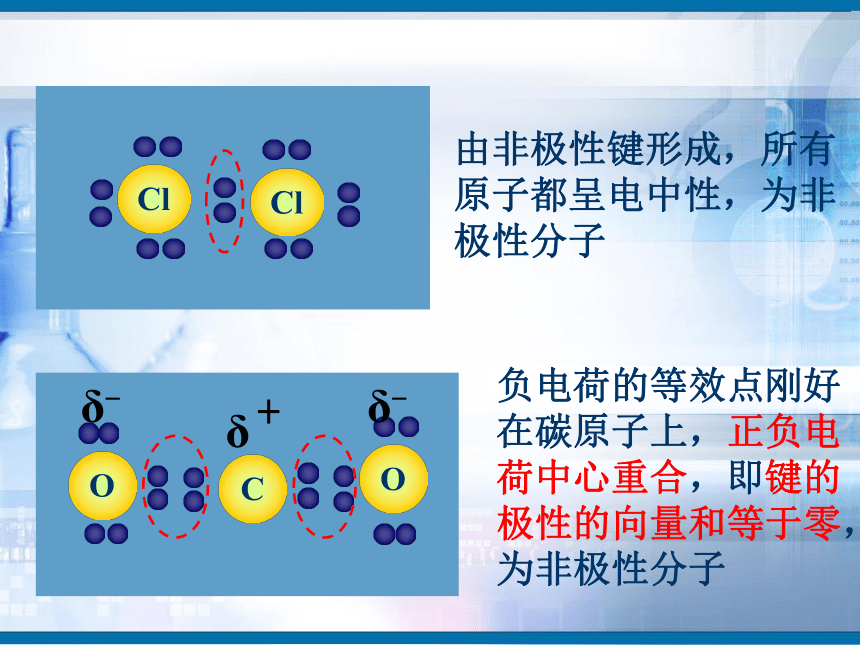
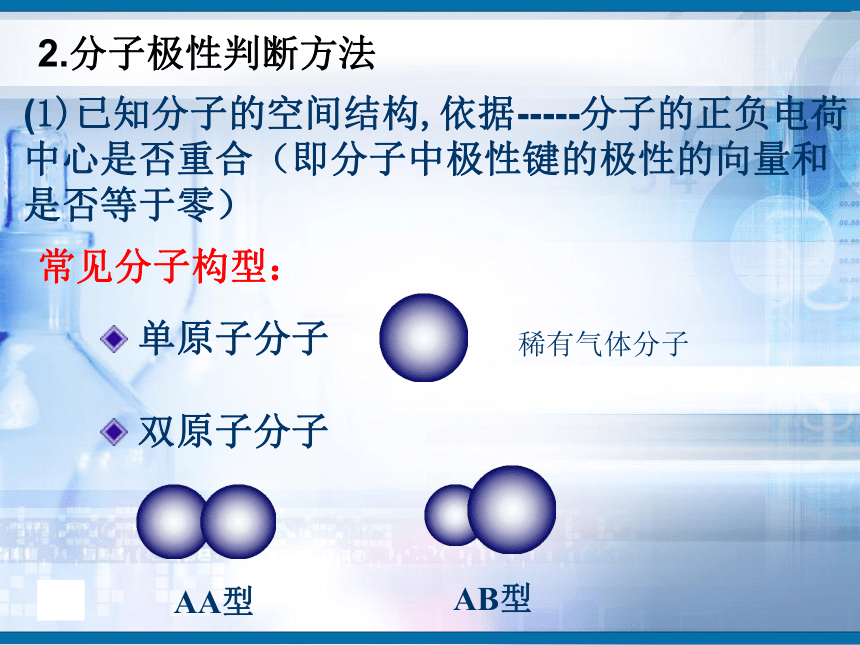
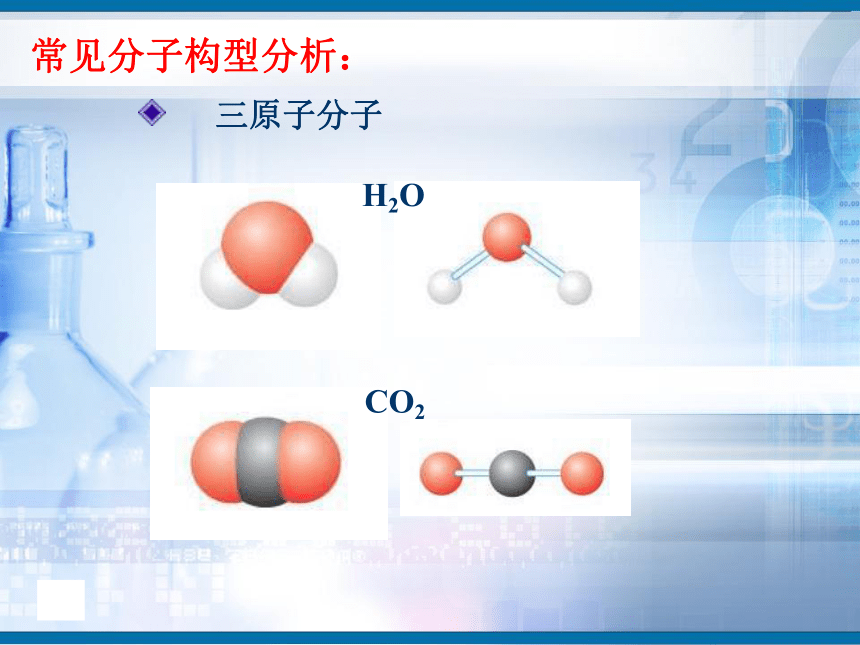
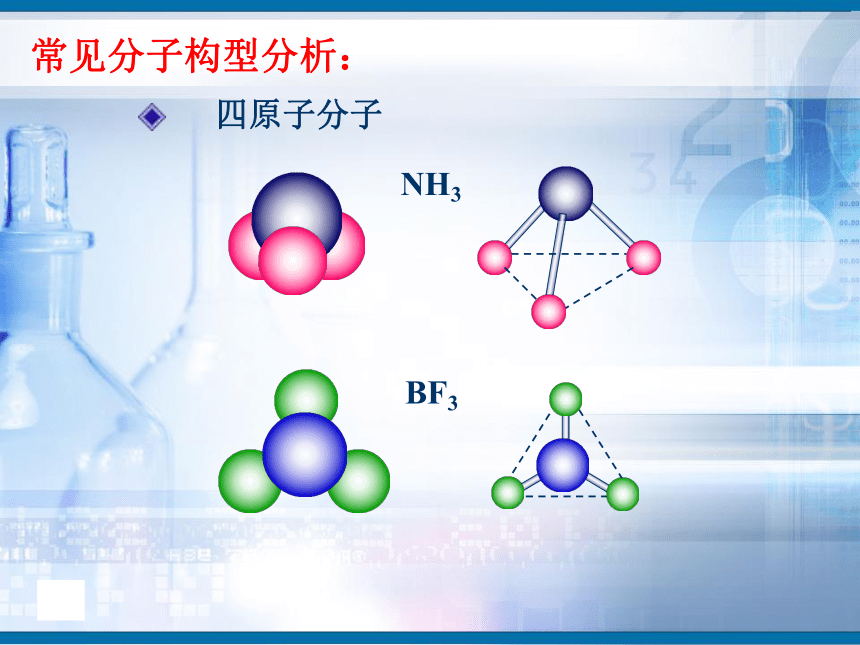
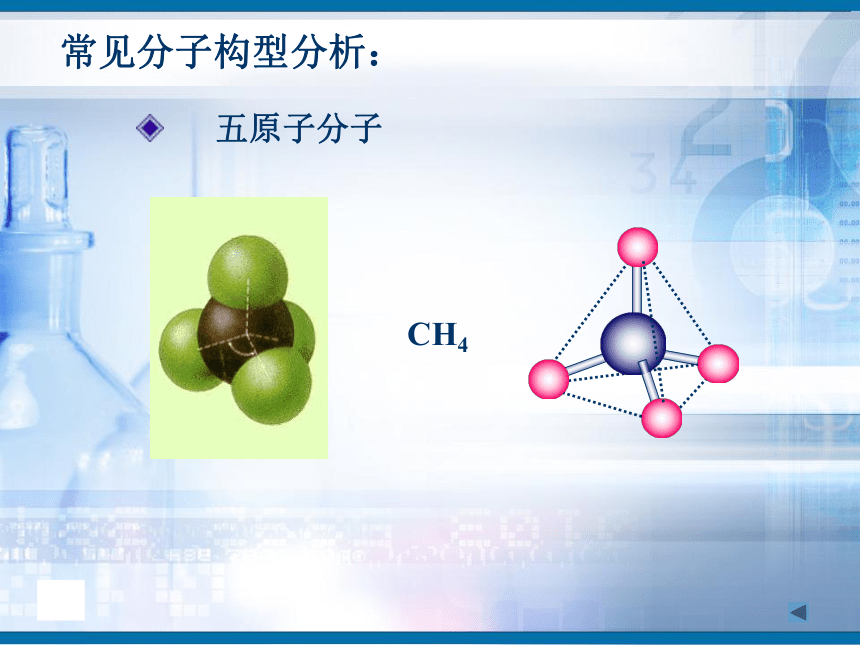
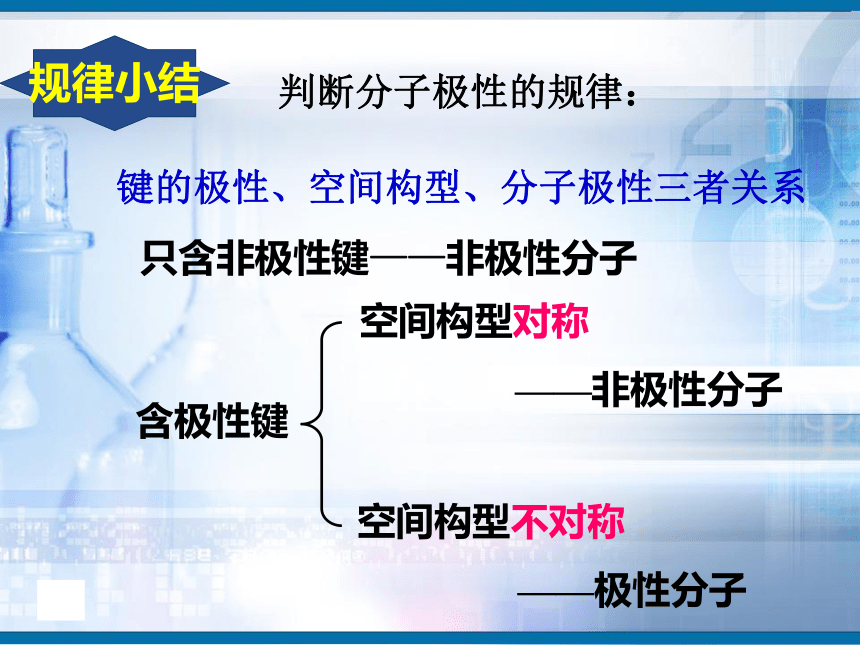
知识回顾问题1、写出H2、O2、N2、HCl、CO2、H2O的电子式和结构式。问题2、共用电子对在两原子周围出现的机会是否相同?即共用电子对是否偏移?电子式结构式电子式结构式极性共价键 非极性共价键一、键的极性和分子的极性(一)键的极性HClCl2(二)、分子的极性 1.分子也有极性分子和非极性分子之分。δ-HOH由于共用电子对偏向氧原子,负电荷在氧原子中心,正电荷在两氢原子的中心,正电中心和负电中心不重合,即键的极性的向量和不等于零,为极性分子。由非极性键形成,所有原子都呈电中性,为非极性分子δ-δ-负电荷的等效点刚好在碳原子上,正负电荷中心重合,即键的极性的向量和等于零,为非极性分子(1)已知分子的空间结构,依据-----分子的正负电荷中心是否重合(即分子中极性键的极性的向量和是否等于零)双原子分子2.分子极性判断方法常见分子构型:单原子分子稀有气体分子三原子分子H2OCO2常见分子构型分析:四原子分子NH3BF3常见分子构型分析:常见分子构型分析:五原子分子CH4规律小结判断分子极性的规律:键的极性、空间构型、分子极性三者关系只含非极性键——非极性分子含极性键空间构型对称
——非极性分子空间构型不对称
——极性分子(2)未知分子的空间结构,判断ABn型分子极性的经验规律:①ABn型分子中心原子A的化合价的绝对值 是否等于该主族元素原子的最外层电子数,若相等为非极性分子,若不等为极性分子
②ABn型分子中心原子A有无孤电子对,若有为极性分子,若无为非极性分子[练习]判断下列分子是极性分子还是非极性分子:PCl3、CCl4、CS2、SO2非极性分子 将分子中的共价键看作作用力,不同的共价键看作不相等的作用力,运用物理上力的合成与分解,看中心原子受力是否平衡,如平衡则为非极性分子;否则为极性分子。(3)物理模型法思考与交流(课本P45)1、以下双原子分子中,哪些是极性分子,哪些是非极性分子?H2 O2 Cl2 HCl2、以下非金属单质中,哪个是极性分子,哪个是非极性分子?P4 C60 He3、以下化合物分子中,哪些是极性分子,哪些是非极性分子?CO2 HCN H2O NH3BF3 CH4 CH3Cl极性分子极性分子 问题1 冰山融化现象是物理变化还是化学变化?问题2 冰山融化时有没有破坏其中的化学键?问题3 那为什么冰山融化过程仍要吸收能量呢?问题探究 分子间存在着将分子聚集在一起的作用力,这种作用力称为分子间作用力。常见的为范德华力和氢键 这一事实表明:二、范德华力及其对物质性质的影响定义:把分子聚集在一起的作用力,
称范德华力。请分析下表中数据并填空2. 特点:范德华力 ,约比化学键的键能 __1~2数量级。 很弱小问题探究①?
?
3. 影响范德华力大小的因素(1)结构 的分子,相对分子质量越 ,
范德华力越 ,熔、沸点越 。?
?
相似大大请结合分子结构的特点分析下表中数据并填空高问题探究②(2)相对分子质量 或 时,分子的极性越 ,范德华力越 ,熔、沸点越 。 相同相近大大请分析下表中数据并填空高问题探究③2018年11月18日星期日不为失败找理由要为成功找方法!怎样解释卤素单质从F2 I2的熔、沸点越来越高?卤素单质都是双原子分子,组成和结构相似,其范德华力随相对分子质量的增大而增大,因此,卤素单质从F2→I2的熔、沸点越来越高思考与交流教材P47 学与问2018年11月18日星期日不为失败找理由, 要为成功找方法!范德华力与化学键的比较表物质的分子间存在的微弱的相互作用。分子内相邻的两个或多个原子间强烈的相互作用。分子间分子内弱(约几个至数十个kJ/mol) 强 (键能一般为120-800KJ/mol)主要影响物质的物理性质(如熔沸点等)主要影响物质的化学性质结论(1)将干冰气化,破坏了CO2分子晶体的 。(2)将HCl气体溶于水,破坏了HCl分子 。分子间作用力共价键(3)解释CCl4是液体,CH4及CF4是气体,CI4是固体的原因。 原因解释:它们均是正四面体结构,它们的分子间作用力随相对分子质量增大而增大,相对分子质量越大,分子间作用力越大。 分子间作用力大小: CI4 > CCl4 >CF4 >CH4学以致用三、氢键及其对物质性质的影响这表明在H2O分子之间除了存在van der Waals力外,
还存在另一种作用力。氢键及其形成条件1.定义:氢键是一种特殊的分子间作用力,它是由已经与电负性很强的原子形成共 价键的氢原子与另一分子中电负性很强的原子之间的作用力.
2.表示: X—H…Y (X、Y为N、O、F)2. 氢键的存在(1)分子间氢键 氢键普遍存在于已经与N、O、F形成共价键的氢原子与另外的N、O、F原子之间。如:HF、H2O、NH3 相互之间C2H5OH、CH3COOH、H2O相互之间 (2)分子内氢键
某些物质在分子内也可形成氢键,例如当苯酚在邻位上有—CHO、—COOH、—OH和—NO2时,可形成分子内的氢键,组成“螯合环”的特殊结构. (2)分子内氢键: 例如 (1)分子间氢键:3. 氢键键能大小范围 氢键介于范德华力和化学键之间,是一种较弱的作用力。 氢键强弱与X和Y的吸引电子的能力有关,即与X和Y的电负性有关.它们的吸引电子能力越强(即电负性越大),则氢键越强,如F原子得电子能力最强,因而F-H…F是最强的氢键; 原子吸引电子能力不同,所以氢键强弱变化顺序为:
F-H…F > O-H…O > O-H…N > N-H…N
4. 氢键强弱5.氢键对物质性质的影响2、对性质的影响:
熔沸点:(1)分子间氢键:升高
(2)分子内氢键:降低
溶解度:一般与溶剂形成分子间氢
键可使溶解度升高,分子内
则降低。 我们在学习化学的过程中还有什么地方能用氢键的知识来解释的?(1)醇比含有相同碳原子的烃熔沸点高
(2)低级醇易溶于水
(3)HF酸是弱酸5. 氢键的应用 ……思考:NH3为什么极易溶于水?NH3溶于水是形成N-
H…O还是形成O-H…N?NH3溶于水形成氢键示意图如右,正是这样,NH3溶于水溶液呈碱性四、溶解性思考: 为什么蔗糖和氨易容于水,难溶于四氯化碳;而萘和碘却易溶于四氯化碳,难溶于水?“相似相溶”原理: 极性溶质易溶于极性溶剂,非极性溶质易溶于非极性溶剂。(氢键可使溶解性增大) 用氢键的知识解释下列问题:
(1)H2O的熔沸点为什么比硫化氢的高?
(2)液态氟化氢的分子式为何可写成(HF)n?
(3)为什么水和乙醇可以完全互溶?
(4)为什么氨易液化?交流研讨
知识回顾问题1、写出H2、O2、N2、HCl、CO2、H2O的电子式和结构式。问题2、共用电子对在两原子周围出现的机会是否相同?即共用电子对是否偏移?电子式结构式电子式结构式极性共价键 非极性共价键一、键的极性和分子的极性(一)键的极性HClCl2(二)、分子的极性 1.分子也有极性分子和非极性分子之分。δ-HOH由于共用电子对偏向氧原子,负电荷在氧原子中心,正电荷在两氢原子的中心,正电中心和负电中心不重合,即键的极性的向量和不等于零,为极性分子。由非极性键形成,所有原子都呈电中性,为非极性分子δ-δ-负电荷的等效点刚好在碳原子上,正负电荷中心重合,即键的极性的向量和等于零,为非极性分子(1)已知分子的空间结构,依据-----分子的正负电荷中心是否重合(即分子中极性键的极性的向量和是否等于零)双原子分子2.分子极性判断方法常见分子构型:单原子分子稀有气体分子三原子分子H2OCO2常见分子构型分析:四原子分子NH3BF3常见分子构型分析:常见分子构型分析:五原子分子CH4规律小结判断分子极性的规律:键的极性、空间构型、分子极性三者关系只含非极性键——非极性分子含极性键空间构型对称
——非极性分子空间构型不对称
——极性分子(2)未知分子的空间结构,判断ABn型分子极性的经验规律:①ABn型分子中心原子A的化合价的绝对值 是否等于该主族元素原子的最外层电子数,若相等为非极性分子,若不等为极性分子
②ABn型分子中心原子A有无孤电子对,若有为极性分子,若无为非极性分子[练习]判断下列分子是极性分子还是非极性分子:PCl3、CCl4、CS2、SO2非极性分子 将分子中的共价键看作作用力,不同的共价键看作不相等的作用力,运用物理上力的合成与分解,看中心原子受力是否平衡,如平衡则为非极性分子;否则为极性分子。(3)物理模型法思考与交流(课本P45)1、以下双原子分子中,哪些是极性分子,哪些是非极性分子?H2 O2 Cl2 HCl2、以下非金属单质中,哪个是极性分子,哪个是非极性分子?P4 C60 He3、以下化合物分子中,哪些是极性分子,哪些是非极性分子?CO2 HCN H2O NH3BF3 CH4 CH3Cl极性分子极性分子 问题1 冰山融化现象是物理变化还是化学变化?问题2 冰山融化时有没有破坏其中的化学键?问题3 那为什么冰山融化过程仍要吸收能量呢?问题探究 分子间存在着将分子聚集在一起的作用力,这种作用力称为分子间作用力。常见的为范德华力和氢键 这一事实表明:二、范德华力及其对物质性质的影响定义:把分子聚集在一起的作用力,
称范德华力。请分析下表中数据并填空2. 特点:范德华力 ,约比化学键的键能 __1~2数量级。 很弱小问题探究①?
?
3. 影响范德华力大小的因素(1)结构 的分子,相对分子质量越 ,
范德华力越 ,熔、沸点越 。?
?
相似大大请结合分子结构的特点分析下表中数据并填空高问题探究②(2)相对分子质量 或 时,分子的极性越 ,范德华力越 ,熔、沸点越 。 相同相近大大请分析下表中数据并填空高问题探究③2018年11月18日星期日不为失败找理由要为成功找方法!怎样解释卤素单质从F2 I2的熔、沸点越来越高?卤素单质都是双原子分子,组成和结构相似,其范德华力随相对分子质量的增大而增大,因此,卤素单质从F2→I2的熔、沸点越来越高思考与交流教材P47 学与问2018年11月18日星期日不为失败找理由, 要为成功找方法!范德华力与化学键的比较表物质的分子间存在的微弱的相互作用。分子内相邻的两个或多个原子间强烈的相互作用。分子间分子内弱(约几个至数十个kJ/mol) 强 (键能一般为120-800KJ/mol)主要影响物质的物理性质(如熔沸点等)主要影响物质的化学性质结论(1)将干冰气化,破坏了CO2分子晶体的 。(2)将HCl气体溶于水,破坏了HCl分子 。分子间作用力共价键(3)解释CCl4是液体,CH4及CF4是气体,CI4是固体的原因。 原因解释:它们均是正四面体结构,它们的分子间作用力随相对分子质量增大而增大,相对分子质量越大,分子间作用力越大。 分子间作用力大小: CI4 > CCl4 >CF4 >CH4学以致用三、氢键及其对物质性质的影响这表明在H2O分子之间除了存在van der Waals力外,
还存在另一种作用力。氢键及其形成条件1.定义:氢键是一种特殊的分子间作用力,它是由已经与电负性很强的原子形成共 价键的氢原子与另一分子中电负性很强的原子之间的作用力.
2.表示: X—H…Y (X、Y为N、O、F)2. 氢键的存在(1)分子间氢键 氢键普遍存在于已经与N、O、F形成共价键的氢原子与另外的N、O、F原子之间。如:HF、H2O、NH3 相互之间C2H5OH、CH3COOH、H2O相互之间 (2)分子内氢键
某些物质在分子内也可形成氢键,例如当苯酚在邻位上有—CHO、—COOH、—OH和—NO2时,可形成分子内的氢键,组成“螯合环”的特殊结构. (2)分子内氢键: 例如 (1)分子间氢键:3. 氢键键能大小范围 氢键介于范德华力和化学键之间,是一种较弱的作用力。 氢键强弱与X和Y的吸引电子的能力有关,即与X和Y的电负性有关.它们的吸引电子能力越强(即电负性越大),则氢键越强,如F原子得电子能力最强,因而F-H…F是最强的氢键; 原子吸引电子能力不同,所以氢键强弱变化顺序为:
F-H…F > O-H…O > O-H…N > N-H…N
4. 氢键强弱5.氢键对物质性质的影响2、对性质的影响:
熔沸点:(1)分子间氢键:升高
(2)分子内氢键:降低
溶解度:一般与溶剂形成分子间氢
键可使溶解度升高,分子内
则降低。 我们在学习化学的过程中还有什么地方能用氢键的知识来解释的?(1)醇比含有相同碳原子的烃熔沸点高
(2)低级醇易溶于水
(3)HF酸是弱酸5. 氢键的应用 ……思考:NH3为什么极易溶于水?NH3溶于水是形成N-
H…O还是形成O-H…N?NH3溶于水形成氢键示意图如右,正是这样,NH3溶于水溶液呈碱性四、溶解性思考: 为什么蔗糖和氨易容于水,难溶于四氯化碳;而萘和碘却易溶于四氯化碳,难溶于水?“相似相溶”原理: 极性溶质易溶于极性溶剂,非极性溶质易溶于非极性溶剂。(氢键可使溶解性增大) 用氢键的知识解释下列问题:
(1)H2O的熔沸点为什么比硫化氢的高?
(2)液态氟化氢的分子式为何可写成(HF)n?
(3)为什么水和乙醇可以完全互溶?
(4)为什么氨易液化?交流研讨
