1.2 有机化合物的结构特点 课件 (3)
文档属性
| 名称 | 1.2 有机化合物的结构特点 课件 (3) |  | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 10:27:02 | ||
图片预览










文档简介
课件36张PPT。第二节 有机化合物的结构特点【学习目标】
1.了解有机化合物中碳原子形成化学键的特点。
2.认识有机化合物的同分异构现象与同分异构体。
3.掌握同分异构体的书写方法与规律。【课前预习】
一、有机化合物中碳原子的成键特点
1.碳原子的结构特点:碳原子最外层有__个电子,不易失去或得
到电子形成阳离子或阴离子。碳原子通过_______与其他原子
形成共价化合物。
2.碳原子间的结合方式:碳原子之间可以形成稳定的_____、
_____或_____。多个碳原子可以形成长短不一的碳链,碳链可
以带_____,还可以结合形成_____,碳链和碳环也可以相互结合。4共价键单键双键三键支链碳环3.甲烷分子中碳原子的成键特点:
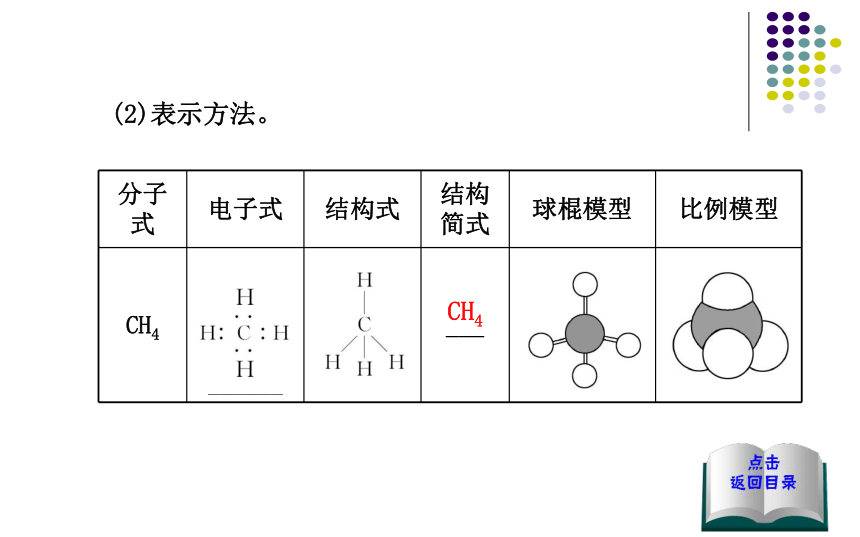
(1)结构特点:正四面体结构[1],碳原子居于正四面体的中心,
4个氢原子位于正四面体的顶点,两个碳氢键间的夹角为
_________。109°28'(2)表示方法。CH4二、有机化合物的同分异构现象
1.同分异构现象和同分异构体:
(1)同分异构现象:化合物具有相同的_______,但_____不同,因
而产生了_____上的差异的现象。
(2)同分异构体:具有_____________的化合物互为同分异构体。分子式结构性质同分异构现象2.同分异构体的类型[2]:碳链骨架官能团位置CH3—CH=CH—CH3官能团种类2.问题思考:
(1)符合通式为CnH2n+2的烃一定是烷烃吗?
分析:是。烷烃是饱和链烃,只有烷烃的通式为CnH2n+2,不像单烯烃和环烷烃那样可以具有相同的通式。
(2)相对分子质量相同的两种物质一定互为同分异构体吗?试举例说明。
分析:不一定。相对分子质量相同的不同物质可能具有相同的分子式,也可能具有不同的分子式,如CH3COOH与CH3CH2CH2OH,它们的相对分子质量相同,但分子式不同,不互为同分异构体。【课堂探究】
1、某有机物如图所示:
下列关于该有机物的叙述正确的是 ( )
A.以上表示方法为结构式
B.能使溴水因反应而褪色
C.在加热和催化剂作用下,最多能和5 mol H2反应
D.该有机物的分子式为C14H19Cl
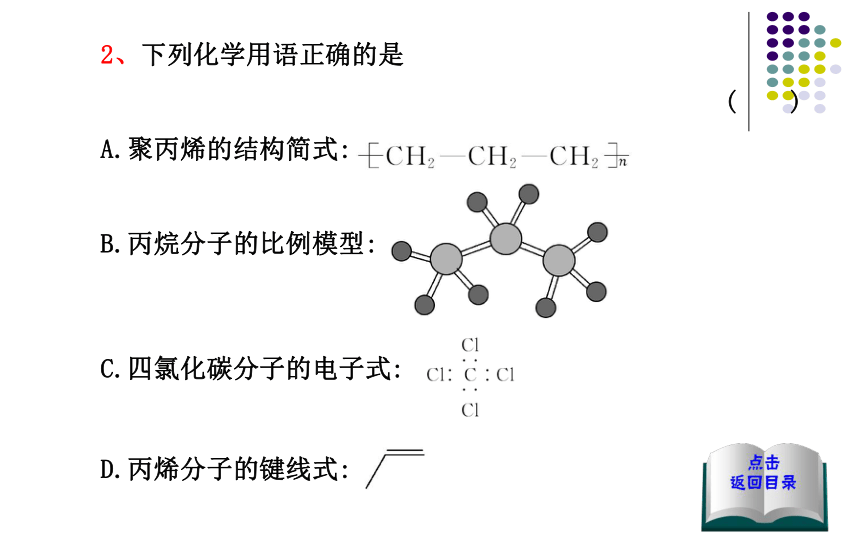
【解析】选B。图示为该有机物的键线式,由于有机物分子中含有碳碳双键,因而具有烯烃的性质,能使溴水因反应而褪色,在加热条件下能与4 mol H2加成(苯环3 mol,碳碳双键1 mol),分子式为C13H17Cl。2、下列化学用语正确的是
( )
A.聚丙烯的结构简式:??
B.丙烷分子的比例模型:
C.四氯化碳分子的电子式:
D.丙烯分子的键线式:【解析】选D。聚丙烯的结构简式为 ,A项错
误;B项为丙烷的球棍模型;C项四氯化碳分子的电子式为3、下列物质的一氯取代物的同分异构体数目相同的是 ( )A.①② B.③④ C.②③ D.②④【解析】选C。根据等效氢法可知,①②③④四种物质的等效氢
如下图所示:
序号相同的氢原子被氯原子取代后的产物相同,②③一氯代物
均为4种,①④都为7种。4、已知化合物A(C4Si4H8)与立方烷(C8H8)的分子结构相似,如图:
则C4Si4H8的二氯代物的同分异构体数目为 ( )
A.3 B.4 C.5 D.6【解析】选B。观察立方烷的结构可知,立方烷的二氯代物为
3种,分别为
化合物A由于顶点原子与立方烷的不同,从而在平面对角线上多
一种同分异构体,因此有4种,它们分别是【当堂检测】
1、(双选)互称为同分异构体的物质一定具有 ( )
A.相似的化学性质 B.相同的组成元素
C.相同的分子式 D.相同的熔、沸点和密度
【解析】选B、C。互为同分异构体的物质物理性质一定不同,化学性质可能相似,可能不同,比如官能团异构的同分异构体化学性质不同,但是一定具有相同的分子式和组成元素。2、已知丙烷的二氯代物有四种异构体,则其六氯代物的异构体数目为 ( )
A.两种 B.三种 C.四种 D.五种
【解析】选C。根据替代法将丙烷的二氯代物中的氢原子和氯原子互换,就是丙烷的六氯代物,则同样为四种。3、大多数有机物分子里的碳原子与碳原子之间或碳原子与其他原子之间相结合的化学键是 ( )
A.只有极性键 B.只有非极性键
C.有极性键和非极性键 D.只有离子键
【解析】选C。根据碳原子的成键特点,碳碳原子之间可形成非极性共价键,碳原子与其他原子之间则以极性共价键结合,C项正确。4、A、B两种烃的分子式均为C6H10,它们的分子中均无支链或侧链。
(1)A为环状结构,能跟溴发生加成反应,则A的结构简式是 。
(2)B分子为链状(分子中不存在—C=C=C—基团),它跟溴的1∶1加成产物可能有两种,则B的结构简式可能是
① ;
② 。【解析】本题要求根据有机化合物性质书写同分异构体。
(1)中A为环状结构,且能跟溴发生加成反应,说明含有碳碳双键。
(2)中B分子为链状,且跟溴的1∶1加成产物可能有两种,说明含
有两个碳碳双键,且不含有—C=C=C—基团。
答案:(1)
(2)①CH3—CH=CH—CH=CH—CH3
②CH2=CH—CH2—CH=CH—CH3【课堂总结】
一、有机物分子结构的表示方法二、同分异构体的书写及数目判断
1.同分异构体的书写方法:
(1)烷烃——减碳对称法:烷烃只存在碳链异构,书写时要注意全面而不重复,下面以C7H16为例,具体规则如下:
①将分子写成直链形式:CH3CH2CH2CH2CH2CH2CH3。
②从直链上去掉一个—CH3,依次连在剩余碳链中心对称线一侧的各个碳原子上。可得③再从主链上去掉一个碳,可形成一个—CH2CH3或两个—CH3。
当取代基为乙基时,即得 。当取代基为
两个甲基时,在主链上先定一个甲基,然后按照位置由近到远的
顺序依次移动另外一个甲基,注意不要重复,即④再从主链上去掉一个碳,可形成一个丙基,一个乙基与一个甲
基或三个甲基,其中当取代基为丙基或乙基与甲基时写出同分
异构体与前面写出的重复;当取代基为三个甲基时,即
上述书写方法可总结为成直链,一条线;摘一碳,挂中间;往边移,
不到端;摘多碳,整到散;多支链,同邻间。也可总结为主链由长
到短,支链由整到散,位置由心到边不到端。(2)官能团的位置异构的书写——先链后位:含有官能团的同分异构体的书写顺序一般为碳链异构→官能团位置异构→官能团类别异构。
以C5H10为例,写出烯烃范围内的同分异构体。
书写方法:先写出可能的碳链方式(只写碳骨架),再加上含有的官能团位置。
碳链结构:
位置异构:用箭头表示双键的位置。在(Ⅰ)中,双键可能加入的位置有
C—C—C—C=C、C—C—C=C—C;在(Ⅱ)中,双键可能加入的位
置有
在(Ⅲ)中,双键无法加入,因为碳只能形成四个键。
整理后得C5H10烯烃范围内的同分异构体有
CH3CH2CH2CH=CH2、CH3CH2CH=CHCH3、2.同分异构体的数目判断:
(1)基元法:如丁基有4种同分异构体,分别为
CH3—CH2—CH2—CH2—、 、
,则丁醇的同分异构体为4种。
(2)替代法:如二氯苯(C6H4Cl2)有3种同分异构体,则四氯苯
(C6H2Cl4)也有3种同分异构体(将H替代Cl)。(3)等效氢法。
①同一甲基上的氢是等效的。
②同一碳原子上所连甲基上的氢是等效的。如新戊烷
( )的四个甲基是等效的,所有的氢原子都是等效的,
故新戊烷的一氯代物只有一种。
③处于对称位置上的氢原子是等效的。如
的六个甲基是等效的,18个氢原子都是等效的,因此该物质的一
氯代物也只有一种。【作业布置】《高效作业本》课时提升练二
1.了解有机化合物中碳原子形成化学键的特点。
2.认识有机化合物的同分异构现象与同分异构体。
3.掌握同分异构体的书写方法与规律。【课前预习】
一、有机化合物中碳原子的成键特点
1.碳原子的结构特点:碳原子最外层有__个电子,不易失去或得
到电子形成阳离子或阴离子。碳原子通过_______与其他原子
形成共价化合物。
2.碳原子间的结合方式:碳原子之间可以形成稳定的_____、
_____或_____。多个碳原子可以形成长短不一的碳链,碳链可
以带_____,还可以结合形成_____,碳链和碳环也可以相互结合。4共价键单键双键三键支链碳环3.甲烷分子中碳原子的成键特点:
(1)结构特点:正四面体结构[1],碳原子居于正四面体的中心,
4个氢原子位于正四面体的顶点,两个碳氢键间的夹角为
_________。109°28'(2)表示方法。CH4二、有机化合物的同分异构现象
1.同分异构现象和同分异构体:
(1)同分异构现象:化合物具有相同的_______,但_____不同,因
而产生了_____上的差异的现象。
(2)同分异构体:具有_____________的化合物互为同分异构体。分子式结构性质同分异构现象2.同分异构体的类型[2]:碳链骨架官能团位置CH3—CH=CH—CH3官能团种类2.问题思考:
(1)符合通式为CnH2n+2的烃一定是烷烃吗?
分析:是。烷烃是饱和链烃,只有烷烃的通式为CnH2n+2,不像单烯烃和环烷烃那样可以具有相同的通式。
(2)相对分子质量相同的两种物质一定互为同分异构体吗?试举例说明。
分析:不一定。相对分子质量相同的不同物质可能具有相同的分子式,也可能具有不同的分子式,如CH3COOH与CH3CH2CH2OH,它们的相对分子质量相同,但分子式不同,不互为同分异构体。【课堂探究】
1、某有机物如图所示:
下列关于该有机物的叙述正确的是 ( )
A.以上表示方法为结构式
B.能使溴水因反应而褪色
C.在加热和催化剂作用下,最多能和5 mol H2反应
D.该有机物的分子式为C14H19Cl
【解析】选B。图示为该有机物的键线式,由于有机物分子中含有碳碳双键,因而具有烯烃的性质,能使溴水因反应而褪色,在加热条件下能与4 mol H2加成(苯环3 mol,碳碳双键1 mol),分子式为C13H17Cl。2、下列化学用语正确的是
( )
A.聚丙烯的结构简式:??
B.丙烷分子的比例模型:
C.四氯化碳分子的电子式:
D.丙烯分子的键线式:【解析】选D。聚丙烯的结构简式为 ,A项错
误;B项为丙烷的球棍模型;C项四氯化碳分子的电子式为3、下列物质的一氯取代物的同分异构体数目相同的是 ( )A.①② B.③④ C.②③ D.②④【解析】选C。根据等效氢法可知,①②③④四种物质的等效氢
如下图所示:
序号相同的氢原子被氯原子取代后的产物相同,②③一氯代物
均为4种,①④都为7种。4、已知化合物A(C4Si4H8)与立方烷(C8H8)的分子结构相似,如图:
则C4Si4H8的二氯代物的同分异构体数目为 ( )
A.3 B.4 C.5 D.6【解析】选B。观察立方烷的结构可知,立方烷的二氯代物为
3种,分别为
化合物A由于顶点原子与立方烷的不同,从而在平面对角线上多
一种同分异构体,因此有4种,它们分别是【当堂检测】
1、(双选)互称为同分异构体的物质一定具有 ( )
A.相似的化学性质 B.相同的组成元素
C.相同的分子式 D.相同的熔、沸点和密度
【解析】选B、C。互为同分异构体的物质物理性质一定不同,化学性质可能相似,可能不同,比如官能团异构的同分异构体化学性质不同,但是一定具有相同的分子式和组成元素。2、已知丙烷的二氯代物有四种异构体,则其六氯代物的异构体数目为 ( )
A.两种 B.三种 C.四种 D.五种
【解析】选C。根据替代法将丙烷的二氯代物中的氢原子和氯原子互换,就是丙烷的六氯代物,则同样为四种。3、大多数有机物分子里的碳原子与碳原子之间或碳原子与其他原子之间相结合的化学键是 ( )
A.只有极性键 B.只有非极性键
C.有极性键和非极性键 D.只有离子键
【解析】选C。根据碳原子的成键特点,碳碳原子之间可形成非极性共价键,碳原子与其他原子之间则以极性共价键结合,C项正确。4、A、B两种烃的分子式均为C6H10,它们的分子中均无支链或侧链。
(1)A为环状结构,能跟溴发生加成反应,则A的结构简式是 。
(2)B分子为链状(分子中不存在—C=C=C—基团),它跟溴的1∶1加成产物可能有两种,则B的结构简式可能是
① ;
② 。【解析】本题要求根据有机化合物性质书写同分异构体。
(1)中A为环状结构,且能跟溴发生加成反应,说明含有碳碳双键。
(2)中B分子为链状,且跟溴的1∶1加成产物可能有两种,说明含
有两个碳碳双键,且不含有—C=C=C—基团。
答案:(1)
(2)①CH3—CH=CH—CH=CH—CH3
②CH2=CH—CH2—CH=CH—CH3【课堂总结】
一、有机物分子结构的表示方法二、同分异构体的书写及数目判断
1.同分异构体的书写方法:
(1)烷烃——减碳对称法:烷烃只存在碳链异构,书写时要注意全面而不重复,下面以C7H16为例,具体规则如下:
①将分子写成直链形式:CH3CH2CH2CH2CH2CH2CH3。
②从直链上去掉一个—CH3,依次连在剩余碳链中心对称线一侧的各个碳原子上。可得③再从主链上去掉一个碳,可形成一个—CH2CH3或两个—CH3。
当取代基为乙基时,即得 。当取代基为
两个甲基时,在主链上先定一个甲基,然后按照位置由近到远的
顺序依次移动另外一个甲基,注意不要重复,即④再从主链上去掉一个碳,可形成一个丙基,一个乙基与一个甲
基或三个甲基,其中当取代基为丙基或乙基与甲基时写出同分
异构体与前面写出的重复;当取代基为三个甲基时,即
上述书写方法可总结为成直链,一条线;摘一碳,挂中间;往边移,
不到端;摘多碳,整到散;多支链,同邻间。也可总结为主链由长
到短,支链由整到散,位置由心到边不到端。(2)官能团的位置异构的书写——先链后位:含有官能团的同分异构体的书写顺序一般为碳链异构→官能团位置异构→官能团类别异构。
以C5H10为例,写出烯烃范围内的同分异构体。
书写方法:先写出可能的碳链方式(只写碳骨架),再加上含有的官能团位置。
碳链结构:
位置异构:用箭头表示双键的位置。在(Ⅰ)中,双键可能加入的位置有
C—C—C—C=C、C—C—C=C—C;在(Ⅱ)中,双键可能加入的位
置有
在(Ⅲ)中,双键无法加入,因为碳只能形成四个键。
整理后得C5H10烯烃范围内的同分异构体有
CH3CH2CH2CH=CH2、CH3CH2CH=CHCH3、2.同分异构体的数目判断:
(1)基元法:如丁基有4种同分异构体,分别为
CH3—CH2—CH2—CH2—、 、
,则丁醇的同分异构体为4种。
(2)替代法:如二氯苯(C6H4Cl2)有3种同分异构体,则四氯苯
(C6H2Cl4)也有3种同分异构体(将H替代Cl)。(3)等效氢法。
①同一甲基上的氢是等效的。
②同一碳原子上所连甲基上的氢是等效的。如新戊烷
( )的四个甲基是等效的,所有的氢原子都是等效的,
故新戊烷的一氯代物只有一种。
③处于对称位置上的氢原子是等效的。如
的六个甲基是等效的,18个氢原子都是等效的,因此该物质的一
氯代物也只有一种。【作业布置】《高效作业本》课时提升练二
