内蒙古集宁一中西校区2024-2025学年高一下学期期末考试化学试卷(含答案)
文档属性
| 名称 | 内蒙古集宁一中西校区2024-2025学年高一下学期期末考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 705.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-18 15:46:56 | ||
图片预览



文档简介
2024-2025学年西校区高一下学期期末考试化学试卷
时间:75分钟 满分:100分
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Al 27
Cu 64
一、单选题(共15小题,每题3分)
1.“绿水青山就是金山银山”旨在引导社会各界自觉践行绿色生活,共建美丽中国。下列说法错误的是( )
A. 水中氮、磷元素过多,造成藻类疯长,消耗水中溶解氧,使水质恶化,会造成水华、赤潮等水体污染问题
B. 绿色化学的核心思想是改变“先污染后治理”的观念和做法,减少或消除产品在生产和应用中涉及的有害化学物质
C. 合理开发和利用金属资源可通过提高金属矿物的利用率、开发环保高效冶炼方法、防止金属腐蚀、加强废旧金属的回收和再利用、使用替代其他材料等途径
D. 、、、均是常见的大气污染物,主要来源于化石燃料的燃烧,可能造成酸雨、雾霾、光化学烟雾等污染
2.下列反应中,浓硫酸既表现强氧化性,又表现酸性的是( )
①2NaCl(固)+H2SO4(浓)Na2SO4+2HCl↑
②C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
③Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
④2FeO+4H2SO4(浓)Fe2(SO4)3+SO2↑+4H2O
A. ①② B. ③④ C. ①③ D. ②④
3.下列离子方程式与所给事实不相符的是( )
A. NaClO溶液中通入少量:
B. 向稀硝酸中加入铜片:
C. 利用覆铜板制作印刷电路板:
D. 溶液中滴加溶液:
4.“价—类”二维图是元素化合物学习的重要工具,部分含硫物质的分类与相应硫元素的化合价关系如图所示。下列说法不正确的是( )
A. 向a的溶液中通入c,出现黄色浑浊 B. d是一种二元强酸
C. 能用e的浓溶液干燥c气体 D. 盐g与盐f之间也可能发生反应
5.海水淡化时常用到蒸馏法,关于蒸馏,下列叙述不正确的是( )
A. 蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置
B. 蒸馏时的接收装置如图
C. 冷却水应该从冷凝管的下口进水上口出水
D. 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加
6.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是( )
A. ①②中Mg作负极,③④中Fe作负极
B. ①Al作正极,2H++2e-===H2↑
C. ②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑
D. ④中Cu作正极,电极反应式为O2+2H2O+4e-===4OH-
7.已知下列反应的能量变化示意图如图,有关说法正确的是( )
A. 1 mol S(g)与O2(g)完全反应生成SO2(g)放出的热量小于297.0 kJ
B. 在相同条件下,SO2(g)比SO3(g)稳定
C. 1 mol S(s)与足量O2(g)反应,最终转化为SO3(g)放出的热量为395.7 kJ
D. 2 mol SO2(g)和1 mol O2(g)充分反应后放出的热小于197.4 kJ
8.一定温度下,容积为的恒容密闭容器中发生气相反应,反应物和生成物的物质的量随时间变化的曲线如图所示。下列说法正确的是( )
A. 该反应的化学方程式为 B. 内,
C. 时,正逆反应速率均为0 D. 时,Y的转化率为50%
9.山梨酸是一种食品添加剂,对酵母、霉菌等许多真菌都具有抑制作用,还用于动物饲料、化妆品、药品、包装材料和橡胶助剂等,其结构简式为CH3CH==CHCH==CHCOOH。下列关于该有机物的说法错误的是( )
A. 山梨酸的分子式为C6H8O2 B. 山梨酸可使酸性高锰酸钾溶液褪色
C. 山梨酸可与NaHCO3发生反应 D. 1 mol山梨酸可与3 mol H2发生加成反应
10.下列实验描述与对应的解释或结论均正确的是( )
A. 向某溶液中滴加溶液,溶液变成红色,说明该溶液一定不含
B. 向白葡萄酒中滴入少量酸性溶液,红色褪去,说明白葡萄酒中含二氧化硫
C. 向蔗糖溶液中滴滴稀硫酸,煮沸几分钟,冷却后加入新制银氨溶液,水浴加热,无银镜产生,说明蔗糖未水解
D. 将铜与浓硫酸反应后的溶液冷却,缓缓注入盛有蒸馏水的烧杯中,并不断搅拌,溶液呈蓝色,说明溶液中含有
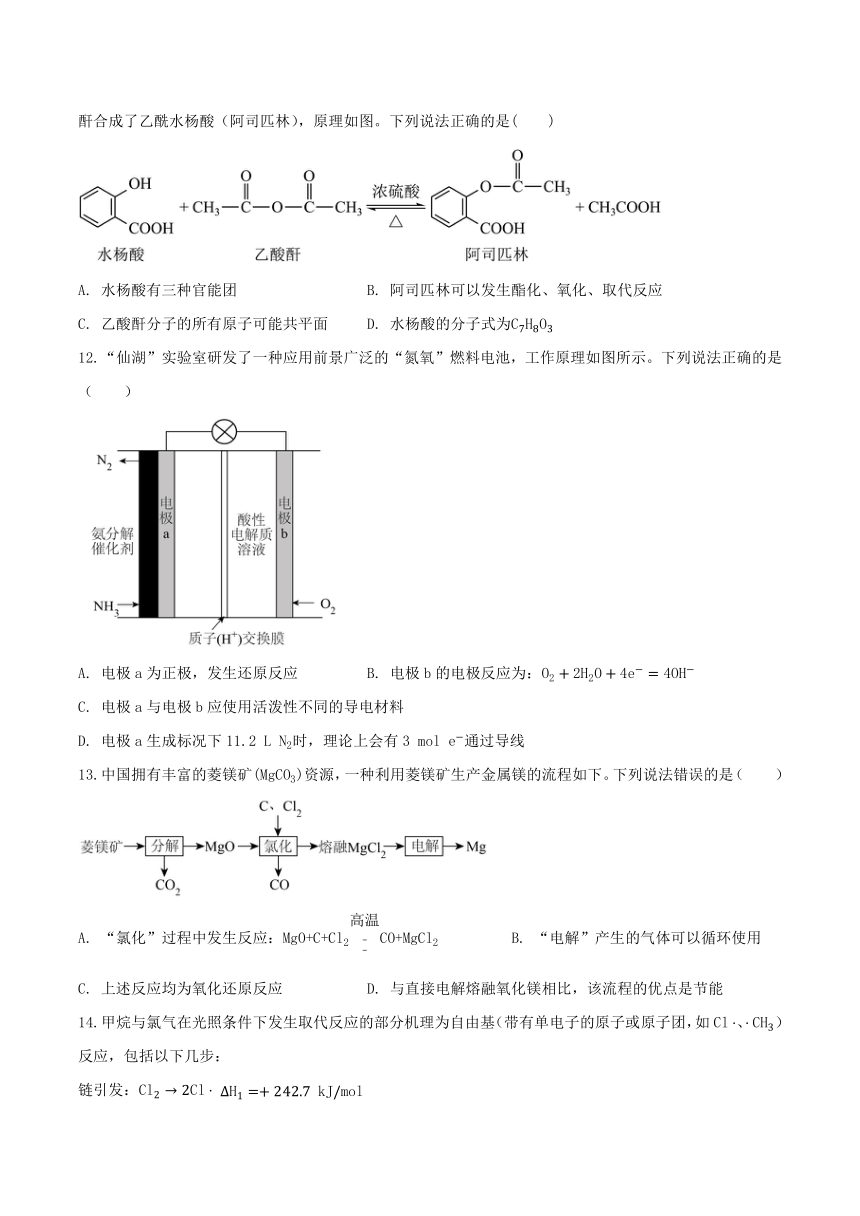
11.阿司匹林具有解热镇痛的作用,早在1853年夏尔弗雷德里克,热拉尔(Gerhardl)就用水杨酸与乙酸酐合成了乙酰水杨酸(阿司匹林),原理如图。下列说法正确的是( )
A. 水杨酸有三种官能团 B. 阿司匹林可以发生酯化、氧化、取代反应
C. 乙酸酐分子的所有原子可能共平面 D. 水杨酸的分子式为
12.“仙湖”实验室研发了一种应用前景广泛的“氮氧”燃料电池,工作原理如图所示。下列说法正确的是( )
A. 电极a为正极,发生还原反应 B. 电极b的电极反应为:
C. 电极a与电极b应使用活泼性不同的导电材料
D. 电极a生成标况下11.2 L 时,理论上会有3 mol 通过导线
13.中国拥有丰富的菱镁矿()资源,一种利用菱镁矿生产金属镁的流程如下。下列说法错误的是( )
A. “氯化”过程中发生反应: B. “电解”产生的气体可以循环使用
C. 上述反应均为氧化还原反应 D. 与直接电解熔融氧化镁相比,该流程的优点是节能
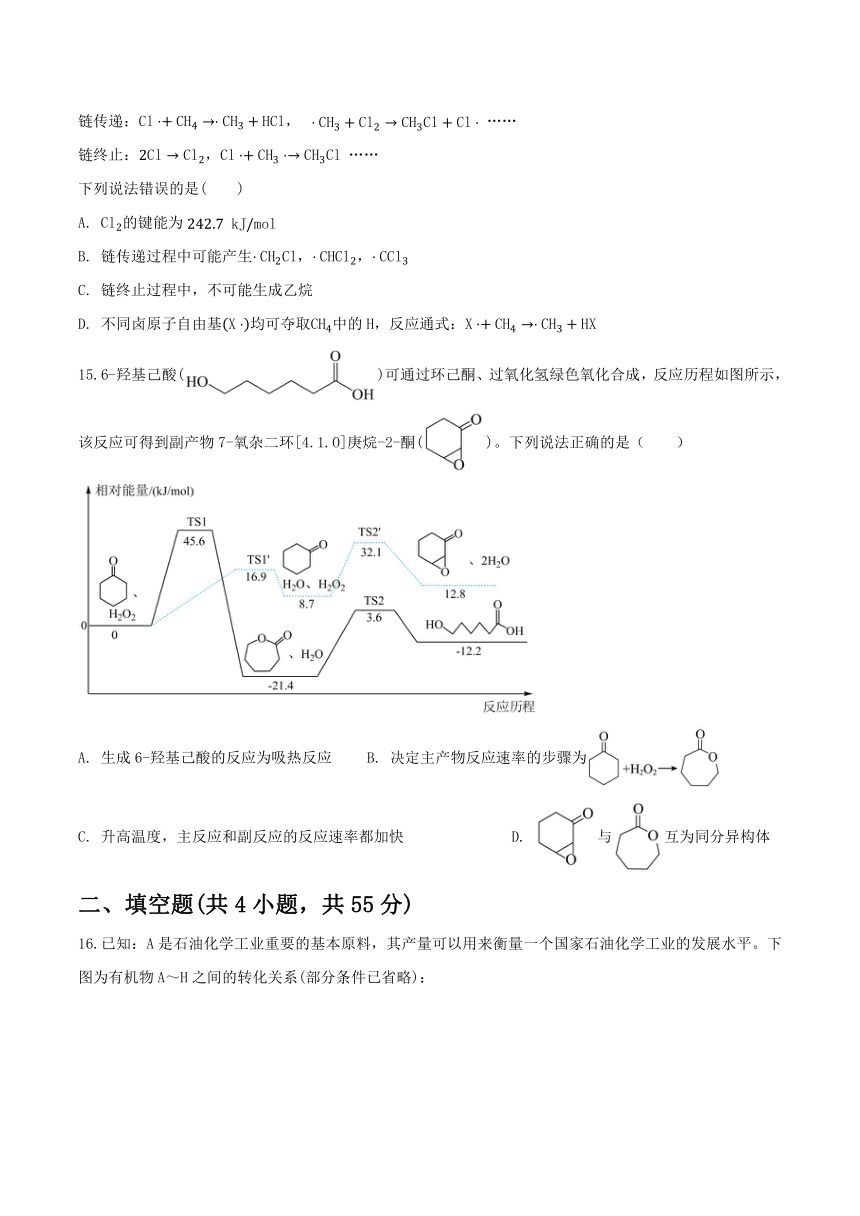
14.甲烷与氯气在光照条件下发生取代反应的部分机理为自由基(带有单电子的原子或原子团,如、)反应,包括以下几步:
链引发:
链传递:, ……
链终止:, ……
下列说法错误的是( )
A. 的键能为
B. 链传递过程中可能产生,,
C. 链终止过程中,不可能生成乙烷
D. 不同卤原子自由基均可夺取中的,反应通式:
15.6-羟基己酸()可通过环己酮、过氧化氢绿色氧化合成,反应历程如图所示,该反应可得到副产物7-氧杂二环[4.1.O]庚烷-2-酮()。下列说法正确的是( )
A. 生成6-羟基己酸的反应为吸热反应 B. 决定主产物反应速率的步骤为
C. 升高温度,主反应和副反应的反应速率都加快 D. 与互为同分异构体
二、填空题(共4小题,共55分)
16.已知:A是石油化学工业重要的基本原料,其产量可以用来衡量一个国家石油化学工业的发展水平。下图为有机物A~H之间的转化关系(部分条件已省略):
回答下列问题:
(1)A的结构式为 ,E中官能团的名称为 。
(2)A→C的反应类型为 。
(3)D→E的化学方程式为 。
(4)下列物质中能用来鉴别D和F的是_______(填标号)。
A.水 B.碳酸钠溶液 C.紫色石蕊试液 D.铁粉
(5)H是一种高分子化合物,其结构简式为 。
(6)G是一种具有香味的液体,的化学方程式为 。
(7)物质J与C互为同系物,且相对分子质量比C大14,则J的结构简式可能为: (写出2种)。
17.运用化学反应原理研究化学反应有重要的意义。请回答下列问题:
(1)一种新型催化剂能使和发生反应:。已知增大催化剂的比表面积可提高反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
①表中a= 。
②能验证温度对化学反应速率影响规律的是实验 (填编号)。
③实验Ⅰ和实验Ⅱ中,的物质的量浓度[]随时间()的变化曲线如图所示,其中表示实验Ⅱ的是曲线 (填“甲”或“乙”)。
(2)某种利用硫化氢气体生产硫黄的工艺为。在2 L恒容密闭容器中充入发生反应,时测得气体质量减少了。
①前20 min内平均反应速率 。
②下列曲线表示反应中某物理量随时间的变化,其中错误的是 (填字母)。
(3)如图是探究不同条件下化学能转变为电能的装置。
①当电极为、电极为、电解质溶液为稀硫酸时,正极的电极反应式为 ;当电路中有电子通过时,负极的质量减少 。
②当电极为、电极为、电解质溶液为氢氧化钠溶液时,该装置的正极材料为 (填化学式),外电路中电子的移动方向为 (填“”或“”)。
18.工业上由黄铜矿(主要成分为)冶炼铜和制备硫酸的生产流程如图所示:
已知:冰铜主要成分是、,泡铜主要成分是、。
回答下列问题:
(1)提高黄铜矿焙烧利用率的措施有 (答两条)。
(2)“焙烧Ⅱ”被称为“火法炼铜”,转化为,继续与反应生成,写出与反应的化学方程式: 。
(3)“铝热反应”中,每消耗1 mol铝,理论上可以获得 g铜。
(4)写出“氧化”步骤发生反应的化学方程式: 。
19.Ⅰ.氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中制备NH3,回答下列问题:
(1)氨气的发生装置可以选择上图中的________(填字母),反应的化学方程式为________________________________________________________________________。
(2)欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为发生装置→______→______→_______→_______→_______(按气流方向,用小写字母表示)。
Ⅱ.亚硝酰氯(NOCl)是一种黄色气体,沸点为-5.5 ℃。其液体呈红褐色。遇水发生反应:2NOCl+H2O===2HCl+NO+NO2。某化学兴趣小组设计如图装置用Cl2和NO制备NOCl。回答下列相关问题:
(3)甲装置发生反应的离子方程式为_______________________________________________,装置丙中的液体为_____________________________________________________________。
(4)实验时,先通入Cl2,待丁中烧瓶内充满黄绿色气体时,再通入NO,这样做的目的是________________________________________________________________________。
(5)装置丁中冰盐水的作用是____________________。
(6)经分析该套装置设计上有一处明显缺陷,改进方法是____________________(用文字描述)。
(7)吸收尾气时,NOCl发生反应的化学方程式为__________________________(已知:NO+NO2+2NaOH===2NaNO2+H2O)。
一、单选题
1.【答案】D
2.【答案】B
3.【答案】A
4.【答案】B
5.【答案】B
6.【答案】A
7.【答案】D
8.【答案】B
9.【答案】D
10.【答案】D
11.【答案】B
12.【答案】D
13.【答案】C
14.【答案】C
15.【答案】C
二、填空题
16.【答案】(1) 醛基
(2)加成反应
(3)
(4)BCD
(5)
(6)
(7)、
17.【答案】(1)① ②Ⅰ和Ⅲ ③乙
(2)①0.0125 ②AC
(3)① 1.8 ②Al
18.【答案】(1)黄铜矿粉碎、通入足量的空气
(2)
(3)192
(4)
19.【答案】(1)A Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O(或B NH3·H2ONH3↑+H2O)
(2)d c f e i
(3)MnO2+4H++2Cl-Cl2↑+Mn2++2H2O 浓硫酸
(4)排尽装置中的空气,避免NO被氧化
(5)液化亚硝酰氯,便于收集产品
(6)在装置丁和戊之间增加一个气体干燥装置
(7)NOCl+2NaOH===NaCl+NaNO2+H2O
时间:75分钟 满分:100分
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Al 27
Cu 64
一、单选题(共15小题,每题3分)
1.“绿水青山就是金山银山”旨在引导社会各界自觉践行绿色生活,共建美丽中国。下列说法错误的是( )
A. 水中氮、磷元素过多,造成藻类疯长,消耗水中溶解氧,使水质恶化,会造成水华、赤潮等水体污染问题
B. 绿色化学的核心思想是改变“先污染后治理”的观念和做法,减少或消除产品在生产和应用中涉及的有害化学物质
C. 合理开发和利用金属资源可通过提高金属矿物的利用率、开发环保高效冶炼方法、防止金属腐蚀、加强废旧金属的回收和再利用、使用替代其他材料等途径
D. 、、、均是常见的大气污染物,主要来源于化石燃料的燃烧,可能造成酸雨、雾霾、光化学烟雾等污染
2.下列反应中,浓硫酸既表现强氧化性,又表现酸性的是( )
①2NaCl(固)+H2SO4(浓)Na2SO4+2HCl↑
②C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
③Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
④2FeO+4H2SO4(浓)Fe2(SO4)3+SO2↑+4H2O
A. ①② B. ③④ C. ①③ D. ②④
3.下列离子方程式与所给事实不相符的是( )
A. NaClO溶液中通入少量:
B. 向稀硝酸中加入铜片:
C. 利用覆铜板制作印刷电路板:
D. 溶液中滴加溶液:
4.“价—类”二维图是元素化合物学习的重要工具,部分含硫物质的分类与相应硫元素的化合价关系如图所示。下列说法不正确的是( )
A. 向a的溶液中通入c,出现黄色浑浊 B. d是一种二元强酸
C. 能用e的浓溶液干燥c气体 D. 盐g与盐f之间也可能发生反应
5.海水淡化时常用到蒸馏法,关于蒸馏,下列叙述不正确的是( )
A. 蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置
B. 蒸馏时的接收装置如图
C. 冷却水应该从冷凝管的下口进水上口出水
D. 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加
6.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是( )
A. ①②中Mg作负极,③④中Fe作负极
B. ①Al作正极,2H++2e-===H2↑
C. ②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑
D. ④中Cu作正极,电极反应式为O2+2H2O+4e-===4OH-
7.已知下列反应的能量变化示意图如图,有关说法正确的是( )
A. 1 mol S(g)与O2(g)完全反应生成SO2(g)放出的热量小于297.0 kJ
B. 在相同条件下,SO2(g)比SO3(g)稳定
C. 1 mol S(s)与足量O2(g)反应,最终转化为SO3(g)放出的热量为395.7 kJ
D. 2 mol SO2(g)和1 mol O2(g)充分反应后放出的热小于197.4 kJ
8.一定温度下,容积为的恒容密闭容器中发生气相反应,反应物和生成物的物质的量随时间变化的曲线如图所示。下列说法正确的是( )
A. 该反应的化学方程式为 B. 内,
C. 时,正逆反应速率均为0 D. 时,Y的转化率为50%
9.山梨酸是一种食品添加剂,对酵母、霉菌等许多真菌都具有抑制作用,还用于动物饲料、化妆品、药品、包装材料和橡胶助剂等,其结构简式为CH3CH==CHCH==CHCOOH。下列关于该有机物的说法错误的是( )
A. 山梨酸的分子式为C6H8O2 B. 山梨酸可使酸性高锰酸钾溶液褪色
C. 山梨酸可与NaHCO3发生反应 D. 1 mol山梨酸可与3 mol H2发生加成反应
10.下列实验描述与对应的解释或结论均正确的是( )
A. 向某溶液中滴加溶液,溶液变成红色,说明该溶液一定不含
B. 向白葡萄酒中滴入少量酸性溶液,红色褪去,说明白葡萄酒中含二氧化硫
C. 向蔗糖溶液中滴滴稀硫酸,煮沸几分钟,冷却后加入新制银氨溶液,水浴加热,无银镜产生,说明蔗糖未水解
D. 将铜与浓硫酸反应后的溶液冷却,缓缓注入盛有蒸馏水的烧杯中,并不断搅拌,溶液呈蓝色,说明溶液中含有
11.阿司匹林具有解热镇痛的作用,早在1853年夏尔弗雷德里克,热拉尔(Gerhardl)就用水杨酸与乙酸酐合成了乙酰水杨酸(阿司匹林),原理如图。下列说法正确的是( )
A. 水杨酸有三种官能团 B. 阿司匹林可以发生酯化、氧化、取代反应
C. 乙酸酐分子的所有原子可能共平面 D. 水杨酸的分子式为
12.“仙湖”实验室研发了一种应用前景广泛的“氮氧”燃料电池,工作原理如图所示。下列说法正确的是( )
A. 电极a为正极,发生还原反应 B. 电极b的电极反应为:
C. 电极a与电极b应使用活泼性不同的导电材料
D. 电极a生成标况下11.2 L 时,理论上会有3 mol 通过导线
13.中国拥有丰富的菱镁矿()资源,一种利用菱镁矿生产金属镁的流程如下。下列说法错误的是( )
A. “氯化”过程中发生反应: B. “电解”产生的气体可以循环使用
C. 上述反应均为氧化还原反应 D. 与直接电解熔融氧化镁相比,该流程的优点是节能
14.甲烷与氯气在光照条件下发生取代反应的部分机理为自由基(带有单电子的原子或原子团,如、)反应,包括以下几步:
链引发:
链传递:, ……
链终止:, ……
下列说法错误的是( )
A. 的键能为
B. 链传递过程中可能产生,,
C. 链终止过程中,不可能生成乙烷
D. 不同卤原子自由基均可夺取中的,反应通式:
15.6-羟基己酸()可通过环己酮、过氧化氢绿色氧化合成,反应历程如图所示,该反应可得到副产物7-氧杂二环[4.1.O]庚烷-2-酮()。下列说法正确的是( )
A. 生成6-羟基己酸的反应为吸热反应 B. 决定主产物反应速率的步骤为
C. 升高温度,主反应和副反应的反应速率都加快 D. 与互为同分异构体
二、填空题(共4小题,共55分)
16.已知:A是石油化学工业重要的基本原料,其产量可以用来衡量一个国家石油化学工业的发展水平。下图为有机物A~H之间的转化关系(部分条件已省略):
回答下列问题:
(1)A的结构式为 ,E中官能团的名称为 。
(2)A→C的反应类型为 。
(3)D→E的化学方程式为 。
(4)下列物质中能用来鉴别D和F的是_______(填标号)。
A.水 B.碳酸钠溶液 C.紫色石蕊试液 D.铁粉
(5)H是一种高分子化合物,其结构简式为 。
(6)G是一种具有香味的液体,的化学方程式为 。
(7)物质J与C互为同系物,且相对分子质量比C大14,则J的结构简式可能为: (写出2种)。
17.运用化学反应原理研究化学反应有重要的意义。请回答下列问题:
(1)一种新型催化剂能使和发生反应:。已知增大催化剂的比表面积可提高反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
①表中a= 。
②能验证温度对化学反应速率影响规律的是实验 (填编号)。
③实验Ⅰ和实验Ⅱ中,的物质的量浓度[]随时间()的变化曲线如图所示,其中表示实验Ⅱ的是曲线 (填“甲”或“乙”)。
(2)某种利用硫化氢气体生产硫黄的工艺为。在2 L恒容密闭容器中充入发生反应,时测得气体质量减少了。
①前20 min内平均反应速率 。
②下列曲线表示反应中某物理量随时间的变化,其中错误的是 (填字母)。
(3)如图是探究不同条件下化学能转变为电能的装置。
①当电极为、电极为、电解质溶液为稀硫酸时,正极的电极反应式为 ;当电路中有电子通过时,负极的质量减少 。
②当电极为、电极为、电解质溶液为氢氧化钠溶液时,该装置的正极材料为 (填化学式),外电路中电子的移动方向为 (填“”或“”)。
18.工业上由黄铜矿(主要成分为)冶炼铜和制备硫酸的生产流程如图所示:
已知:冰铜主要成分是、,泡铜主要成分是、。
回答下列问题:
(1)提高黄铜矿焙烧利用率的措施有 (答两条)。
(2)“焙烧Ⅱ”被称为“火法炼铜”,转化为,继续与反应生成,写出与反应的化学方程式: 。
(3)“铝热反应”中,每消耗1 mol铝,理论上可以获得 g铜。
(4)写出“氧化”步骤发生反应的化学方程式: 。
19.Ⅰ.氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中制备NH3,回答下列问题:
(1)氨气的发生装置可以选择上图中的________(填字母),反应的化学方程式为________________________________________________________________________。
(2)欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为发生装置→______→______→_______→_______→_______(按气流方向,用小写字母表示)。
Ⅱ.亚硝酰氯(NOCl)是一种黄色气体,沸点为-5.5 ℃。其液体呈红褐色。遇水发生反应:2NOCl+H2O===2HCl+NO+NO2。某化学兴趣小组设计如图装置用Cl2和NO制备NOCl。回答下列相关问题:
(3)甲装置发生反应的离子方程式为_______________________________________________,装置丙中的液体为_____________________________________________________________。
(4)实验时,先通入Cl2,待丁中烧瓶内充满黄绿色气体时,再通入NO,这样做的目的是________________________________________________________________________。
(5)装置丁中冰盐水的作用是____________________。
(6)经分析该套装置设计上有一处明显缺陷,改进方法是____________________(用文字描述)。
(7)吸收尾气时,NOCl发生反应的化学方程式为__________________________(已知:NO+NO2+2NaOH===2NaNO2+H2O)。
一、单选题
1.【答案】D
2.【答案】B
3.【答案】A
4.【答案】B
5.【答案】B
6.【答案】A
7.【答案】D
8.【答案】B
9.【答案】D
10.【答案】D
11.【答案】B
12.【答案】D
13.【答案】C
14.【答案】C
15.【答案】C
二、填空题
16.【答案】(1) 醛基
(2)加成反应
(3)
(4)BCD
(5)
(6)
(7)、
17.【答案】(1)① ②Ⅰ和Ⅲ ③乙
(2)①0.0125 ②AC
(3)① 1.8 ②Al
18.【答案】(1)黄铜矿粉碎、通入足量的空气
(2)
(3)192
(4)
19.【答案】(1)A Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O(或B NH3·H2ONH3↑+H2O)
(2)d c f e i
(3)MnO2+4H++2Cl-Cl2↑+Mn2++2H2O 浓硫酸
(4)排尽装置中的空气,避免NO被氧化
(5)液化亚硝酰氯,便于收集产品
(6)在装置丁和戊之间增加一个气体干燥装置
(7)NOCl+2NaOH===NaCl+NaNO2+H2O
同课章节目录
