常见的酸及酸的通性
图片预览



文档简介
课件12张PPT。课题1 常见的酸和碱一、酸、碱、盐的定义1、酸:H+酸根的化合物。
如:HCl H2SO4 H2CO3
2、碱:金属+OH的化合物。如:NaOH Ca(O H)2
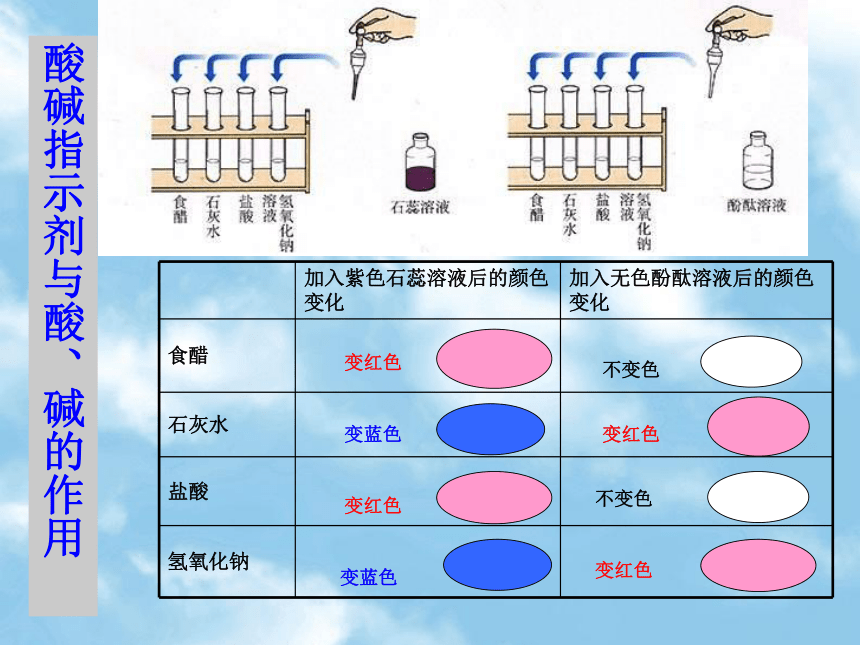
3、盐:金属离子+酸根离子的化合物。如:NaCl CuSO4实验探究:向溶液中加入酸碱指示剂酸碱指示剂与酸、碱的作用二、酸碱指示剂小结:
1、酸碱指示剂(简称指示剂):遇酸或碱的溶液能显示不同颜色的物质。如紫色石蕊,无色酚酞。
2、指示剂的作用:能检验溶液的酸性或碱性
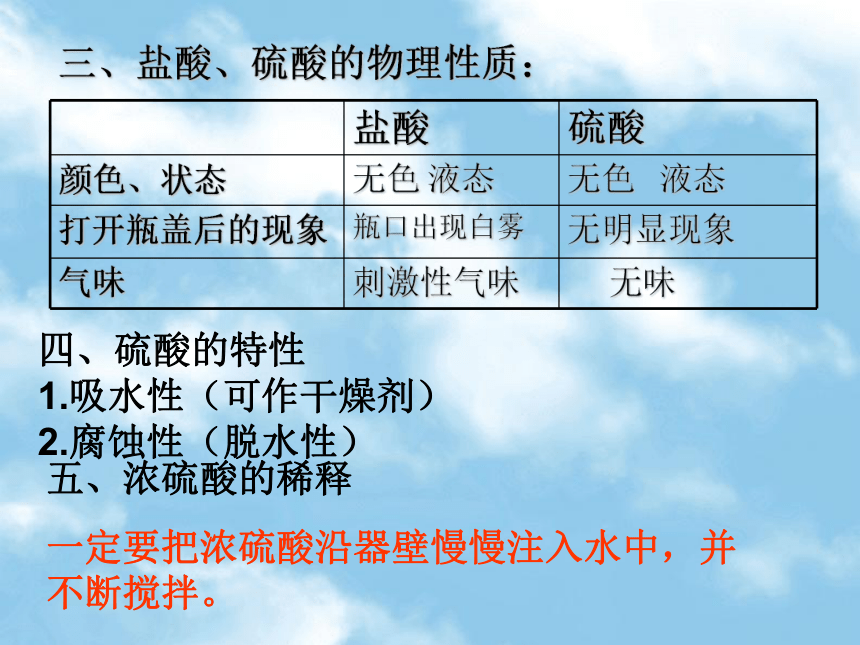
3、指示剂的变色规律:三、盐酸、硫酸的物理性质:四、硫酸的特性
1.吸水性(可作干燥剂)
2.腐蚀性(脱水性)五、浓硫酸的稀释
一定要把浓硫酸沿器壁慢慢注入水中,并不断搅拌。一、与酸碱指示剂反应二、与活泼金属反应三、与碱性氧化物反应四、与碱反应五、与盐发生复分解反应稀硫酸石蕊实验一:往稀硫酸中加入石蕊结论:稀硫酸可使石蕊指示剂变红锌粒稀硫酸实验二:往锌粒中加入稀硫酸结论:硫酸可与排在金属活动顺序表中H前面的金属反应方程式:
H2SO4+Zn=ZnSO4+H2实验三:往带锈铁钉中滴入稀硫酸溶液稀硫酸带锈铁钉结论:硫酸可与碱
性氧化物反应生成盐
和水反应方程式: 3H2SO4+Fe2O3=Fe2(SO4)3+3H2O稀硫酸酚酞 NaOH溶液实验四:往酚酞NaOH溶液中滴入稀硫酸溶液结论:硫酸可与碱反应生成盐和水反应方程式:
H2SO4+2NaOH=Na2SO4+2H2O稀硫酸BaCl2溶液实验五 :往稀硫酸溶液中滴入氯化钡溶液结论:硫酸可与盐发生复分解反应,生成盐和水。反应方程式: H2SO4+BaCl2=BaSO4↓+H2O
HCl + AgNO3=AgCl+HNO3↓
如:HCl H2SO4 H2CO3
2、碱:金属+OH的化合物。如:NaOH Ca(O H)2
3、盐:金属离子+酸根离子的化合物。如:NaCl CuSO4实验探究:向溶液中加入酸碱指示剂酸碱指示剂与酸、碱的作用二、酸碱指示剂小结:
1、酸碱指示剂(简称指示剂):遇酸或碱的溶液能显示不同颜色的物质。如紫色石蕊,无色酚酞。
2、指示剂的作用:能检验溶液的酸性或碱性
3、指示剂的变色规律:三、盐酸、硫酸的物理性质:四、硫酸的特性
1.吸水性(可作干燥剂)
2.腐蚀性(脱水性)五、浓硫酸的稀释
一定要把浓硫酸沿器壁慢慢注入水中,并不断搅拌。一、与酸碱指示剂反应二、与活泼金属反应三、与碱性氧化物反应四、与碱反应五、与盐发生复分解反应稀硫酸石蕊实验一:往稀硫酸中加入石蕊结论:稀硫酸可使石蕊指示剂变红锌粒稀硫酸实验二:往锌粒中加入稀硫酸结论:硫酸可与排在金属活动顺序表中H前面的金属反应方程式:
H2SO4+Zn=ZnSO4+H2实验三:往带锈铁钉中滴入稀硫酸溶液稀硫酸带锈铁钉结论:硫酸可与碱
性氧化物反应生成盐
和水反应方程式: 3H2SO4+Fe2O3=Fe2(SO4)3+3H2O稀硫酸酚酞 NaOH溶液实验四:往酚酞NaOH溶液中滴入稀硫酸溶液结论:硫酸可与碱反应生成盐和水反应方程式:
H2SO4+2NaOH=Na2SO4+2H2O稀硫酸BaCl2溶液实验五 :往稀硫酸溶液中滴入氯化钡溶液结论:硫酸可与盐发生复分解反应,生成盐和水。反应方程式: H2SO4+BaCl2=BaSO4↓+H2O
HCl + AgNO3=AgCl+HNO3↓
