2.2 物质的制备 课件 (2)
文档属性
| 名称 | 2.2 物质的制备 课件 (2) |

|
|
| 格式 | zip | ||
| 文件大小 | 680.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 00:00:00 | ||
图片预览








文档简介
课件28张PPT。第二单元
课题二 物质的制备一.制备物质的一般的方法思考与交流:
1.能够通过化学反应产生二氧化碳气体的物质有哪些?①CaCO3+HCl ②CaCO3
③Na2CO3+H2SO4 ④NaHCO3
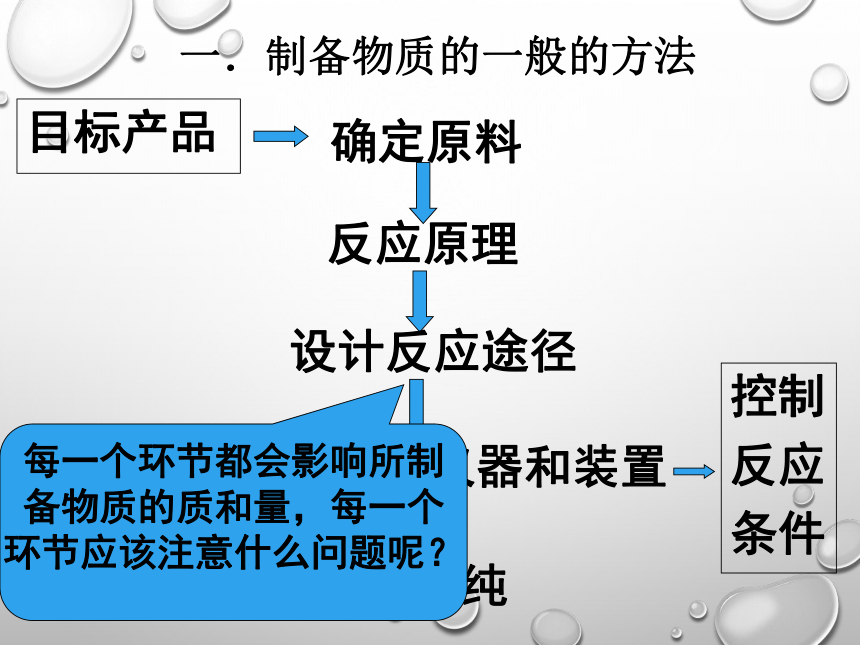
⑤C+O2 ⑥CxHyOz+O2一.制备物质的一般的方法2.制取CO2气体的实验中,以什么物质为反应物(原料)?为什么?CaCO3+HCl3.反应的装置是如何选择和安装的?一.制备物质的一般的方法4.如果要制备干燥的气体产物,应如何设计装置?酸性:浓硫酸、P2O5、硅胶一.制备物质的一般的方法确定原料反应原理设计反应途径选择合理的仪器和装置分离提纯控制
反应
条件目标产品每一个环节都会影响所制备物质的质和量,每一个环节应该注意什么问题呢?1.确定原料目标产物原料:含有“子结构”Cl2NaCl:含有“Cl”原料也可以是一些废弃物:
如:可以选择适当的催化剂和温度,
使泡沫塑料降解,得到燃料油和燃气
【实践活动】P231.确定原料2.设计反应路径用铜制取硝酸铜的最佳方案: (1 )根据提高原子利用率、减少环境污染、简化操作的原则 ,选择最佳反应路线。例如 : ①铜 +浓硝酸 ②铜 +稀硝酸
③铜 +氧→氧化铜 ;
氧化铜 +硝酸→硝酸铜3.优化条件分析P24“实践活动”,试剂和用量都相同时,操作方法不同,现象和结果有何异同?⑴Al3++3OH-=Al(OH)3↓
⑵Al3++4OH-=AlO2-+2H2O
⑶3AlO2- + Al3+ + 6H2O =4Al(OH)3↓小结设计物质制备的实验方案时,应该遵循的优化原则是:原料廉价,原理绿色,
条件优化,仪器简单,
分离方便。硫酸亚铁铵的制备实验原理:亚铁盐在空气中易被氧化,但形成复盐硫酸亚铁铵FeSO4·(NH4)2SO4·6H2O后可稳定存在。
FeSO4 + (NH4)2SO4 + 6H2O =
FeSO4·(NH4)2SO4·6H2O
而硫酸亚铁可由铁屑和稀硫酸反应制得。
Fe + H2SO4 = FeSO4 + H2↑流程图:废铁屑废铁屑①10%碳酸
钠处理②过滤15mL
3mol/L硫酸硫酸
亚铁④过滤③水浴加热硫酸
亚铁硫酸铵⑤蒸发
结晶硫酸亚铁铵计算产率:
计算得理论产量应为为19.6g。实际称得产品约12.2g 。产率约为62% 。不过因为产品是用滤纸压干,会混有水份,实际产率应更低些。实验体会:
1. 制备硫酸亚铁时要保持铁过量,水浴加热。
2. 硫酸亚铁铵的制备:加入硫酸铵后,应使其充分溶解后再往下进行。这样有利于保证产品的纯度。蒸发时要缓缓加热,以防局部过热。
3. 实验过程中应保持足够的酸度。如果溶液的酸性减弱,则亚铁盐(或铁盐)中Fe2+与水作用的程度将会增大。在制备(NH4)2SO4·FeSO4·6H2O过程中,为了使Fe2+ 不与水作用,溶液需要保持足够的酸度。
1.能够通过化学反应产生二氧化碳气体的物质有哪些?①CaCO3+HCl ②CaCO3
③Na2CO3+H2SO4 ④NaHCO3
⑤C+O2 ⑥CxHyOz+O2一.制备物质的一般的方法2.制取CO2气体的实验中,以什么物质为反应物(原料)?为什么?CaCO3+HCl3.反应的装置是如何选择和安装的?一.制备物质的一般的方法4.如果要制备干燥的气体产物,应如何设计装置?酸性:浓硫酸、P2O5、硅胶一.制备物质的一般的方法确定原料反应原理设计反应途径选择合理的仪器和装置分离提纯控制
反应
条件目标产品每一个环节都会影响所制备物质的质和量,每一个环节应该注意什么问题呢?1.确定原料目标产物原料:含有“子结构”Cl2NaCl:含有“Cl”原料也可以是一些废弃物:
如:可以选择适当的催化剂和温度,
使泡沫塑料降解,得到燃料油和燃气
【实践活动】P231.确定原料2.设计反应路径用铜制取硝酸铜的最佳方案: (1 )根据提高原子利用率、减少环境污染、简化操作的原则 ,选择最佳反应路线。例如 : ①铜 +浓硝酸 ②铜 +稀硝酸
③铜 +氧→氧化铜 ;
氧化铜 +硝酸→硝酸铜3.优化条件分析P24“实践活动”,试剂和用量都相同时,操作方法不同,现象和结果有何异同?⑴Al3++3OH-=Al(OH)3↓
⑵Al3++4OH-=AlO2-+2H2O
⑶3AlO2- + Al3+ + 6H2O =4Al(OH)3↓小结设计物质制备的实验方案时,应该遵循的优化原则是:原料廉价,原理绿色,
条件优化,仪器简单,
分离方便。硫酸亚铁铵的制备实验原理:亚铁盐在空气中易被氧化,但形成复盐硫酸亚铁铵FeSO4·(NH4)2SO4·6H2O后可稳定存在。
FeSO4 + (NH4)2SO4 + 6H2O =
FeSO4·(NH4)2SO4·6H2O
而硫酸亚铁可由铁屑和稀硫酸反应制得。
Fe + H2SO4 = FeSO4 + H2↑流程图:废铁屑废铁屑①10%碳酸
钠处理②过滤15mL
3mol/L硫酸硫酸
亚铁④过滤③水浴加热硫酸
亚铁硫酸铵⑤蒸发
结晶硫酸亚铁铵计算产率:
计算得理论产量应为为19.6g。实际称得产品约12.2g 。产率约为62% 。不过因为产品是用滤纸压干,会混有水份,实际产率应更低些。实验体会:
1. 制备硫酸亚铁时要保持铁过量,水浴加热。
2. 硫酸亚铁铵的制备:加入硫酸铵后,应使其充分溶解后再往下进行。这样有利于保证产品的纯度。蒸发时要缓缓加热,以防局部过热。
3. 实验过程中应保持足够的酸度。如果溶液的酸性减弱,则亚铁盐(或铁盐)中Fe2+与水作用的程度将会增大。在制备(NH4)2SO4·FeSO4·6H2O过程中,为了使Fe2+ 不与水作用,溶液需要保持足够的酸度。
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
