2.1 物质的分离和提纯 课件 (6)
文档属性
| 名称 | 2.1 物质的分离和提纯 课件 (6) |

|
|
| 格式 | zip | ||
| 文件大小 | 425.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 00:00:00 | ||
图片预览








文档简介
课件24张PPT。物质的分离和提纯学习策略1、对课本中出现过的每一个基本实验均应详尽复习,搞清楚每一个实验的原理、操作过程、反应现象、原因、结论、注意事项。
2、对实验中经常碰到的一些装置或操作应适当的进行归纳和延伸。
3、重视研究性实验试题的开发与训练,将一些操作简单、时间短、污染少的验证实验改为探究实验。让同学自己动手体验探究的全过程。
第一章:物质的分离和提纯物质的分离:利用物理或化学方法将混合物的各种成分分开
物质的提纯:除去杂质主要是利用化学反应把杂质转化为气体或不溶物(有时恰好相反)而分离除去(去除法),或把杂质转化为所需物质(转化法),但应注意不能因加入试剂又引入新的杂质。即:目的:原则:“不增、不减、易分、复原”(1)不增加新的杂质,
(2)不减少主要成分的含量,
(3)操作方法简单,易于进行分离,
(4)如果将主要成分进行了转化,最后要能将其还原转来。
物质的分离和提纯1固—固混合分离型(1)热分解法或升华:
(2)结晶(重结晶):据溶解度,分离两种及以上可溶性固体2固—液混合分离型(3)过滤:分离不溶性固体与液体
(4)蒸发:蒸干或蒸发至一定程度后降温结晶
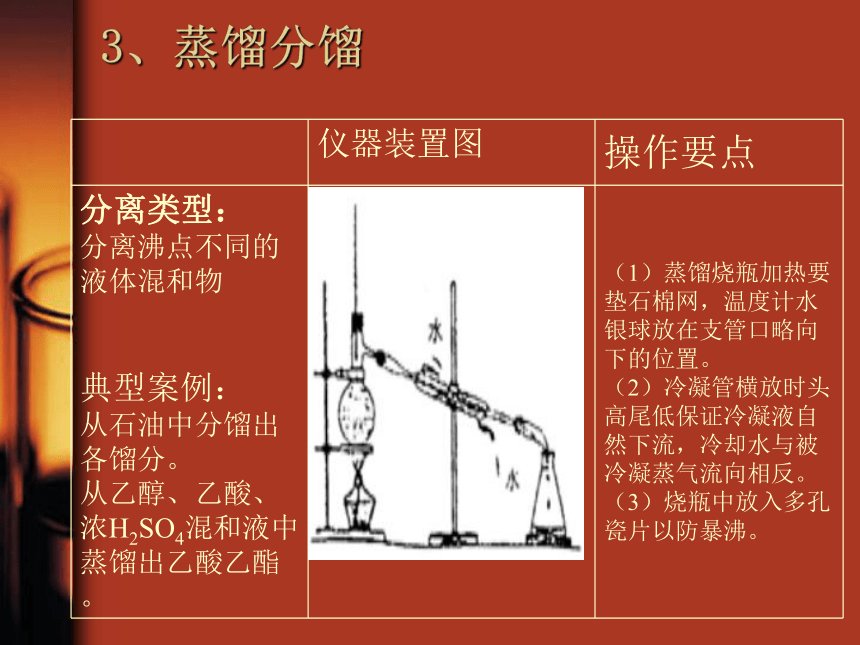
(5)盐析:用于获取肥皂及蛋白质的分离提纯物质的分离和提纯3液—液混合分离型(6)蒸馏(分馏):利用沸点不同分离混合物
(7)渗析:分离胶体和溶液
(8)萃取和分液4气—气混合分离型(9)洗气1、过滤分离类型:固体(不溶)一液体分离
典型案例:除去粗盐中的泥沙 (1)对折法折叠滤纸后紧贴漏斗壁,用水打湿不出气泡为止,滤纸边缘低于漏斗;过滤时加入漏斗的溶液面低于滤纸边缘,即“一贴两低三靠”。
(2)过滤时:烧杯嘴与玻璃棒接触;玻璃棒与三层滤纸处相接触;漏斗嘴紧靠玻璃烧杯壁。
(3)加水,水面高于沉淀,浸洗三次,达到净化沉淀。 2、蒸发结晶(重结晶) 3、蒸馏分馏 4、萃取分液 5、洗气 6、渗析 渗析——用于分离胶体和溶液的一种方法 以提纯Fe(OH)3 胶体为例,说明如何证明胶体中已无杂质?7、加热 8、升华 9、盐析胶体从混和物中分离出来。例:硬脂酸钠溶液中加入食盐细粒;鸡蛋白溶液中加入饱和溶液 10、离子交换 11、色谱法常见的物质分离操作实验:
化学常见分离与提纯案例案例1:硝酸钾晶体的制备
分离方法选择:
研究硝酸钾/粗盐中杂质的状态(S)
可用方法选择(固-固)
热分解/升华或都是结晶(重结晶)
再研究,硝酸钾不符合热分解升华法的要求,故选择结晶(重结晶法
化学常见分离与提纯案例案例2:海带中碘元素的分离及检验
碘单质固体,
升华法可行。
海带中以I-存在,要分离出I-就需要除去海带中的有机物,留下无机物。
无机物溶于水形成溶液(I-)
要生成I2,则需要加入氧化剂(不引入新杂质)
这就由S—S分离→
选用的是萃取-分液/蒸馏法
得到仍是碘的四氯化碳溶液
再用分馏法进行分离。
是否可用S-S分离方法?(灼烧)H2O2液-液分离。化学常见分离与提纯案例案例3:用纸层析法分离铁离子和铜离子
一般情况下选用的是化学方法。
物理方法:色谱分析法(少量物质,更多的是用于物质鉴别方面)
原理:利用不同物质在展开剂中流动和扩张速率不同。
如果有色,直接呈现色谱,如叶绿素分离
如果无色,用显色剂显色。
化学常见分离与提纯案例案例4:血液中的铁元素的检验
把血液中血红蛋白中的Fe2+提取出来
蛋白质水解(催化剂、氧化剂、加热)
Fe2+→Fe3+,蒸干水后成为固体Fe(NO3)3
加入鉴定剂K4[Fe(CN)6]或KSCN化学常见分离与提纯案例案例5:制取无水乙醇
分析杂质:水、甲醇等
除水方式:碱石灰等
让液体与固体分离可用过滤法
过滤后液体是乙醇和甲醇的混合物
分离方法就是分(蒸)馏。
化学常见分离与提纯案例案例6-粗盐的提纯
粗盐中的杂质:Ca2+、Mg2+、SO42-
组合物理方法和化学方法
化学除杂,物理分离。
核心在于除杂顺序和减少不必要过程
注意鉴别溶液中杂质是否完全去除。
2、对实验中经常碰到的一些装置或操作应适当的进行归纳和延伸。
3、重视研究性实验试题的开发与训练,将一些操作简单、时间短、污染少的验证实验改为探究实验。让同学自己动手体验探究的全过程。
第一章:物质的分离和提纯物质的分离:利用物理或化学方法将混合物的各种成分分开
物质的提纯:除去杂质主要是利用化学反应把杂质转化为气体或不溶物(有时恰好相反)而分离除去(去除法),或把杂质转化为所需物质(转化法),但应注意不能因加入试剂又引入新的杂质。即:目的:原则:“不增、不减、易分、复原”(1)不增加新的杂质,
(2)不减少主要成分的含量,
(3)操作方法简单,易于进行分离,
(4)如果将主要成分进行了转化,最后要能将其还原转来。
物质的分离和提纯1固—固混合分离型(1)热分解法或升华:
(2)结晶(重结晶):据溶解度,分离两种及以上可溶性固体2固—液混合分离型(3)过滤:分离不溶性固体与液体
(4)蒸发:蒸干或蒸发至一定程度后降温结晶
(5)盐析:用于获取肥皂及蛋白质的分离提纯物质的分离和提纯3液—液混合分离型(6)蒸馏(分馏):利用沸点不同分离混合物
(7)渗析:分离胶体和溶液
(8)萃取和分液4气—气混合分离型(9)洗气1、过滤分离类型:固体(不溶)一液体分离
典型案例:除去粗盐中的泥沙 (1)对折法折叠滤纸后紧贴漏斗壁,用水打湿不出气泡为止,滤纸边缘低于漏斗;过滤时加入漏斗的溶液面低于滤纸边缘,即“一贴两低三靠”。
(2)过滤时:烧杯嘴与玻璃棒接触;玻璃棒与三层滤纸处相接触;漏斗嘴紧靠玻璃烧杯壁。
(3)加水,水面高于沉淀,浸洗三次,达到净化沉淀。 2、蒸发结晶(重结晶) 3、蒸馏分馏 4、萃取分液 5、洗气 6、渗析 渗析——用于分离胶体和溶液的一种方法 以提纯Fe(OH)3 胶体为例,说明如何证明胶体中已无杂质?7、加热 8、升华 9、盐析胶体从混和物中分离出来。例:硬脂酸钠溶液中加入食盐细粒;鸡蛋白溶液中加入饱和溶液 10、离子交换 11、色谱法常见的物质分离操作实验:
化学常见分离与提纯案例案例1:硝酸钾晶体的制备
分离方法选择:
研究硝酸钾/粗盐中杂质的状态(S)
可用方法选择(固-固)
热分解/升华或都是结晶(重结晶)
再研究,硝酸钾不符合热分解升华法的要求,故选择结晶(重结晶法
化学常见分离与提纯案例案例2:海带中碘元素的分离及检验
碘单质固体,
升华法可行。
海带中以I-存在,要分离出I-就需要除去海带中的有机物,留下无机物。
无机物溶于水形成溶液(I-)
要生成I2,则需要加入氧化剂(不引入新杂质)
这就由S—S分离→
选用的是萃取-分液/蒸馏法
得到仍是碘的四氯化碳溶液
再用分馏法进行分离。
是否可用S-S分离方法?(灼烧)H2O2液-液分离。化学常见分离与提纯案例案例3:用纸层析法分离铁离子和铜离子
一般情况下选用的是化学方法。
物理方法:色谱分析法(少量物质,更多的是用于物质鉴别方面)
原理:利用不同物质在展开剂中流动和扩张速率不同。
如果有色,直接呈现色谱,如叶绿素分离
如果无色,用显色剂显色。
化学常见分离与提纯案例案例4:血液中的铁元素的检验
把血液中血红蛋白中的Fe2+提取出来
蛋白质水解(催化剂、氧化剂、加热)
Fe2+→Fe3+,蒸干水后成为固体Fe(NO3)3
加入鉴定剂K4[Fe(CN)6]或KSCN化学常见分离与提纯案例案例5:制取无水乙醇
分析杂质:水、甲醇等
除水方式:碱石灰等
让液体与固体分离可用过滤法
过滤后液体是乙醇和甲醇的混合物
分离方法就是分(蒸)馏。
化学常见分离与提纯案例案例6-粗盐的提纯
粗盐中的杂质:Ca2+、Mg2+、SO42-
组合物理方法和化学方法
化学除杂,物理分离。
核心在于除杂顺序和减少不必要过程
注意鉴别溶液中杂质是否完全去除。
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
