2.1 物质的分离和提纯 课件 (2)
文档属性
| 名称 | 2.1 物质的分离和提纯 课件 (2) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-12 00:00:00 | ||
图片预览











文档简介
课件46张PPT。第二讲 物质的分离和提纯第一章 从实验学化学[考纲展示]
1.了解物质分离、提纯的意义和方法,掌握过滤、分液、蒸馏、萃取等操作的步骤及要求。 2.能绘制和识别典型的实验装置图。第一章 从实验学化学考点一 物质分离、提纯的常用物理方法考点二 物质分离、提纯的常用化学方法考 点 一 物质分离、提纯的常用物理方法
?
一、物质分离、提纯的区别
1.物质的分离
将混合物的各组分分离开来,获得几种纯净物的过程。
每一种组分都要保留下来,并恢复到原状态,如原来是固体,最后还是固体,得到比较纯的物质.
2.物质的提纯
将混合物中的杂质除去而得到纯净物的过程,又叫物质的净
化或除杂。
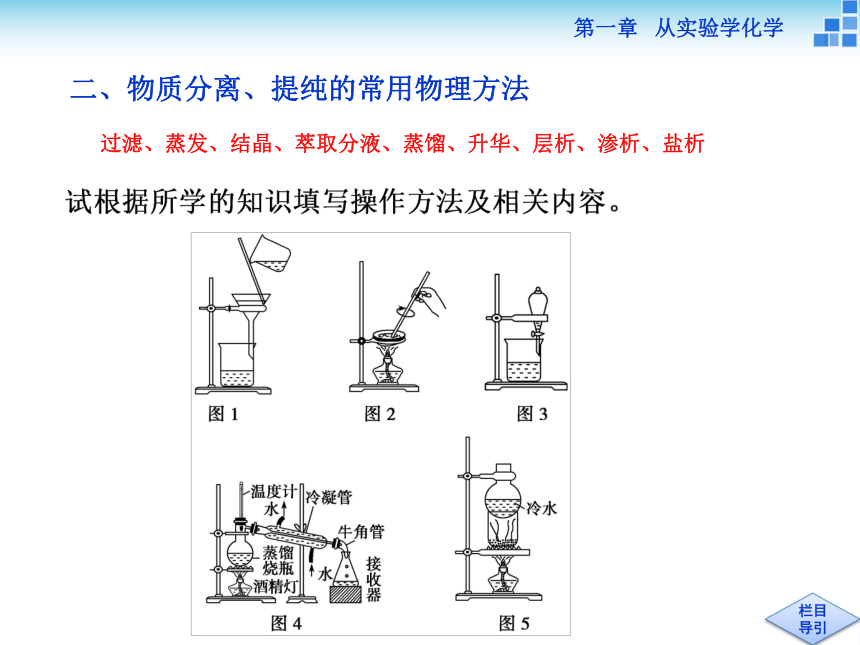
只留所需要物质二、物质分离、提纯的常用物理方法过滤、蒸发、结晶、萃取分液、蒸馏、升华、层析、渗析、盐析1.如图1,所采用的方法、装置的名称:________。
适用范围:把不溶性______________进行分离。
注意事项:①一贴:_______紧贴漏斗内壁;二低:滤纸上
缘低于___________,液面低于滤纸边缘;三靠:烧杯紧靠
__________,玻璃棒轻靠____________处,漏斗下端紧靠
___________。②若滤液浑浊,需____________________。
浑浊的原因可能是_______________________________。过滤固体与液体滤纸漏斗边缘玻璃棒三层滤纸烧杯内壁更换滤纸,重新过滤滤纸破损、滤液超过滤纸边缘过滤、洗涤2.结晶是______________________的过程,对溶解度受温度
变化影响________的固态溶质,采用____________的方法,
而对溶解度受温度变化影响相当大的固态溶质,采用冷却饱
和溶液的方法。
如图2,所采用的方法、装置的名称:_____________。
蒸发皿、玻璃棒、酒精灯、铁架台(铁圈)
.适用范围:溶解度随温度变化较小的物质。
注意事项:①玻璃棒的作用:_____________________________;
②当有大量晶体析出时,停止加热,利用余热蒸干,而不能
直接蒸干。晶体从饱和溶液中析出不大蒸发溶剂蒸发结晶搅拌,防止液体局部过热而飞溅冷却结晶
物质类别:受热易分解、溶解度随温度变化大的溶质。如:胆矾、氯化铵、硝酸钾
操作方法:蒸发浓缩、冷却结晶、过滤、洗涤、干燥3.如图3,所采用的方法、装置的名称:_______。
适用范围:①萃取:利用溶质在互不相溶的溶剂里的溶解度
不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液里提
取出来;②分液:两种液体互不相溶且易分层。
注意事项:①溶质在萃取剂中的溶解度比在原溶剂中大;②
萃取剂与原溶剂不反应、不相溶;③萃取剂与溶质不反应。分液分液操作步骤:1、分液漏斗在洗涤干净后,必须检查上口和玻璃
旋塞是否漏水;
2、充分振荡,适当放气,充分静置,然后分液;
3、分液时保持漏斗内外大气压一致;
4、下层溶液下口出,上层溶液上口出;
5、分液漏斗下端管口要紧靠在烧杯内壁上;
6、下层液体恰好流尽时,立即关闭旋塞。
▲分液操作应注意:4.如图4,所采用的方法、装置的名称:__________。
适用范围:__________相差较大的液体混合物。
注意事项:①温度计的水银球放在蒸馏烧瓶的支管口处;
②蒸馏烧瓶内要加沸石;③冷凝管水流方向应为“逆流”。
5.如图5,所采用的方法、装置的名称:_________。
适用范围:某种组分易升华的混合物,利用物质升华的性质
在加热条件下分离的方法。蒸馏沸点升华用蒸馏原理进行多种混合液体的分离,叫分馏 名师点拨
(1)难溶性固体与液体混合物可用过滤法分离。
(2)沸点不同的液体混合物可用蒸馏的方法分离。
(3)可溶性固体溶质与溶剂混合物可用蒸发的方法分离。
(4)互不混溶的液体可用分液法分离。
(5)易溶于水,但是溶解度受温度影响差异较大的固体混合物,可用重结晶的方法分离。 (高考改编组合题)下列实验能达到目的的是( )
A.(2014·高考安徽卷改编)用分液漏斗、烧杯、蒸馏水分离
Br2和CCl4的混合物
B.(2014·高考福建卷)将NH4Cl溶液蒸干制备NH4Cl固体
C.(2014·高考福建卷)用萃取分液的方法除去酒精中的水
D.(2014·高考福建卷)用可见光束照射以区别溶液和胶体D[解析] A.Br2易溶于CCl4中,加水不能萃取溴,不能采取分液方法分离,故A错误;B.NH4Cl受热易分解,在蒸干NH4Cl溶液过程中即发生分解,故B错误;C.酒精与水能以任意比互溶,应该用先加CaO后蒸馏的方法除去水分,故C错误;D.胶体能产生丁达尔效应,而溶液不能,故D正确。过滤蒸发萃取蒸馏升华分液重结晶盐析从海水中获取粗食盐从海水中提取溴氯化钠溶液中含有泥沙分离固体氯化钠和单质碘用自来水提取蒸馏水油脂发生皂化反应后产物的分离四氯化碳和水的分离除去硝酸钾中混有的氯化钠D 1.(2013·高考新课标全国卷Ⅰ)下列实验中,所
采取的分离方法与对应原理都正确的是( )解析:从化学实验的基本原理、化合物的性质、物质分离与提纯的基本方法角度分析解决问题。A项,萃取剂的选择必须是与原溶剂互不相溶,且被萃取物质在萃取剂中的溶解度较大。I2虽在乙醇中的溶解度较大,但水与乙醇能以任意比互溶,乙醇不能作萃取剂。B项,乙醇与乙酸乙酯均属于有机物,它们相溶,不能采取分液的方式分离。C项,除去KNO3固体中的NaCl,可以采取重结晶法,原理是KNO3溶解度随温度变化较大,NaCl溶解度随温度变化不大,可通过冷却热饱和溶液法析出KNO3晶体,而NaCl留在母液中被除去。D项,丁醇与乙醚相溶,但沸点相差较大,可以采用蒸馏的方法将乙醚蒸出,使丁醇与乙醚分开。⊙题组一 混合物分离的物理方法
1.(教材改编)下列各组混合物中,能用分液漏斗进行分离的
是( )
A.乙酸和水 B.溴和苯
C.水和四氯化碳 D.酒精和浓硫酸
解析:乙酸易溶于水,溴易溶于苯,酒精与浓硫酸也可混
溶,故均不能用分液漏斗进行分离。CD解析: A是蒸馏操作装置,B是渗析操作装置,C是过滤操作装置,都是常用的物质分离方法。D选项是溶液配制的操
作,不属于混合物的分离方法。⊙题组二 分离、提纯的装置和操作AA.分离Na2CO3溶液和CH3COOC2H5,选④
B.用CCl4提取碘水中的碘,选③
C.用FeCl2溶液吸收Cl2,选⑤
D.粗盐提纯,选①和②
解析: A项,乙酸乙酯难溶于碳酸钠溶液,二者会分层,可以用分液法分离,选择③,A项错误;B项,用CCl4萃取碘水中的碘,选择③,B项正确;C项,⑤可以用作洗气瓶,可用于氯化亚铁溶液吸收氯气,C项正确;D项,粗盐提纯需要过滤、蒸发结晶,选择①和②,D项正确。D解析:根据每个操作前后混合物的类型选择分离方式。①操作是针对加了饱和碳酸钠溶液之后的分层液体而进行的,故为分液;所得甲溶液是乙酸钠和乙醇的混合液,故②为蒸馏;乙酸钠加入硫酸后得到乙酸和硫酸钠溶液,故③为蒸馏。[反思归纳]
熟记常见物质分离操作中的注意事项
(1)过滤中的“3要求”:一贴、二低、三靠。
(2)蒸发中的“2注意”:玻璃棒搅拌和利用余热蒸干。
(3)萃取分液中的“4步操作”:加萃取剂—振荡放气—静置分层—分液。
(4)蒸馏中的“3注意”:温度计水银球的位置,冷却水的进出方向,加沸石防暴沸。沉淀气体考 点 二 物质分离、提纯的常用化学方法物质分离、提纯的常用化学方法酸性KMnO4热的铜粉NaOH溶液阳阴名师点拨
物质分离和提纯的原则与注意事项
(1)原则——“两不”和“两易”
两不:①不增(不增加新的杂质);②不减(不减少被提纯物质)。
两易:①易分离(被提纯物质与杂质易分离);②易复原(被提纯的物质易恢复原来的组成状态)。
(2)注意事项
①除杂试剂须过量。②过量试剂须除尽。③除去多种杂质时要考虑加入试剂的先后顺序,选择最佳的除杂途径。B 2.(2015·四川自贡高三模拟)下列有关除杂的实验操作合理的是( )
A.除去二氧化碳中混有的少量一氧化碳:通入适量氧气后点燃
B.除去氧气中少量氮气:使气体通过炽热的铜粉
C.除去石英中少量碳酸钙:用稀盐酸溶解后过滤
D.除去氯化钠固体中少量的纯碱:加入足量氯化钙,过滤、蒸发、结晶C解析:二氧化碳中通入适量氧气,少量一氧化碳不能燃烧;将氧气和氮气通过炽热的铜粉,氧气与铜粉反应而除去;碳酸钙与稀盐酸反应,石英即二氧化硅不与稀盐酸反应,再过
滤,这样就可以除掉石英中的碳酸钙;加入足量氯化钙时引入杂质Ca2+。1.除去下列括号内杂质的试剂或方法错误的是( )
A.HNO3溶液(H2SO4),适量BaCl2溶液,过滤
B.CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气
C.KNO3晶体(NaCl),蒸馏水,结晶
D.C2H5OH(CH3COOH),加足量CaO,蒸馏A解析:此题考查了物质的提纯知识。HNO3溶液中混有H2SO4时,加入氯化钡使得硝酸中又混入了HCl杂质,应加入硝酸钡溶液然后过滤,A错;SO2有还原性,可用酸性高锰酸钾氧化为硫酸除去,B对;硝酸钾的溶解度随温度升高变大,但食盐的溶解度随温度变化较小,一般用结晶或重结晶法分离,C对;乙酸具有酸性,其能和氧化钙反应,但乙醇不能,故加足量氧化钙蒸馏可以分离两者,D对。解析:C项中,加入Cu会发生反应:Cu+2FeCl3===CuCl2
+2FeCl2,引入新杂质Cu2+,故错误。C[反思归纳]
不同状态的混合物的分离方法
(1)固-固混合分离型:灼烧、热分解、升华、结晶(或重结晶)。
(2)固-液混合分离型:过滤、盐析、蒸发。
(3)液-液混合分离型:萃取、分液、蒸馏、渗析。
(4)气-气混合分离型:洗气、液化。
1.了解物质分离、提纯的意义和方法,掌握过滤、分液、蒸馏、萃取等操作的步骤及要求。 2.能绘制和识别典型的实验装置图。第一章 从实验学化学考点一 物质分离、提纯的常用物理方法考点二 物质分离、提纯的常用化学方法考 点 一 物质分离、提纯的常用物理方法
?
一、物质分离、提纯的区别
1.物质的分离
将混合物的各组分分离开来,获得几种纯净物的过程。
每一种组分都要保留下来,并恢复到原状态,如原来是固体,最后还是固体,得到比较纯的物质.
2.物质的提纯
将混合物中的杂质除去而得到纯净物的过程,又叫物质的净
化或除杂。
只留所需要物质二、物质分离、提纯的常用物理方法过滤、蒸发、结晶、萃取分液、蒸馏、升华、层析、渗析、盐析1.如图1,所采用的方法、装置的名称:________。
适用范围:把不溶性______________进行分离。
注意事项:①一贴:_______紧贴漏斗内壁;二低:滤纸上
缘低于___________,液面低于滤纸边缘;三靠:烧杯紧靠
__________,玻璃棒轻靠____________处,漏斗下端紧靠
___________。②若滤液浑浊,需____________________。
浑浊的原因可能是_______________________________。过滤固体与液体滤纸漏斗边缘玻璃棒三层滤纸烧杯内壁更换滤纸,重新过滤滤纸破损、滤液超过滤纸边缘过滤、洗涤2.结晶是______________________的过程,对溶解度受温度
变化影响________的固态溶质,采用____________的方法,
而对溶解度受温度变化影响相当大的固态溶质,采用冷却饱
和溶液的方法。
如图2,所采用的方法、装置的名称:_____________。
蒸发皿、玻璃棒、酒精灯、铁架台(铁圈)
.适用范围:溶解度随温度变化较小的物质。
注意事项:①玻璃棒的作用:_____________________________;
②当有大量晶体析出时,停止加热,利用余热蒸干,而不能
直接蒸干。晶体从饱和溶液中析出不大蒸发溶剂蒸发结晶搅拌,防止液体局部过热而飞溅冷却结晶
物质类别:受热易分解、溶解度随温度变化大的溶质。如:胆矾、氯化铵、硝酸钾
操作方法:蒸发浓缩、冷却结晶、过滤、洗涤、干燥3.如图3,所采用的方法、装置的名称:_______。
适用范围:①萃取:利用溶质在互不相溶的溶剂里的溶解度
不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液里提
取出来;②分液:两种液体互不相溶且易分层。
注意事项:①溶质在萃取剂中的溶解度比在原溶剂中大;②
萃取剂与原溶剂不反应、不相溶;③萃取剂与溶质不反应。分液分液操作步骤:1、分液漏斗在洗涤干净后,必须检查上口和玻璃
旋塞是否漏水;
2、充分振荡,适当放气,充分静置,然后分液;
3、分液时保持漏斗内外大气压一致;
4、下层溶液下口出,上层溶液上口出;
5、分液漏斗下端管口要紧靠在烧杯内壁上;
6、下层液体恰好流尽时,立即关闭旋塞。
▲分液操作应注意:4.如图4,所采用的方法、装置的名称:__________。
适用范围:__________相差较大的液体混合物。
注意事项:①温度计的水银球放在蒸馏烧瓶的支管口处;
②蒸馏烧瓶内要加沸石;③冷凝管水流方向应为“逆流”。
5.如图5,所采用的方法、装置的名称:_________。
适用范围:某种组分易升华的混合物,利用物质升华的性质
在加热条件下分离的方法。蒸馏沸点升华用蒸馏原理进行多种混合液体的分离,叫分馏 名师点拨
(1)难溶性固体与液体混合物可用过滤法分离。
(2)沸点不同的液体混合物可用蒸馏的方法分离。
(3)可溶性固体溶质与溶剂混合物可用蒸发的方法分离。
(4)互不混溶的液体可用分液法分离。
(5)易溶于水,但是溶解度受温度影响差异较大的固体混合物,可用重结晶的方法分离。 (高考改编组合题)下列实验能达到目的的是( )
A.(2014·高考安徽卷改编)用分液漏斗、烧杯、蒸馏水分离
Br2和CCl4的混合物
B.(2014·高考福建卷)将NH4Cl溶液蒸干制备NH4Cl固体
C.(2014·高考福建卷)用萃取分液的方法除去酒精中的水
D.(2014·高考福建卷)用可见光束照射以区别溶液和胶体D[解析] A.Br2易溶于CCl4中,加水不能萃取溴,不能采取分液方法分离,故A错误;B.NH4Cl受热易分解,在蒸干NH4Cl溶液过程中即发生分解,故B错误;C.酒精与水能以任意比互溶,应该用先加CaO后蒸馏的方法除去水分,故C错误;D.胶体能产生丁达尔效应,而溶液不能,故D正确。过滤蒸发萃取蒸馏升华分液重结晶盐析从海水中获取粗食盐从海水中提取溴氯化钠溶液中含有泥沙分离固体氯化钠和单质碘用自来水提取蒸馏水油脂发生皂化反应后产物的分离四氯化碳和水的分离除去硝酸钾中混有的氯化钠D 1.(2013·高考新课标全国卷Ⅰ)下列实验中,所
采取的分离方法与对应原理都正确的是( )解析:从化学实验的基本原理、化合物的性质、物质分离与提纯的基本方法角度分析解决问题。A项,萃取剂的选择必须是与原溶剂互不相溶,且被萃取物质在萃取剂中的溶解度较大。I2虽在乙醇中的溶解度较大,但水与乙醇能以任意比互溶,乙醇不能作萃取剂。B项,乙醇与乙酸乙酯均属于有机物,它们相溶,不能采取分液的方式分离。C项,除去KNO3固体中的NaCl,可以采取重结晶法,原理是KNO3溶解度随温度变化较大,NaCl溶解度随温度变化不大,可通过冷却热饱和溶液法析出KNO3晶体,而NaCl留在母液中被除去。D项,丁醇与乙醚相溶,但沸点相差较大,可以采用蒸馏的方法将乙醚蒸出,使丁醇与乙醚分开。⊙题组一 混合物分离的物理方法
1.(教材改编)下列各组混合物中,能用分液漏斗进行分离的
是( )
A.乙酸和水 B.溴和苯
C.水和四氯化碳 D.酒精和浓硫酸
解析:乙酸易溶于水,溴易溶于苯,酒精与浓硫酸也可混
溶,故均不能用分液漏斗进行分离。CD解析: A是蒸馏操作装置,B是渗析操作装置,C是过滤操作装置,都是常用的物质分离方法。D选项是溶液配制的操
作,不属于混合物的分离方法。⊙题组二 分离、提纯的装置和操作AA.分离Na2CO3溶液和CH3COOC2H5,选④
B.用CCl4提取碘水中的碘,选③
C.用FeCl2溶液吸收Cl2,选⑤
D.粗盐提纯,选①和②
解析: A项,乙酸乙酯难溶于碳酸钠溶液,二者会分层,可以用分液法分离,选择③,A项错误;B项,用CCl4萃取碘水中的碘,选择③,B项正确;C项,⑤可以用作洗气瓶,可用于氯化亚铁溶液吸收氯气,C项正确;D项,粗盐提纯需要过滤、蒸发结晶,选择①和②,D项正确。D解析:根据每个操作前后混合物的类型选择分离方式。①操作是针对加了饱和碳酸钠溶液之后的分层液体而进行的,故为分液;所得甲溶液是乙酸钠和乙醇的混合液,故②为蒸馏;乙酸钠加入硫酸后得到乙酸和硫酸钠溶液,故③为蒸馏。[反思归纳]
熟记常见物质分离操作中的注意事项
(1)过滤中的“3要求”:一贴、二低、三靠。
(2)蒸发中的“2注意”:玻璃棒搅拌和利用余热蒸干。
(3)萃取分液中的“4步操作”:加萃取剂—振荡放气—静置分层—分液。
(4)蒸馏中的“3注意”:温度计水银球的位置,冷却水的进出方向,加沸石防暴沸。沉淀气体考 点 二 物质分离、提纯的常用化学方法物质分离、提纯的常用化学方法酸性KMnO4热的铜粉NaOH溶液阳阴名师点拨
物质分离和提纯的原则与注意事项
(1)原则——“两不”和“两易”
两不:①不增(不增加新的杂质);②不减(不减少被提纯物质)。
两易:①易分离(被提纯物质与杂质易分离);②易复原(被提纯的物质易恢复原来的组成状态)。
(2)注意事项
①除杂试剂须过量。②过量试剂须除尽。③除去多种杂质时要考虑加入试剂的先后顺序,选择最佳的除杂途径。B 2.(2015·四川自贡高三模拟)下列有关除杂的实验操作合理的是( )
A.除去二氧化碳中混有的少量一氧化碳:通入适量氧气后点燃
B.除去氧气中少量氮气:使气体通过炽热的铜粉
C.除去石英中少量碳酸钙:用稀盐酸溶解后过滤
D.除去氯化钠固体中少量的纯碱:加入足量氯化钙,过滤、蒸发、结晶C解析:二氧化碳中通入适量氧气,少量一氧化碳不能燃烧;将氧气和氮气通过炽热的铜粉,氧气与铜粉反应而除去;碳酸钙与稀盐酸反应,石英即二氧化硅不与稀盐酸反应,再过
滤,这样就可以除掉石英中的碳酸钙;加入足量氯化钙时引入杂质Ca2+。1.除去下列括号内杂质的试剂或方法错误的是( )
A.HNO3溶液(H2SO4),适量BaCl2溶液,过滤
B.CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气
C.KNO3晶体(NaCl),蒸馏水,结晶
D.C2H5OH(CH3COOH),加足量CaO,蒸馏A解析:此题考查了物质的提纯知识。HNO3溶液中混有H2SO4时,加入氯化钡使得硝酸中又混入了HCl杂质,应加入硝酸钡溶液然后过滤,A错;SO2有还原性,可用酸性高锰酸钾氧化为硫酸除去,B对;硝酸钾的溶解度随温度升高变大,但食盐的溶解度随温度变化较小,一般用结晶或重结晶法分离,C对;乙酸具有酸性,其能和氧化钙反应,但乙醇不能,故加足量氧化钙蒸馏可以分离两者,D对。解析:C项中,加入Cu会发生反应:Cu+2FeCl3===CuCl2
+2FeCl2,引入新杂质Cu2+,故错误。C[反思归纳]
不同状态的混合物的分离方法
(1)固-固混合分离型:灼烧、热分解、升华、结晶(或重结晶)。
(2)固-液混合分离型:过滤、盐析、蒸发。
(3)液-液混合分离型:萃取、分液、蒸馏、渗析。
(4)气-气混合分离型:洗气、液化。
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
