实验2-5 乙酸乙酯的制备及反应条件探究 课件
文档属性
| 名称 | 实验2-5 乙酸乙酯的制备及反应条件探究 课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 803.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-13 00:00:00 | ||
图片预览






文档简介
课件19张PPT。 乙酸乙酯的制备
---谈谈有机制备实验的基本思路高考
风向2014年
全国卷Ⅰ:乙酸异戊酯的制备
全国大纲卷:苯乙酸的制备
海南卷、天津卷: Na2S2O3的制备
浙江卷:葡萄糖酸钙的制备
2013年
江苏卷:合成二甲氧基苯酚
全国卷Ⅰ:合成环己烯
全国卷Ⅱ:合成正丁醛教学
目标1.分析乙酸乙酯制备实验的原理、解读各操作细节
2.寻找有机制备实验中常见改进举措
3.初步形成有机制备实验的一般解题思路和方法1.回归教材基础
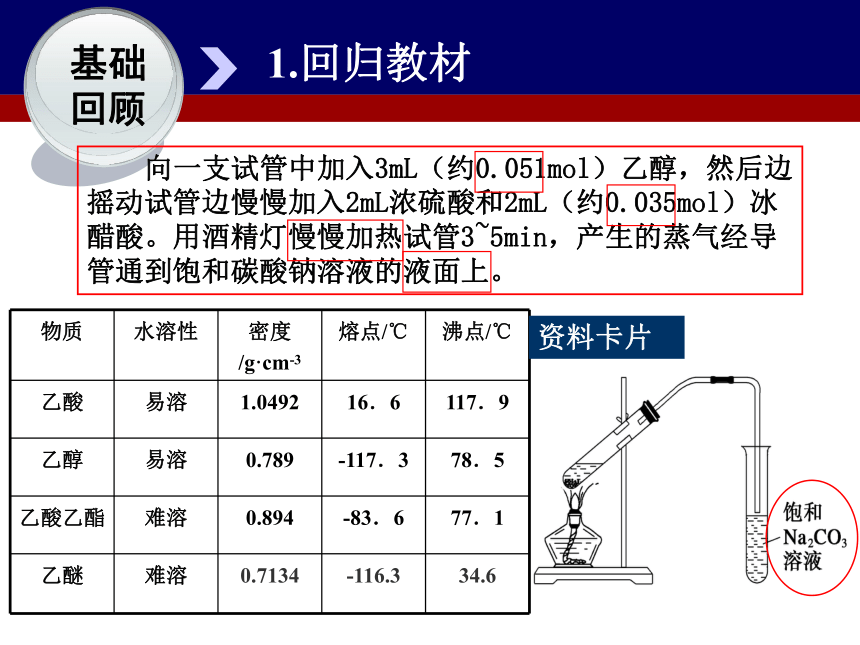
回顾 向一支试管中加入3mL(约0.051mol)乙醇,然后边摇动试管边慢慢加入2mL浓硫酸和2mL(约0.035mol)冰醋酸。用酒精灯慢慢加热试管3~5min,产生的蒸气经导管通到饱和碳酸钠溶液的液面上。资料卡片2.原理分析基础
回顾1.反应原理:
2.反应特点:
3.如何“多快好省”的提高乙酸乙酯的产率,措施有哪些
快(速率角度):浓硫酸作催化剂并加热
多(平衡角度):增加乙醇的量(更经济)、浓硫酸吸水、加热蒸出乙酸乙酯等,促使平衡正向移动,提高产率。
3.分离提纯基础
回顾1. 副反应、杂质有哪些?
2. 饱和碳酸钠溶液的作用有哪些?
3. 分离提纯的方法是什么?
4. 原料加入顺序应注意什么?
5. 末端导气管为什么在液面上?
6. 为什么要慢慢加热?
7. 长玻璃导管的作用有哪些?可能的副反应:可能的杂质:乙醇、乙酸、乙醚等除杂试剂:饱和碳酸钠溶液可以减少乙酸乙酯的溶解损失,提高产率,同时溶解乙醇、吸收乙酸、提高乙酸乙酯的纯度。除杂方法:分液 操作细节: ①加料顺序:乙醇→浓硫酸→冰乙酸;
②导管不能插入液面下,以防倒吸;
③须小心均匀加热,以防原料大量挥发;
④倾斜的导管可起到冷凝回流导气作用。 1.方案改进难点突破上述简易有机制备装置有哪些不足?如何改进
思考1:如何控制反应条件避免原料的损失
思考2:如何分离生成的水提高产品产量
思考3:如何有效分离杂质提高产品纯度1.方案改进难点突破制取苯甲酸乙酯能否使用制取乙酸乙酯的简易装置?
原料乙醇的沸点低于苯甲酸乙酯的沸点,若使用制备乙酸乙酯的发生装置,会使原料乙醇大量蒸馏出去,实验效率大大降低。
实例(一)控制反应条件避免损失1.三颈烧瓶+冷凝回流+反应温度指示加热温度以溶液
刚好回流为宜!恒压滴液漏斗 滴速过快可能造反应温度下降过快或放热反应升温过快
搅拌器+延长回流时间 使原料反应更充分
分批滴加 原料利用率更高
水浴加热 温度控制更精确 (一)控制反应条件避免损失2.恒压滴液漏斗+分批滴加+搅拌器+水浴加热+延长时间(一)控制反应条件避免损失2.恒压滴液漏斗+分批滴加+搅拌器+水浴加热+延长时间 在分水器上加水至c处,接通冷凝水。在反应过程中,通过调节分水器下部的旋塞不断分离出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回流到圆底烧瓶中。(二)分离生成的水1.分水器韦氏分馏柱作用与
原理类似于冷凝管2.分馏柱(二)分离生成的水保持柱顶温度约为105℃,则锥形瓶中收集到的馏分主要是什么?选择此温度的主要理由是什么?温度过低不能将水蒸馏出来,降低了产率,温度过高冰醋酸也被蒸出,降低了原料的利用率。 实例杂质来源:①未完全反应的原料,包括催化剂;
②生成物中的其他物质;
③副反应产物除杂方法:要根据产品和杂质的性质(沸点、溶解性、密度)
和状态来确定。(三)有效分离杂质沸点有差异的液体:萃取→分液→干燥→蒸馏(三)有效分离杂质溶解度有差异的固体:加热溶解→冷却结晶→过滤(抽滤)→洗涤→(重结晶)→干燥白色针状晶体,熔点135~136℃,难溶于水(三)有效分离杂质有机制备实验的命题规律:2.思路建构难点突破根据官能团性质分析发生的反应以及可能有的杂质。根据反应条件、原料和产物的物理性质合理选择装置,同时兼顾简便、安全、环保原则。分离提纯需综合分析各组分的性状,特别是溶解情况、熔沸点、密度的差异合理选择走结晶还是蒸馏路线。领悟操作细节,提升学科素养。纯度、产率纯属方程式计算(过量计算),胆大心细即可。有机制备实验的命题规律:2.思路建构难点突破
---谈谈有机制备实验的基本思路高考
风向2014年
全国卷Ⅰ:乙酸异戊酯的制备
全国大纲卷:苯乙酸的制备
海南卷、天津卷: Na2S2O3的制备
浙江卷:葡萄糖酸钙的制备
2013年
江苏卷:合成二甲氧基苯酚
全国卷Ⅰ:合成环己烯
全国卷Ⅱ:合成正丁醛教学
目标1.分析乙酸乙酯制备实验的原理、解读各操作细节
2.寻找有机制备实验中常见改进举措
3.初步形成有机制备实验的一般解题思路和方法1.回归教材基础
回顾 向一支试管中加入3mL(约0.051mol)乙醇,然后边摇动试管边慢慢加入2mL浓硫酸和2mL(约0.035mol)冰醋酸。用酒精灯慢慢加热试管3~5min,产生的蒸气经导管通到饱和碳酸钠溶液的液面上。资料卡片2.原理分析基础
回顾1.反应原理:
2.反应特点:
3.如何“多快好省”的提高乙酸乙酯的产率,措施有哪些
快(速率角度):浓硫酸作催化剂并加热
多(平衡角度):增加乙醇的量(更经济)、浓硫酸吸水、加热蒸出乙酸乙酯等,促使平衡正向移动,提高产率。
3.分离提纯基础
回顾1. 副反应、杂质有哪些?
2. 饱和碳酸钠溶液的作用有哪些?
3. 分离提纯的方法是什么?
4. 原料加入顺序应注意什么?
5. 末端导气管为什么在液面上?
6. 为什么要慢慢加热?
7. 长玻璃导管的作用有哪些?可能的副反应:可能的杂质:乙醇、乙酸、乙醚等除杂试剂:饱和碳酸钠溶液可以减少乙酸乙酯的溶解损失,提高产率,同时溶解乙醇、吸收乙酸、提高乙酸乙酯的纯度。除杂方法:分液 操作细节: ①加料顺序:乙醇→浓硫酸→冰乙酸;
②导管不能插入液面下,以防倒吸;
③须小心均匀加热,以防原料大量挥发;
④倾斜的导管可起到冷凝回流导气作用。 1.方案改进难点突破上述简易有机制备装置有哪些不足?如何改进
思考1:如何控制反应条件避免原料的损失
思考2:如何分离生成的水提高产品产量
思考3:如何有效分离杂质提高产品纯度1.方案改进难点突破制取苯甲酸乙酯能否使用制取乙酸乙酯的简易装置?
原料乙醇的沸点低于苯甲酸乙酯的沸点,若使用制备乙酸乙酯的发生装置,会使原料乙醇大量蒸馏出去,实验效率大大降低。
实例(一)控制反应条件避免损失1.三颈烧瓶+冷凝回流+反应温度指示加热温度以溶液
刚好回流为宜!恒压滴液漏斗 滴速过快可能造反应温度下降过快或放热反应升温过快
搅拌器+延长回流时间 使原料反应更充分
分批滴加 原料利用率更高
水浴加热 温度控制更精确 (一)控制反应条件避免损失2.恒压滴液漏斗+分批滴加+搅拌器+水浴加热+延长时间(一)控制反应条件避免损失2.恒压滴液漏斗+分批滴加+搅拌器+水浴加热+延长时间 在分水器上加水至c处,接通冷凝水。在反应过程中,通过调节分水器下部的旋塞不断分离出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回流到圆底烧瓶中。(二)分离生成的水1.分水器韦氏分馏柱作用与
原理类似于冷凝管2.分馏柱(二)分离生成的水保持柱顶温度约为105℃,则锥形瓶中收集到的馏分主要是什么?选择此温度的主要理由是什么?温度过低不能将水蒸馏出来,降低了产率,温度过高冰醋酸也被蒸出,降低了原料的利用率。 实例杂质来源:①未完全反应的原料,包括催化剂;
②生成物中的其他物质;
③副反应产物除杂方法:要根据产品和杂质的性质(沸点、溶解性、密度)
和状态来确定。(三)有效分离杂质沸点有差异的液体:萃取→分液→干燥→蒸馏(三)有效分离杂质溶解度有差异的固体:加热溶解→冷却结晶→过滤(抽滤)→洗涤→(重结晶)→干燥白色针状晶体,熔点135~136℃,难溶于水(三)有效分离杂质有机制备实验的命题规律:2.思路建构难点突破根据官能团性质分析发生的反应以及可能有的杂质。根据反应条件、原料和产物的物理性质合理选择装置,同时兼顾简便、安全、环保原则。分离提纯需综合分析各组分的性状,特别是溶解情况、熔沸点、密度的差异合理选择走结晶还是蒸馏路线。领悟操作细节,提升学科素养。纯度、产率纯属方程式计算(过量计算),胆大心细即可。有机制备实验的命题规律:2.思路建构难点突破
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
