第四单元 研究型实验 课件
文档属性
| 名称 | 第四单元 研究型实验 课件 |  | |
| 格式 | zip | ||
| 文件大小 | 545.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-13 17:52:09 | ||
图片预览






文档简介
课件20张PPT。第一节 金属的化学性质 第二课时 金属与水的反应
一、实验探究:钠与水的反应
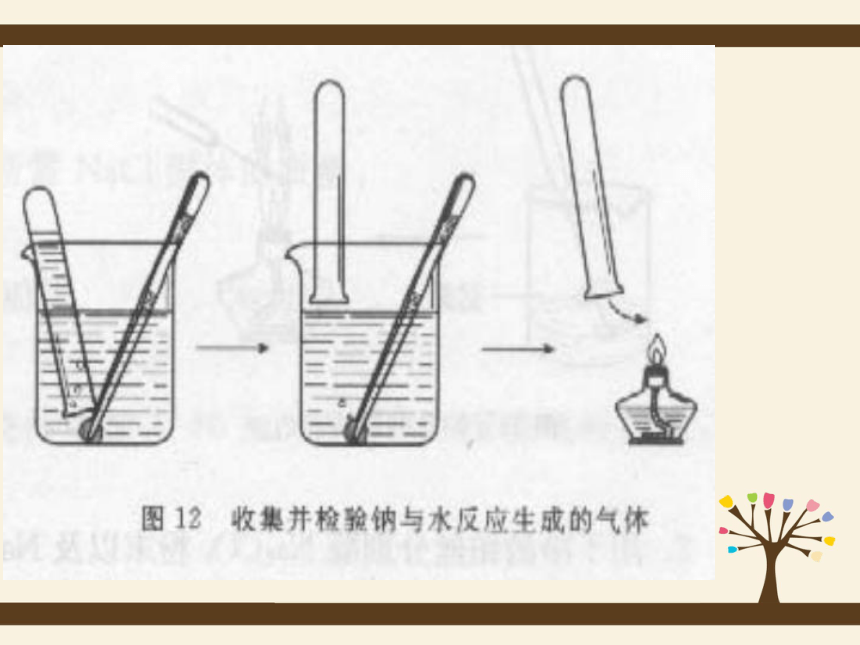
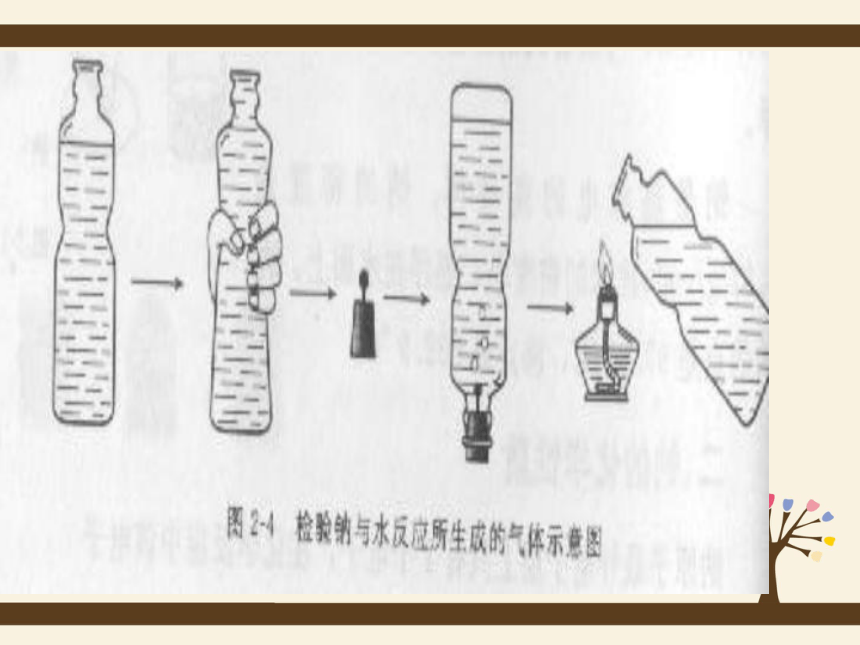
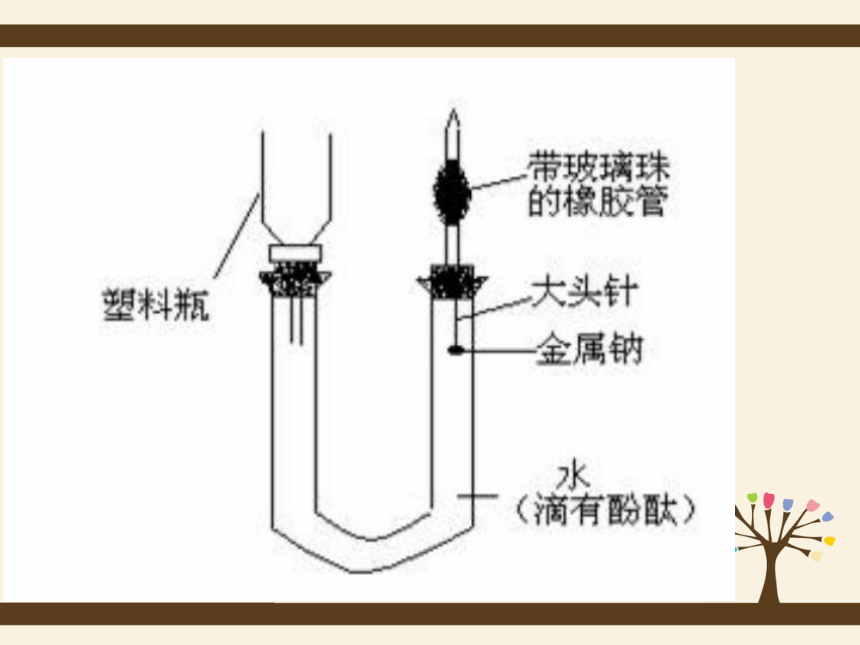
1、操作:在烧杯中加一些水,滴入几滴酚酞溶液。用镊子将金
属钠从试剂瓶中取出,用滤纸将其表面的煤油吸干,
在玻璃片上用小刀切下一小块钠(黄豆粒大小),剩
余的钠放回原试剂瓶中。将切下的钠块放入水中。你
们看到什么现象?
观察点钠与溶液的变化
有没有气体放出
反应是否放出热量 现象
谐音芙蓉香又红2、现象及解释:
3、结论:
A物理性质
钠是银白色,具有金属光泽,质软,
密度比水小,熔点低于水的沸点。
B化学性质
钠在常温下,与水剧烈反应,生成碱
和气体,并放出热量。
4、原理:
2Na + 2H2O = 2NaOH + ____↑
猜想: H2或O2←元素守恒
验证:A理论--氧化还原反应
B实验
5、友情提示
钠的灭火
干粉灭火器 泡沫灭火器 清水灭火器
用沙土扑灭二、
1、钠与盐溶液的反应
实验:钠投入CuSO4溶液
猜想→假设→验证拓展迁移 2Na+CuSO4=Cu+Na2SO4 × 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 2Na+2H2O=2NaOH+H2↑ 注意:钠只有与某些熔融盐作用时才能置换出相应的金属。 如:4Na+TiCl4(熔融)= 4NaCl+Ti 总反应为: 2Na+2H2O+CuSO4 = Cu(OH)2↓+Na2SO4+H2↑
2、Mg与水的反应
猜想→假设→验证
3、Fe与水的反应
猜想→假设→验证金属与水的反应KCaNaMgAlZnFeSnPb与冷水反应生成碱和氢气与热水反应生成碱和氢气高温下与水蒸气反应生成氧化物和氢气
三、优化测训
1、将一小块钠投入盛有5mL饱和澄清石灰水的试管里,
不可能观察到的现象是( )
A.钠熔成小球并在液面上游动
B.有气体生成
C.试管底部有银白色物质生成
D.溶液变浑
答案:C
2、将2.3g钠放在47.7g水中,反应完毕,溶质的
质量分数( )
A.大于8% B.等于8%
C.小于8% D.大于4%而小于8%
答案:A
3、分别将一小块钠投入下列的溶液中,只有气体放出没
有沉淀生成的是( )
A.饱和NaCl溶液 B.稀NaHSO4
C. MgCl2溶液 D.CuSO4溶液
答案:B谢谢
一、实验探究:钠与水的反应
1、操作:在烧杯中加一些水,滴入几滴酚酞溶液。用镊子将金
属钠从试剂瓶中取出,用滤纸将其表面的煤油吸干,
在玻璃片上用小刀切下一小块钠(黄豆粒大小),剩
余的钠放回原试剂瓶中。将切下的钠块放入水中。你
们看到什么现象?
观察点钠与溶液的变化
有没有气体放出
反应是否放出热量 现象
谐音芙蓉香又红2、现象及解释:
3、结论:
A物理性质
钠是银白色,具有金属光泽,质软,
密度比水小,熔点低于水的沸点。
B化学性质
钠在常温下,与水剧烈反应,生成碱
和气体,并放出热量。
4、原理:
2Na + 2H2O = 2NaOH + ____↑
猜想: H2或O2←元素守恒
验证:A理论--氧化还原反应
B实验
5、友情提示
钠的灭火
干粉灭火器 泡沫灭火器 清水灭火器
用沙土扑灭二、
1、钠与盐溶液的反应
实验:钠投入CuSO4溶液
猜想→假设→验证拓展迁移 2Na+CuSO4=Cu+Na2SO4 × 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 2Na+2H2O=2NaOH+H2↑ 注意:钠只有与某些熔融盐作用时才能置换出相应的金属。 如:4Na+TiCl4(熔融)= 4NaCl+Ti 总反应为: 2Na+2H2O+CuSO4 = Cu(OH)2↓+Na2SO4+H2↑
2、Mg与水的反应
猜想→假设→验证
3、Fe与水的反应
猜想→假设→验证金属与水的反应KCaNaMgAlZnFeSnPb与冷水反应生成碱和氢气与热水反应生成碱和氢气高温下与水蒸气反应生成氧化物和氢气
三、优化测训
1、将一小块钠投入盛有5mL饱和澄清石灰水的试管里,
不可能观察到的现象是( )
A.钠熔成小球并在液面上游动
B.有气体生成
C.试管底部有银白色物质生成
D.溶液变浑
答案:C
2、将2.3g钠放在47.7g水中,反应完毕,溶质的
质量分数( )
A.大于8% B.等于8%
C.小于8% D.大于4%而小于8%
答案:A
3、分别将一小块钠投入下列的溶液中,只有气体放出没
有沉淀生成的是( )
A.饱和NaCl溶液 B.稀NaHSO4
C. MgCl2溶液 D.CuSO4溶液
答案:B谢谢
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
