苏教版高中化学选择性必修1专题2化学反应速率与化学平衡2.2.2化学平衡状态教学课件(共25张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修1专题2化学反应速率与化学平衡2.2.2化学平衡状态教学课件(共25张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 431.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-21 17:55:44 | ||
图片预览








文档简介
(共25张PPT)
第2课时 化学平衡状态
专题2 化学反应速率与化学平衡
第二单元 化学反应的方向与限度
分点突破1
可逆反应及其特征
梳理落实
课堂练习
分点突破2
化学平衡状态
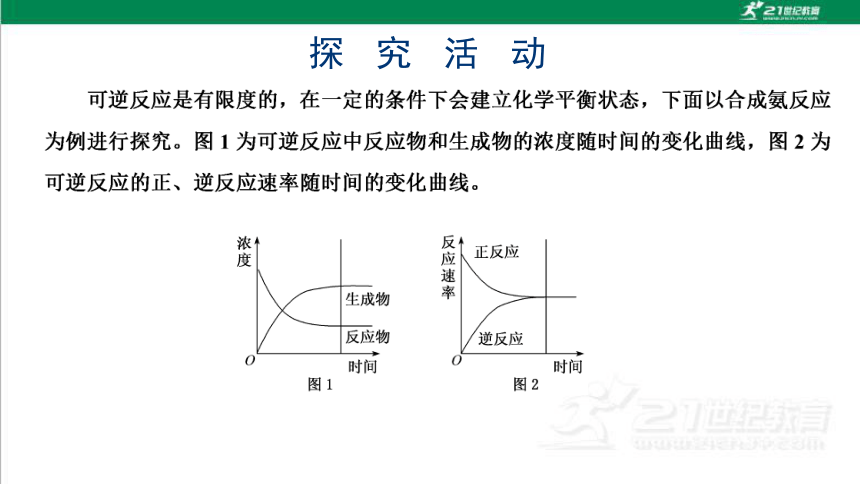
探究活动
归纳总结
课堂练习
[分级训练·课课过关]
2门世2有
3厚
指可逆反应分为方向相反的两个反应,即正
双向性
反应和逆反应
双同性
指正、逆反应是在同一条件下,同时进行
指反应物的转化率小于100%,反应物、生
共存性
成物共存于同一体系
潑
反应速率
正反应
生成物
反应物
逆反应
0
时间
0
时间
图1
图2
反应开始时
F最大,噬为零
反应物浓度逐渐减小→正逐渐减
反应进行时
小,生成物浓度山零逐渐增大→逆
从零开始逐渐增大
压=逆,反应混合物中各组分的浓
达到平衡时
度保持不变
)木
0正
V正=V逆
化学平衡
U逆
0
老
逆
研究对象为可逆反应
等
正、逆化学反应速率相等,即v正=v逆
动
化学平衡是动态平衡,即v正=v逆≠0
定
平衡混合物中,各组分的百分含量保持一定
变
外界条件改变,化学平衡状态可能发生改变
)木
V正
b
a
C
d
0
逆
0
E
密度
CHOH体积分数
0
to
E
0
to
t
A
B
平均摩尔质量
忄压强
0
to
t
O
to
t
C
D
第2课时 化学平衡状态
专题2 化学反应速率与化学平衡
第二单元 化学反应的方向与限度
分点突破1
可逆反应及其特征
梳理落实
课堂练习
分点突破2
化学平衡状态
探究活动
归纳总结
课堂练习
[分级训练·课课过关]
2门世2有
3厚
指可逆反应分为方向相反的两个反应,即正
双向性
反应和逆反应
双同性
指正、逆反应是在同一条件下,同时进行
指反应物的转化率小于100%,反应物、生
共存性
成物共存于同一体系
潑
反应速率
正反应
生成物
反应物
逆反应
0
时间
0
时间
图1
图2
反应开始时
F最大,噬为零
反应物浓度逐渐减小→正逐渐减
反应进行时
小,生成物浓度山零逐渐增大→逆
从零开始逐渐增大
压=逆,反应混合物中各组分的浓
达到平衡时
度保持不变
)木
0正
V正=V逆
化学平衡
U逆
0
老
逆
研究对象为可逆反应
等
正、逆化学反应速率相等,即v正=v逆
动
化学平衡是动态平衡,即v正=v逆≠0
定
平衡混合物中,各组分的百分含量保持一定
变
外界条件改变,化学平衡状态可能发生改变
)木
V正
b
a
C
d
0
逆
0
E
密度
CHOH体积分数
0
to
E
0
to
t
A
B
平均摩尔质量
忄压强
0
to
t
O
to
t
C
D
