苏教版高中化学选择性必修1专题1化学反应与能量变化1.3金属的腐蚀与防护教学课件(共22张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修1专题1化学反应与能量变化1.3金属的腐蚀与防护教学课件(共22张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-21 17:57:10 | ||
图片预览




文档简介
(共22张PPT)
专题1第三单元
金属的腐蚀与防护
金属的腐蚀与防护
01
概念
02
实质
03
影响
金属的腐蚀
金属腐蚀是指金属或合金与周围环境中的物质发生化学反应而腐蚀损耗的现象。
金属原子失电子被氧化,表示为:M-ne-=Mn+
金属被腐蚀后,在外形、色泽以及机械性能等方面都将发生变化,会使机器设备、仪器、仪表的精密度和灵敏度降低,影响使用以致报废。
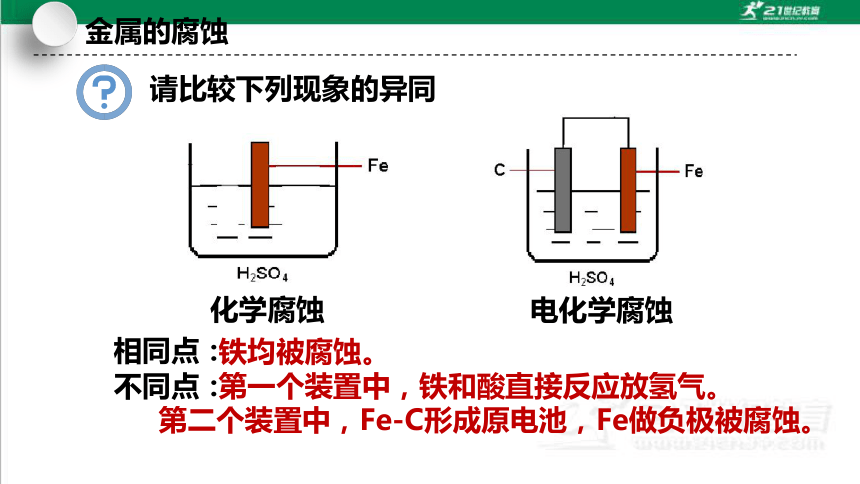
请比较下列现象的异同
铁均被腐蚀。
第一个装置中,铁和酸直接反应放氢气。
第二个装置中,Fe-C形成原电池,Fe做负极被腐蚀。
相同点:
不同点:
电化学腐蚀
化学腐蚀
金属的腐蚀
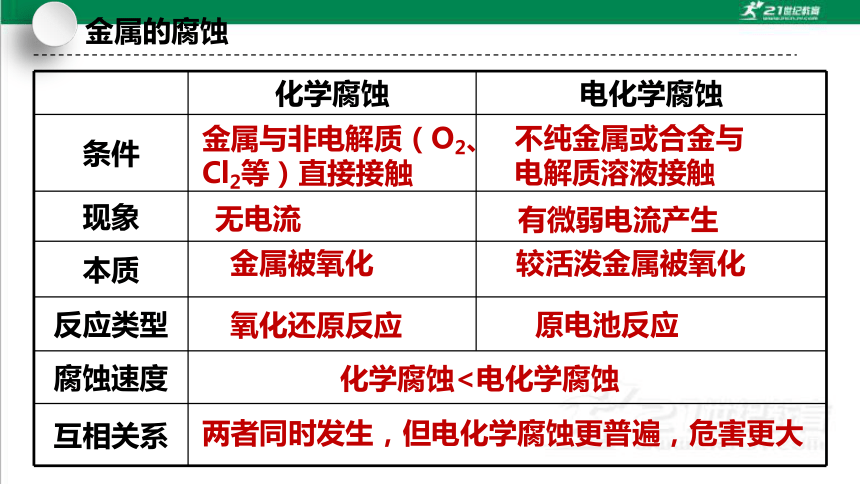
化学腐蚀 电化学腐蚀
条件
现象
本质
反应类型
腐蚀速度
互相关系
不纯金属或合金与电解质溶液接触
无电流
有微弱电流产生
金属与非电解质(O2、Cl2等)直接接触
金属被氧化
较活泼金属被氧化
两者同时发生,但电化学腐蚀更普遍,危害更大
化学腐蚀<电化学腐蚀
氧化还原反应
原电池反应
金属的腐蚀
金属的腐蚀
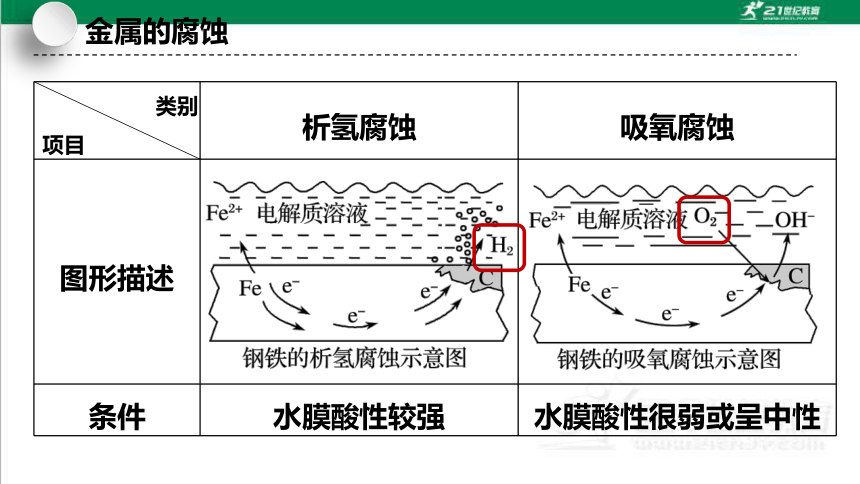
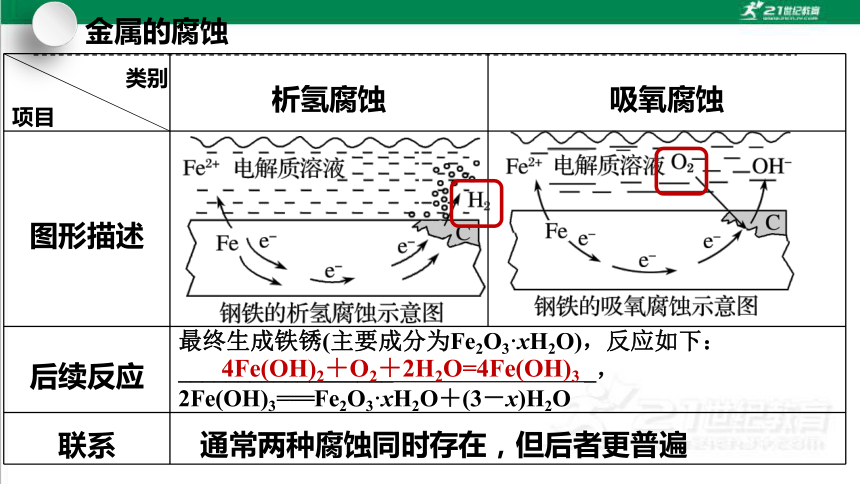
类别
项目 析氢腐蚀 吸氧腐蚀
图形描述
条件 水膜酸性较强 水膜酸性很弱或呈中性
金属的腐蚀
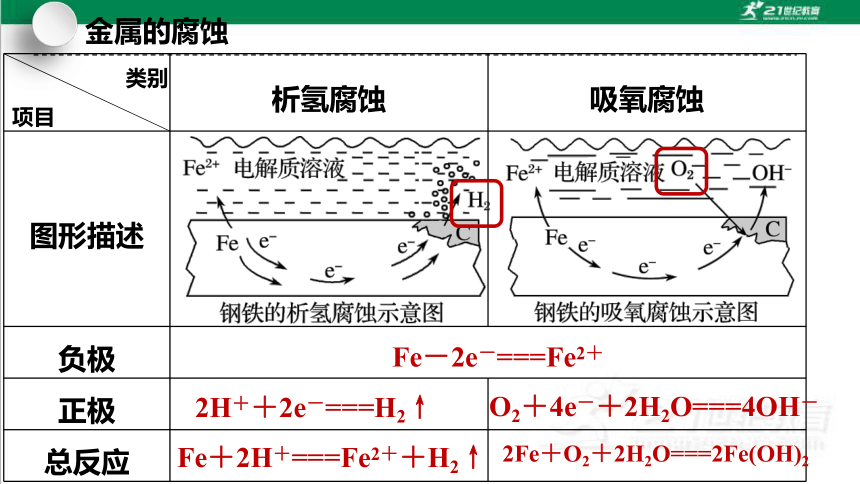
类别
项目 析氢腐蚀 吸氧腐蚀
图形描述
负极
正极
总反应
Fe-2e-===Fe2+
2H++2e-===H2↑
O2+4e-+2H2O===4OH-
Fe+2H+===Fe2++H2↑
2Fe+O2+2H2O===2Fe(OH)2
金属的腐蚀
类别
项目 析氢腐蚀 吸氧腐蚀
图形描述
后续反应 最终生成铁锈(主要成分为Fe2O3·xH2O),反应如下:__________________ _,
2Fe(OH)3===Fe2O3·xH2O+(3-x)H2O
联系
4Fe(OH)2+O2+2H2O=4Fe(OH)3
通常两种腐蚀同时存在,但后者更普遍
注意:
01
02
金属活动性顺序表中氢前面的金属,在酸性较强的电解质溶液中发生析氢腐蚀,在中性或酸性较弱的电解质溶液中发生吸氧腐蚀;
金属活动性顺序在氢后面的金属只可能发生吸氧腐蚀。
钢铁发生析氢腐蚀或吸氧腐蚀时,负极都是铁,失电子生成Fe2+,而非Fe3+。
金属的腐蚀
将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( )
A.铁被氧化的电极反应式为Fe-3e-==Fe3+
B.铁腐蚀过程中化学能全部转化为电能
C.活性炭的存在会加速铁的腐蚀
D.以水代替NaCl溶液,铁不能发生吸氧腐蚀
C
强化巩固
金属的防护方法
金属防护就是防止金属的腐蚀,要解决的主要问题是使金属不被氧化,应从金属腐蚀的化学反应原理、腐蚀的类型等方面来确定金属防护的具体方法。
金属的防护原理
金属的防护主要从金属、与金属接触的物质及两者反应的条件等方面来考虑。
金属的防护方法
在金属中添加其他金属或非金属制成性能优异的合金。如普通钢加入镍、铬制成不锈钢,钛合金不仅具有优异的抗腐蚀性能且具有良好的生物相容性。
1
改变金属材料的组成
金属的防护方法
在金属表面覆盖致密的保护层,从而使金属制品与周围物质(外界空气、水、电解质溶液等)隔离,这是一种被普遍采用的防护方法。
2
在金属表面覆盖保护层
①非金属保护层:如喷油漆、涂油脂。
②金属保护层:如铁制品上镀铜、锌等。
金属的防护方法
3
电化学防护法
金属在发生电化学腐蚀时,总是作为原电池负极(阳极)的金属被腐蚀,作为正极(阴极)的金属不被腐蚀,如果能使被保护的金属成为阴极,就不易被腐蚀。
金属的防护方法
3
电化学防护法
牺牲阳极的阴极保护法
活泼性强的金属做负极,被保护金属做正极。
原理:
原电池原理
金属的防护方法
3
电化学防护法
牺牲阳极的阴极保护法
此法常用于保护海轮外壳及石油管道等。
更活泼的金属(如镁、锌等)作阳极(负极),在不断被腐蚀后定期更换,而作为阴极(正极)的金属就不易被腐蚀而得到保护。
金属的防护方法
3
电化学防护法
外加电流的阴极保护法
被保护的金属与外接电源负极相连做阴极。
原理:
电解池原理
金属的防护方法
3
电化学防护法
外加电流的阴极保护法
通电后,电子流向被保护的钢铁设备,在钢铁表面积累了大量的负电荷,从而抑制钢铁失去电子,阻止钢铁被腐蚀。
此主要用于防止土壤、海水及河水中金属设备的腐蚀。
01
电解原理引起的腐蚀 > 原电池原理引起的腐蚀 > 化学腐蚀>防腐措施的腐蚀
02
对同一种金属来说,腐蚀的快慢:
强电解质溶液 > 弱电解质溶液 > 非电解质溶液
03
活泼性不同的两金属,活泼性差别越大,腐蚀越快。
04
对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。
判断金属腐蚀快慢的规律
金属的腐蚀
电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极
如图所示,各烧杯中均盛有海水,铁在其中被腐蚀的速率由快到慢的顺序为( )
A.②①③④⑤⑥ B.⑤④③①②⑥
C.⑤④②①③⑥ D.⑤③②④①⑥
C
强化巩固
延时符
课堂小结
1.钢铁的防护有多种方法,下列对于图中的方法描述错误的是( )
A.a、b以导线连接,辅助电极发生氧化反应
B.a、b以导线连接或以电源连接,辅助电极的材料可能都含有Zn
C.a、b分别连接直流电源,通电后外电路电子被强制从辅助电极流向钢铁闸门
D.a、b分别连接直流电源的负极、正极,该方法是牺牲阳极法
D
课堂练习
2.炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图所示,下列说法正确的是( )
A.腐蚀过程中,负极是C
B.Fe失去电子经电解质溶液转移给C
C.正极的电极反应式为4OH--4e-==2H2O+O2↑
D.C是正极,O2在C表面上发生还原反应
D
课堂练习
专题1第三单元
金属的腐蚀与防护
金属的腐蚀与防护
01
概念
02
实质
03
影响
金属的腐蚀
金属腐蚀是指金属或合金与周围环境中的物质发生化学反应而腐蚀损耗的现象。
金属原子失电子被氧化,表示为:M-ne-=Mn+
金属被腐蚀后,在外形、色泽以及机械性能等方面都将发生变化,会使机器设备、仪器、仪表的精密度和灵敏度降低,影响使用以致报废。
请比较下列现象的异同
铁均被腐蚀。
第一个装置中,铁和酸直接反应放氢气。
第二个装置中,Fe-C形成原电池,Fe做负极被腐蚀。
相同点:
不同点:
电化学腐蚀
化学腐蚀
金属的腐蚀
化学腐蚀 电化学腐蚀
条件
现象
本质
反应类型
腐蚀速度
互相关系
不纯金属或合金与电解质溶液接触
无电流
有微弱电流产生
金属与非电解质(O2、Cl2等)直接接触
金属被氧化
较活泼金属被氧化
两者同时发生,但电化学腐蚀更普遍,危害更大
化学腐蚀<电化学腐蚀
氧化还原反应
原电池反应
金属的腐蚀
金属的腐蚀
类别
项目 析氢腐蚀 吸氧腐蚀
图形描述
条件 水膜酸性较强 水膜酸性很弱或呈中性
金属的腐蚀
类别
项目 析氢腐蚀 吸氧腐蚀
图形描述
负极
正极
总反应
Fe-2e-===Fe2+
2H++2e-===H2↑
O2+4e-+2H2O===4OH-
Fe+2H+===Fe2++H2↑
2Fe+O2+2H2O===2Fe(OH)2
金属的腐蚀
类别
项目 析氢腐蚀 吸氧腐蚀
图形描述
后续反应 最终生成铁锈(主要成分为Fe2O3·xH2O),反应如下:__________________ _,
2Fe(OH)3===Fe2O3·xH2O+(3-x)H2O
联系
4Fe(OH)2+O2+2H2O=4Fe(OH)3
通常两种腐蚀同时存在,但后者更普遍
注意:
01
02
金属活动性顺序表中氢前面的金属,在酸性较强的电解质溶液中发生析氢腐蚀,在中性或酸性较弱的电解质溶液中发生吸氧腐蚀;
金属活动性顺序在氢后面的金属只可能发生吸氧腐蚀。
钢铁发生析氢腐蚀或吸氧腐蚀时,负极都是铁,失电子生成Fe2+,而非Fe3+。
金属的腐蚀
将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( )
A.铁被氧化的电极反应式为Fe-3e-==Fe3+
B.铁腐蚀过程中化学能全部转化为电能
C.活性炭的存在会加速铁的腐蚀
D.以水代替NaCl溶液,铁不能发生吸氧腐蚀
C
强化巩固
金属的防护方法
金属防护就是防止金属的腐蚀,要解决的主要问题是使金属不被氧化,应从金属腐蚀的化学反应原理、腐蚀的类型等方面来确定金属防护的具体方法。
金属的防护原理
金属的防护主要从金属、与金属接触的物质及两者反应的条件等方面来考虑。
金属的防护方法
在金属中添加其他金属或非金属制成性能优异的合金。如普通钢加入镍、铬制成不锈钢,钛合金不仅具有优异的抗腐蚀性能且具有良好的生物相容性。
1
改变金属材料的组成
金属的防护方法
在金属表面覆盖致密的保护层,从而使金属制品与周围物质(外界空气、水、电解质溶液等)隔离,这是一种被普遍采用的防护方法。
2
在金属表面覆盖保护层
①非金属保护层:如喷油漆、涂油脂。
②金属保护层:如铁制品上镀铜、锌等。
金属的防护方法
3
电化学防护法
金属在发生电化学腐蚀时,总是作为原电池负极(阳极)的金属被腐蚀,作为正极(阴极)的金属不被腐蚀,如果能使被保护的金属成为阴极,就不易被腐蚀。
金属的防护方法
3
电化学防护法
牺牲阳极的阴极保护法
活泼性强的金属做负极,被保护金属做正极。
原理:
原电池原理
金属的防护方法
3
电化学防护法
牺牲阳极的阴极保护法
此法常用于保护海轮外壳及石油管道等。
更活泼的金属(如镁、锌等)作阳极(负极),在不断被腐蚀后定期更换,而作为阴极(正极)的金属就不易被腐蚀而得到保护。
金属的防护方法
3
电化学防护法
外加电流的阴极保护法
被保护的金属与外接电源负极相连做阴极。
原理:
电解池原理
金属的防护方法
3
电化学防护法
外加电流的阴极保护法
通电后,电子流向被保护的钢铁设备,在钢铁表面积累了大量的负电荷,从而抑制钢铁失去电子,阻止钢铁被腐蚀。
此主要用于防止土壤、海水及河水中金属设备的腐蚀。
01
电解原理引起的腐蚀 > 原电池原理引起的腐蚀 > 化学腐蚀>防腐措施的腐蚀
02
对同一种金属来说,腐蚀的快慢:
强电解质溶液 > 弱电解质溶液 > 非电解质溶液
03
活泼性不同的两金属,活泼性差别越大,腐蚀越快。
04
对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。
判断金属腐蚀快慢的规律
金属的腐蚀
电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极
如图所示,各烧杯中均盛有海水,铁在其中被腐蚀的速率由快到慢的顺序为( )
A.②①③④⑤⑥ B.⑤④③①②⑥
C.⑤④②①③⑥ D.⑤③②④①⑥
C
强化巩固
延时符
课堂小结
1.钢铁的防护有多种方法,下列对于图中的方法描述错误的是( )
A.a、b以导线连接,辅助电极发生氧化反应
B.a、b以导线连接或以电源连接,辅助电极的材料可能都含有Zn
C.a、b分别连接直流电源,通电后外电路电子被强制从辅助电极流向钢铁闸门
D.a、b分别连接直流电源的负极、正极,该方法是牺牲阳极法
D
课堂练习
2.炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图所示,下列说法正确的是( )
A.腐蚀过程中,负极是C
B.Fe失去电子经电解质溶液转移给C
C.正极的电极反应式为4OH--4e-==2H2O+O2↑
D.C是正极,O2在C表面上发生还原反应
D
课堂练习
