苏教版高中化学选择性必修1专题3水溶液中的离子反应3.1.2电离平衡常数强酸与弱酸的比较教学课件(共22张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修1专题3水溶液中的离子反应3.1.2电离平衡常数强酸与弱酸的比较教学课件(共22张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-21 00:00:00 | ||
图片预览







文档简介
(共22张PPT)
专题3 水溶液中的离子反应
第一单元 弱电解质的电离平衡
第2课时
电离平衡常数 强酸与弱酸的比较
核心素养发展目标
学会运用电离平衡常数描述弱酸弱碱和水的电离程度
学习目标
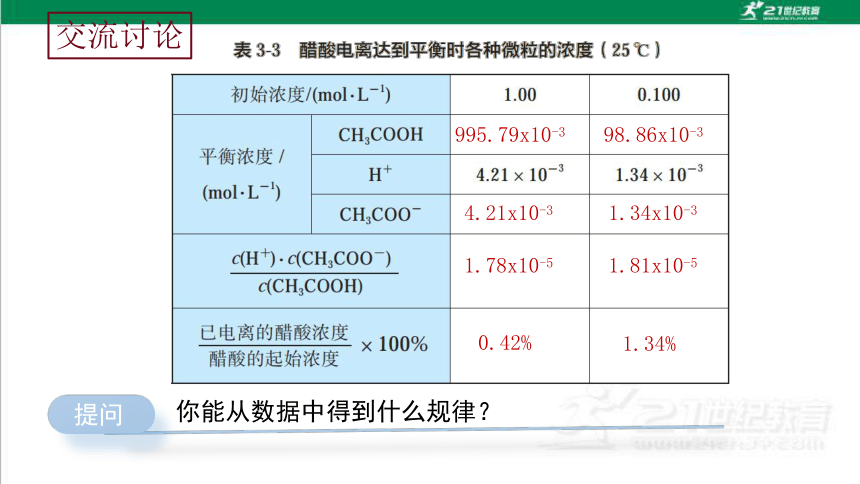
交流讨论
995.79x10-3
4.21x10-3
98.86x10-3
1.34x10-3
1.78x10-5
1.81x10-5
0.42%
1.34%
提问
你能从数据中得到什么规律?
交流讨论
一、电离平衡常数
定义:
弱酸的电离常数用Ka表示,弱碱的电离常数Kb表示。
1.电离平衡常数的概念
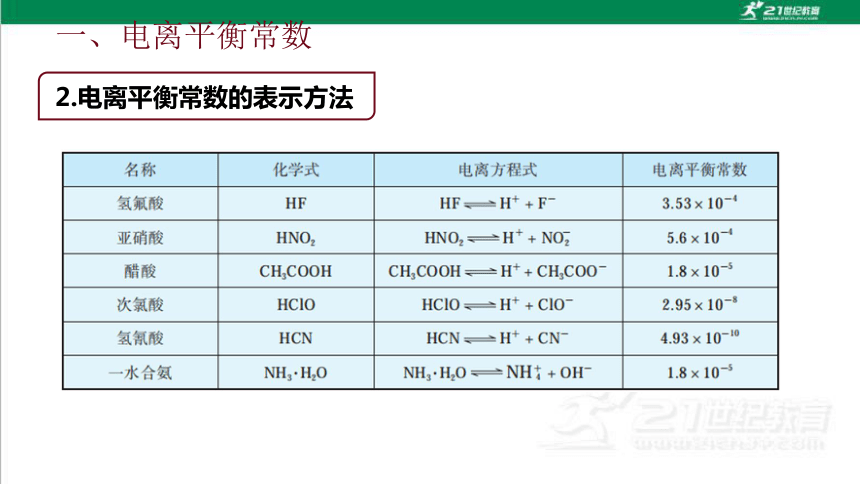
一、电离平衡常数
2.电离平衡常数的表示方法
(1)一元弱酸HA的电离常数:根据 HA H++A-,
可表示为
(2)一元弱碱BOH的电离常数:根据 BOH B++OH-,
可表示为
Ka=
c ( H+) .c( A-)
c(HA)
Kb=
c ( B+).c( OH- )
c(BOH)
一、电离平衡常数
2.电离平衡常数的表示方法
醋酸的电离常数表达式
Ka=
c(CH3COO )·c(H+)
c(CH3COOH)
Kb=
c(NH )·c(OH )
c(NH3·H2O)
+
4
NH3·H2O NH + OH
+
4
CH3COOH H+ + CH3COO
一水合氨的电离常数表达式
一、电离平衡常数
2.电离平衡常数的表示方法
一、电离平衡常数
2.电离平衡常数的表示方法
(3)多元弱酸、多元弱碱的电离平衡常数
多元弱酸的电离是分步进行的,每步各有电离平衡常数,通常用K1、K2等来分别表示。例如,
H2CO3 H++HCO3-
HCO3- H++CO32-
c(HCO3-)
c(H+)
c(H2CO3)
c(H+)
c(HCO3-)
c(CO32-)
Ka1=
Ka2=
一、电离平衡常数
2.电离平衡常数的表示方法
一、电离平衡常数
3.电离平衡常数的影响因素
内因:
由物质的本性所决定。
外因:
只与温度有关。
电解质越弱,Ka(或Kb)越小,越难电离,酸 (碱)的酸(碱)性越弱。
二、电离度
1.电离度的概念及表示方法
表达式:
意义:
电离度实质上是一种平衡转化率,表示弱电解质在水中的电离程度。
当温度和浓度相同时,一元弱酸的α越大,Ka越大、酸性越强。
二、电离度
2.电离度的影响因素
内因:
外因:
弱电解质本身的性质。(决定性因素)
温度——T↑,α↑
浓度——c↑,α↓
3.电离度的计算
乙酰水杨酸(HA)是一种弱酸。在一定温度下,0.1mol/L的乙酰水杨酸溶液中,乙酰水杨酸的电离度为5.7%,求该酸的电离平衡常数。
HA H+ + A-
始:
变:
平:
3.电离度的计算
HAc H+ + Ac-
始: c 0 0
变:
平:
x x x
c-x x x
越稀越电离
项目 C(H+) 酸性 中和碱能力 与活泼金属反应生成H2 的量 与同一金属反应时的起始速率
一元强酸
一元弱酸
大
小
强
弱
相同
小
相同
大
强酸与弱酸的比较
强酸与弱酸的比较
项目 C(H+) 酸性 中和碱能力 与活泼金属反应生成H2 的量 与同一金属反应时的起始速率
一元强酸
一元弱酸
相同
少
小
多
大
相同
相同
习题研究
解析:
25 ℃时,部分物质的电离平衡常数如下表所示:
化学式 CH3COOH H2CO3 HClO
电离平衡常数 1.76×10-5 K1=4.30×10-7
K2=5.61×10-11 2.95×10-8
(1)CH3COOH、H2CO3、HClO的
酸性由强到弱的顺序为 。
(2)试写出向NaClO和CH3COONa的混合溶液中通入少量CO2的化学方程式: 。
三、强酸制弱酸的反应规律
较强酸制较弱酸规律:
离子反应的本质:
对于HCl、H2SO4等实际的强酸,可将它的电离平衡常数视为无穷大。
例: HCl + NaF = NaCl + HF
三、强酸制弱酸的反应规律
一元酸的较强酸制较弱酸的反应规律
若三种一元酸HA、HB、HC的电离平衡常数Ka(HA)>Ka(HB)>Ka(HC),
则酸性由强到弱是: ,
则酸根离子结合H+的能力: ,
则可发生的反应有:
HA>HB>HC
C->B->A-
专题3 水溶液中的离子反应
第一单元 弱电解质的电离平衡
第2课时
电离平衡常数 强酸与弱酸的比较
核心素养发展目标
学会运用电离平衡常数描述弱酸弱碱和水的电离程度
学习目标
交流讨论
995.79x10-3
4.21x10-3
98.86x10-3
1.34x10-3
1.78x10-5
1.81x10-5
0.42%
1.34%
提问
你能从数据中得到什么规律?
交流讨论
一、电离平衡常数
定义:
弱酸的电离常数用Ka表示,弱碱的电离常数Kb表示。
1.电离平衡常数的概念
一、电离平衡常数
2.电离平衡常数的表示方法
(1)一元弱酸HA的电离常数:根据 HA H++A-,
可表示为
(2)一元弱碱BOH的电离常数:根据 BOH B++OH-,
可表示为
Ka=
c ( H+) .c( A-)
c(HA)
Kb=
c ( B+).c( OH- )
c(BOH)
一、电离平衡常数
2.电离平衡常数的表示方法
醋酸的电离常数表达式
Ka=
c(CH3COO )·c(H+)
c(CH3COOH)
Kb=
c(NH )·c(OH )
c(NH3·H2O)
+
4
NH3·H2O NH + OH
+
4
CH3COOH H+ + CH3COO
一水合氨的电离常数表达式
一、电离平衡常数
2.电离平衡常数的表示方法
一、电离平衡常数
2.电离平衡常数的表示方法
(3)多元弱酸、多元弱碱的电离平衡常数
多元弱酸的电离是分步进行的,每步各有电离平衡常数,通常用K1、K2等来分别表示。例如,
H2CO3 H++HCO3-
HCO3- H++CO32-
c(HCO3-)
c(H+)
c(H2CO3)
c(H+)
c(HCO3-)
c(CO32-)
Ka1=
Ka2=
一、电离平衡常数
2.电离平衡常数的表示方法
一、电离平衡常数
3.电离平衡常数的影响因素
内因:
由物质的本性所决定。
外因:
只与温度有关。
电解质越弱,Ka(或Kb)越小,越难电离,酸 (碱)的酸(碱)性越弱。
二、电离度
1.电离度的概念及表示方法
表达式:
意义:
电离度实质上是一种平衡转化率,表示弱电解质在水中的电离程度。
当温度和浓度相同时,一元弱酸的α越大,Ka越大、酸性越强。
二、电离度
2.电离度的影响因素
内因:
外因:
弱电解质本身的性质。(决定性因素)
温度——T↑,α↑
浓度——c↑,α↓
3.电离度的计算
乙酰水杨酸(HA)是一种弱酸。在一定温度下,0.1mol/L的乙酰水杨酸溶液中,乙酰水杨酸的电离度为5.7%,求该酸的电离平衡常数。
HA H+ + A-
始:
变:
平:
3.电离度的计算
HAc H+ + Ac-
始: c 0 0
变:
平:
x x x
c-x x x
越稀越电离
项目 C(H+) 酸性 中和碱能力 与活泼金属反应生成H2 的量 与同一金属反应时的起始速率
一元强酸
一元弱酸
大
小
强
弱
相同
小
相同
大
强酸与弱酸的比较
强酸与弱酸的比较
项目 C(H+) 酸性 中和碱能力 与活泼金属反应生成H2 的量 与同一金属反应时的起始速率
一元强酸
一元弱酸
相同
少
小
多
大
相同
相同
习题研究
解析:
25 ℃时,部分物质的电离平衡常数如下表所示:
化学式 CH3COOH H2CO3 HClO
电离平衡常数 1.76×10-5 K1=4.30×10-7
K2=5.61×10-11 2.95×10-8
(1)CH3COOH、H2CO3、HClO的
酸性由强到弱的顺序为 。
(2)试写出向NaClO和CH3COONa的混合溶液中通入少量CO2的化学方程式: 。
三、强酸制弱酸的反应规律
较强酸制较弱酸规律:
离子反应的本质:
对于HCl、H2SO4等实际的强酸,可将它的电离平衡常数视为无穷大。
例: HCl + NaF = NaCl + HF
三、强酸制弱酸的反应规律
一元酸的较强酸制较弱酸的反应规律
若三种一元酸HA、HB、HC的电离平衡常数Ka(HA)>Ka(HB)>Ka(HC),
则酸性由强到弱是: ,
则酸根离子结合H+的能力: ,
则可发生的反应有:
HA>HB>HC
C->B->A-
