苏教版高中化学选择性必修1专题2化学反应速率与化学平衡2.3.1浓度、压强变化对化学平衡的影响教学课件(共39张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修1专题2化学反应速率与化学平衡2.3.1浓度、压强变化对化学平衡的影响教学课件(共39张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 5.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-21 00:00:00 | ||
图片预览











文档简介
(共39张PPT)
专题2 化学反应速率与化学平衡
第三单元 化学平衡的移动
第1课时 浓度、压强变化对化学平衡
的影响
技能目标
1.利用化学平衡常数和浓度商的关系判断化学平衡移动的方向
2.通过实验探究说明浓度对化学平衡移动的影响
学习目标
课前导入
逆、等、动、定、
化学平衡状态的五大特征?
变
改变外界条件,化学平衡被打破,平衡发生移动。
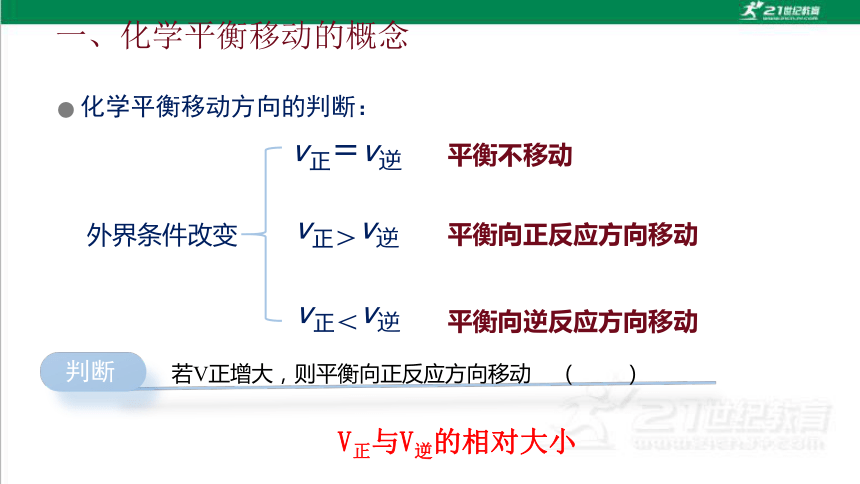
一、化学平衡移动的概念
定义:
当平衡体系条件改变时,原有平衡状态被破坏,一段时间后会达到新的平衡状态。从一个平衡状态变为另一个平衡状态,称为化学平衡的移动。
移动的根本原因:
v正=v逆
v正≠v逆
v’正=v’逆
原化学平衡
平衡被破坏
新化学平衡
条件
改变
一定
时间
改变外界条件后:①v正≠v逆,②各组分的百分含量发生改变。
一、化学平衡移动的概念
类比:
一、化学平衡移动的概念
化学平衡移动方向的判断:
外界条件改变
平衡不移动
v正=v逆
v正>v逆
平衡向正反应方向移动
v正<v逆
平衡向逆反应方向移动
V正与V逆的相对大小
判断
若V正增大,则平衡向正反应方向移动 ( )
随堂训练《导与练》 知识点一 · 基础题组
2.在密闭容器中进行如下反应:CO2(g)+C(s) 2CO(g)。
(1)在单位时间内消耗了1 mol CO2(g),同时又消耗了2 mol CO(g),则v(正)
v(逆),反应处于 状态。
(2)若向该容器中再充入1 mol CO2(g),则v′(正) (填“>”“<”或“=”)v′(逆),化学平衡向 方向移动。
(3)若向该容器中增加C(s),则v′(正) (填“>”“<”或“=”)v′(逆),
化学平衡 移动。
=
平衡
>
正反应
=
不
随堂训练·《导与练》知识点一 基础题组
解析:外界条件改变,平衡不一定发生移动。
1.下列叙述中说明某化学平衡一定发生移动的是( )
A.混合物中各组分的浓度改变
B.混合体系中气体密度发生变化
C.正、逆反应速率改变
D.反应物的转化率改变
D
随堂训练·《导与练》知识点一 · 基础题组
外界条件改变,平衡不一定发生移动。
(1)若条件改变,未引起化学反应速率的变化,则平衡一定不移动,如增加固体的用量。
(2)若条件改变,引起了化学反应速率的变化,但v(正)、v(逆)同等程度地改变,则平衡不发生移动。
(3)若条件改变,引起v(正)≠v(逆),则平衡一定发生移动。
(4)平衡发生移动,说明外界条件一定发生改变。
实验探究一
实验操作:
二、浓度变化对化学平衡的影响
2CrO42-+ 2H+ Cr2O72-+ H2O
黄色
橙色
在溶液中存在如下平衡:
二、浓度变化对化学平衡的影响
宏观现象:
微观分析:
2CrO42-+ 2H+ Cr2O72-+ H2O
黄色
橙色
加酸后颜色变橙
c(H+)增大
平衡向正反应方向移动
平衡向生成Cr2O72-或CrO42-减小方向移动
加碱后颜色变黄
c(H+)减小
平衡向逆反应方向移动
平衡向生成CrO42-或Cr2O72-减小方向移动
二、浓度变化对化学平衡的影响
1.浓度对平衡影响的解释
浓度变化 Qc值
变化 Qc与K
的关系 平衡移
动方向
增大反应
物浓度
减小生成
物浓度
减小反应
物浓度
增大生成
物浓度
减小
增大
Qc =
cp(C) cq(D)
cm(A) cn(B)
m A(g) + n B(g) p C(g) + q D(g)
QcQc>K
正反应方向
逆反应方向
二、浓度变化对化学平衡的影响
②c(反应物)减小或c(生成物)增大,平衡向逆反应方向移动。
2.浓度对化学平衡移动的影响规律
当其他条件不变时:
①c(反应物)增大或c(生成物)减小,平衡向正反应方向移动。
反应物 生成物
二、浓度变化对化学平衡的影响
2.浓度对化学平衡移动的影响规律
浓度商:用任意状态的浓度幂之积的比值,用Qc表示
Q =
cp(C) cq(D)
cm(A) cn(B)
m A(g) + n B(g) p C(g) + q D(g)
Q<K:可逆反应向正反应方向进行。
Q>K:可逆反应向逆反应方向进行;
Q=K:可逆反应处于平衡状态;
二、浓度变化对化学平衡的影响
【学以致用】 P67 填写表2-11
二、浓度变化对化学平衡的影响
3.用v-t图像分析浓度变化对化学平衡移动的影响
V 正>V 逆 平衡正向移动
V(逆)
V
V(正)
t
V(正)= V(逆)
0
t1
①增大反应物浓度
t2
V (正)
V (逆)
V (正)=V (逆)
t3
②减小生成物浓度
t2
t3
V (正)
V (逆)
V (正)=V (逆)
t
0
V
V(正)
V(逆)
V(正) = V(逆)
t1
二、浓度变化对化学平衡的影响
3.用v-t图像分析浓度变化对化学平衡移动的影响
V 逆>V 正 平衡逆向移动
V(逆)
V
V(正)
t
V(正)= V(逆)
0
t1
③增大生成物浓度
t2
V (逆)
V (正)
V (正)=V (逆)
t3
④减小反应物浓度
t2
V (逆)
V (正)
V (正)=V (逆)
t3
0
V
t
V(正)
V(逆)
V(正) = V(逆)
t1
浓度引起平移图像特征:一突变,一渐变。
二、浓度对化学平衡的影响
解析:K+、Cl-不参与反应,增大KCl的浓度,对该离子反应无影响,故平衡不移动。
1.对于可逆反应:FeCl3+3KSCN Fe(SCN)3+3KCl的理解不正确的是( )
A.增大FeCl3的浓度,平衡向正反应方向移动
B.增大KSCN的浓度,平衡向正反应方向移动
C.增大Fe(SCN)3的浓度,平衡向逆反应方向移动
D.增大KCl的浓度,平衡向逆反应方向移动
D
注意事项
1.固体或纯液体的浓度是常数,改变固体或纯液体的量并不影响v正、v逆的大小,故平衡不移动。
2.“浓度对化学平衡影响”中的“浓度”是指与反应有关的气体或溶液中参加反应的离子的浓度。
3.对于离子平衡体系,注意离子浓度的改变方式,排除不参与反应离子的干扰。
二、浓度对化学平衡的影响
2.已知银氨溶液中存在平衡:[Ag(NH3)2]+ Ag++2NH3。向银氨溶液中加入或通入少量下列物质,能使上述平衡向逆反应方向移动的是
( )
A.NH3 B.HNO3 C.KI D.H2O
二、浓度对化学平衡的影响
A
三、压强变化对化学平衡的影响
N2(g)+3H2(g) 2NH3(g)为例,测得不同温度、压强下反应达到平衡时,氨在体系中的物质的量分数。是分析压强改变对合成氨平衡的影响。
三、压强变化对化学平衡的影响
图像分析:
在相同温度下,压强 ,氨气的物质的量分数 ,说明增大压强,平衡往 方向移动。
越大
越高
正反应
三、压强变化对化学平衡的影响
三、压强变化对化学平衡的影响
1.探究压强对化学平衡的影响
N2(g)+3H2(g) 2NH3(g)
K=
c2(NH3)
c(N2)·c3(H2)
若P(压强) 增至原来的a倍(a>1),则Qc= ,平衡 (气体体积 )移动;若P降至原来的1/a(a>1),则Qc= ,平衡 (气体体积 )移动。。
利用Qc与K的相对大小,分析化学平衡的移动
a2K >K
正向
减小
逆向
增大
三、压强变化对化学平衡的影响
【交流讨论】P68
可逆反应 平衡常数表达式 改变压强对平衡的影响
增大压强 减小压强
N2(g)+ 3H2(g) 2NH3(g)
FeO(s)+CO(g) Fe(s)+CO2
N2O4 2NO2
正向移动
逆向移动
逆向移动
正向移动
不移动
不移动
注意:若没有特殊说明,压强的改变就默认为改变容器容积的方法来实现,如增大压强,就默认为压缩气体体积使压强增大。
c2(NO2)
c(N2O4)
c2(NH3)
c(N2)·c3(H2)
·
Qc 与 K的相对大小
c(CO2)
c(CO)
三、压强变化对化学平衡的影响
2.压强对化学平衡移动的影响规律
②减小压强,化学平衡向 的方向移动。
当其他条件不变时:
①增大压强,化学平衡向 的方向移动。
③对于反应前后气体分子数目不变的反应,改变压强平衡 移动。
气体体积减小
气体体积增大
不
三、压强变化对化学平衡的影响
3.用v-t图像分析压强变化对化学平衡移动的影响
⑴当 m + n > p + q时:
V
t
0
V(正)
V(逆)
V(正)
V(逆)
V
t
0
V(正)
V(逆)
V(逆)
V(正)
①增大压强
②减小压强
mA (g) + nB(g) pC(g) + qD(g)
3.用v-t图像分析压强变化对化学平衡移动的影响
mA (g) + nB(g) pC(g) + qD(g)
⑵当 m + n < p + q 时:
V
t
0
V(正)
V(逆)
V’(逆)
V’(正)
③增大压强
④减小压强
V
t
0
V(正)
V(逆)
V’(正)
V’(逆)
压强引起平移图像特征:两突变。
3.用v-t图像分析压强变化对化学平衡移动的影响
mA (g) + nB(g) pC(g) + qD(g)
V
t
0
V(正)
V(逆)
⑤增大压强
⑥减小压强
V
t
0
V(正)
V(逆)
V正 = V逆
V正 = V逆
⑶当 m + n = p + q 时:
3.用v-t图像分析压强变化对化学平衡移动的影响
改变压强造成平衡移动时,增大压强,各气体组分的平衡浓度 ;减小压强,各气体组分的平衡浓度 。与平衡是否移动以及移动方向 。
均增大
均减小
无关
三、压强变化对化学平衡的影响
4.充入惰性气体对平衡移动的影响
恒容
原平衡体系
体系总压强增大
各组分浓度不变
平衡不移动
充入
“惰性气体”
恒温、恒容
三、压强变化对化学平衡的影响
4.充入惰性气体对平衡移动的影响
恒压
平衡向气体分子数
增大的方向移动
容器容积增大,各组分浓度同倍减小(等效于减压)
恒温、恒压
原平衡体系
充入
“惰性气体”
平衡不移动
反应前后气体体积变化
反应前后气体体积不变
三、压强变化对化学平衡的影响
4.充入惰性气体对平衡移动的影响
对于反应前后气体体积相等的反应[如H2(g)+I2(g) 2HI(g)],当向平衡体系中充入“惰性”气体时,则无论任何情况下平衡都不发生移动。
在恒容容器中,改变其中一种物质的浓度时,必然同时引起压强的改变,但判断平衡移动的方向时,应以浓度的影响进行分析,得出Qc与K 的关系。
总结·归纳
1.恒温恒容的条件下,充入惰性气体,使压强增大,
2.反应前后气体物质化学计量数之和相等的反应,缩小容器体积,使压强增大,平衡均不会发生移动
3.无气体参与或生成的反应,改变压强对反应平衡无影响。
增大压强平衡一定发生移动吗?
四、利用色度传感器探究压强对化学平衡的影响
习题研究
解析:
2. mA(g)+nB(g) pC(g)+qD(g)
增大
(1)①表示改变压强的方式是压强 ,化学平衡 移动,m+n p+q。
(2)②表示改变压强的方式是压强 ,化学平衡 移动,m+n p+q。
(3)③表示改变压强的方式是压强 ,化学平衡 移动,m+n p+q。
减小
减小
逆向
正向
不
<
<
=
习题研究
3.在密闭容器中,反应:xA(g)+yB(g) z C(g),在一定条件下达到平衡状态,试回答下列问题:
(1)若x+y>z,缩小体积,增大压强,则平衡 移动。
(2)若保持体积不变,通入氦气,则平衡 移动。
(3)若保持压强不变,通入氦气,平衡向正反应方向移动,则x、y、z的关系为 。
(4)若x+y=z,缩小体积,增大压强,则平衡 移动。
正向
不
X+Y<Z
不
压强对化学平衡影响的判断思路
1.如果是同等程度地改变各组分气体的浓度,则按照压强变化来考虑。
2.如果不是同等程度地改变各组分气体的浓度(比如改变一种或几种),则按照浓度变化来考虑。
专题2 化学反应速率与化学平衡
第三单元 化学平衡的移动
第1课时 浓度、压强变化对化学平衡
的影响
技能目标
1.利用化学平衡常数和浓度商的关系判断化学平衡移动的方向
2.通过实验探究说明浓度对化学平衡移动的影响
学习目标
课前导入
逆、等、动、定、
化学平衡状态的五大特征?
变
改变外界条件,化学平衡被打破,平衡发生移动。
一、化学平衡移动的概念
定义:
当平衡体系条件改变时,原有平衡状态被破坏,一段时间后会达到新的平衡状态。从一个平衡状态变为另一个平衡状态,称为化学平衡的移动。
移动的根本原因:
v正=v逆
v正≠v逆
v’正=v’逆
原化学平衡
平衡被破坏
新化学平衡
条件
改变
一定
时间
改变外界条件后:①v正≠v逆,②各组分的百分含量发生改变。
一、化学平衡移动的概念
类比:
一、化学平衡移动的概念
化学平衡移动方向的判断:
外界条件改变
平衡不移动
v正=v逆
v正>v逆
平衡向正反应方向移动
v正<v逆
平衡向逆反应方向移动
V正与V逆的相对大小
判断
若V正增大,则平衡向正反应方向移动 ( )
随堂训练《导与练》 知识点一 · 基础题组
2.在密闭容器中进行如下反应:CO2(g)+C(s) 2CO(g)。
(1)在单位时间内消耗了1 mol CO2(g),同时又消耗了2 mol CO(g),则v(正)
v(逆),反应处于 状态。
(2)若向该容器中再充入1 mol CO2(g),则v′(正) (填“>”“<”或“=”)v′(逆),化学平衡向 方向移动。
(3)若向该容器中增加C(s),则v′(正) (填“>”“<”或“=”)v′(逆),
化学平衡 移动。
=
平衡
>
正反应
=
不
随堂训练·《导与练》知识点一 基础题组
解析:外界条件改变,平衡不一定发生移动。
1.下列叙述中说明某化学平衡一定发生移动的是( )
A.混合物中各组分的浓度改变
B.混合体系中气体密度发生变化
C.正、逆反应速率改变
D.反应物的转化率改变
D
随堂训练·《导与练》知识点一 · 基础题组
外界条件改变,平衡不一定发生移动。
(1)若条件改变,未引起化学反应速率的变化,则平衡一定不移动,如增加固体的用量。
(2)若条件改变,引起了化学反应速率的变化,但v(正)、v(逆)同等程度地改变,则平衡不发生移动。
(3)若条件改变,引起v(正)≠v(逆),则平衡一定发生移动。
(4)平衡发生移动,说明外界条件一定发生改变。
实验探究一
实验操作:
二、浓度变化对化学平衡的影响
2CrO42-+ 2H+ Cr2O72-+ H2O
黄色
橙色
在溶液中存在如下平衡:
二、浓度变化对化学平衡的影响
宏观现象:
微观分析:
2CrO42-+ 2H+ Cr2O72-+ H2O
黄色
橙色
加酸后颜色变橙
c(H+)增大
平衡向正反应方向移动
平衡向生成Cr2O72-或CrO42-减小方向移动
加碱后颜色变黄
c(H+)减小
平衡向逆反应方向移动
平衡向生成CrO42-或Cr2O72-减小方向移动
二、浓度变化对化学平衡的影响
1.浓度对平衡影响的解释
浓度变化 Qc值
变化 Qc与K
的关系 平衡移
动方向
增大反应
物浓度
减小生成
物浓度
减小反应
物浓度
增大生成
物浓度
减小
增大
Qc =
cp(C) cq(D)
cm(A) cn(B)
m A(g) + n B(g) p C(g) + q D(g)
Qc
正反应方向
逆反应方向
二、浓度变化对化学平衡的影响
②c(反应物)减小或c(生成物)增大,平衡向逆反应方向移动。
2.浓度对化学平衡移动的影响规律
当其他条件不变时:
①c(反应物)增大或c(生成物)减小,平衡向正反应方向移动。
反应物 生成物
二、浓度变化对化学平衡的影响
2.浓度对化学平衡移动的影响规律
浓度商:用任意状态的浓度幂之积的比值,用Qc表示
Q =
cp(C) cq(D)
cm(A) cn(B)
m A(g) + n B(g) p C(g) + q D(g)
Q<K:可逆反应向正反应方向进行。
Q>K:可逆反应向逆反应方向进行;
Q=K:可逆反应处于平衡状态;
二、浓度变化对化学平衡的影响
【学以致用】 P67 填写表2-11
二、浓度变化对化学平衡的影响
3.用v-t图像分析浓度变化对化学平衡移动的影响
V 正>V 逆 平衡正向移动
V(逆)
V
V(正)
t
V(正)= V(逆)
0
t1
①增大反应物浓度
t2
V (正)
V (逆)
V (正)=V (逆)
t3
②减小生成物浓度
t2
t3
V (正)
V (逆)
V (正)=V (逆)
t
0
V
V(正)
V(逆)
V(正) = V(逆)
t1
二、浓度变化对化学平衡的影响
3.用v-t图像分析浓度变化对化学平衡移动的影响
V 逆>V 正 平衡逆向移动
V(逆)
V
V(正)
t
V(正)= V(逆)
0
t1
③增大生成物浓度
t2
V (逆)
V (正)
V (正)=V (逆)
t3
④减小反应物浓度
t2
V (逆)
V (正)
V (正)=V (逆)
t3
0
V
t
V(正)
V(逆)
V(正) = V(逆)
t1
浓度引起平移图像特征:一突变,一渐变。
二、浓度对化学平衡的影响
解析:K+、Cl-不参与反应,增大KCl的浓度,对该离子反应无影响,故平衡不移动。
1.对于可逆反应:FeCl3+3KSCN Fe(SCN)3+3KCl的理解不正确的是( )
A.增大FeCl3的浓度,平衡向正反应方向移动
B.增大KSCN的浓度,平衡向正反应方向移动
C.增大Fe(SCN)3的浓度,平衡向逆反应方向移动
D.增大KCl的浓度,平衡向逆反应方向移动
D
注意事项
1.固体或纯液体的浓度是常数,改变固体或纯液体的量并不影响v正、v逆的大小,故平衡不移动。
2.“浓度对化学平衡影响”中的“浓度”是指与反应有关的气体或溶液中参加反应的离子的浓度。
3.对于离子平衡体系,注意离子浓度的改变方式,排除不参与反应离子的干扰。
二、浓度对化学平衡的影响
2.已知银氨溶液中存在平衡:[Ag(NH3)2]+ Ag++2NH3。向银氨溶液中加入或通入少量下列物质,能使上述平衡向逆反应方向移动的是
( )
A.NH3 B.HNO3 C.KI D.H2O
二、浓度对化学平衡的影响
A
三、压强变化对化学平衡的影响
N2(g)+3H2(g) 2NH3(g)为例,测得不同温度、压强下反应达到平衡时,氨在体系中的物质的量分数。是分析压强改变对合成氨平衡的影响。
三、压强变化对化学平衡的影响
图像分析:
在相同温度下,压强 ,氨气的物质的量分数 ,说明增大压强,平衡往 方向移动。
越大
越高
正反应
三、压强变化对化学平衡的影响
三、压强变化对化学平衡的影响
1.探究压强对化学平衡的影响
N2(g)+3H2(g) 2NH3(g)
K=
c2(NH3)
c(N2)·c3(H2)
若P(压强) 增至原来的a倍(a>1),则Qc= ,平衡 (气体体积 )移动;若P降至原来的1/a(a>1),则Qc= ,平衡 (气体体积 )移动。。
利用Qc与K的相对大小,分析化学平衡的移动
a2K >K
正向
减小
逆向
增大
三、压强变化对化学平衡的影响
【交流讨论】P68
可逆反应 平衡常数表达式 改变压强对平衡的影响
增大压强 减小压强
N2(g)+ 3H2(g) 2NH3(g)
FeO(s)+CO(g) Fe(s)+CO2
N2O4 2NO2
正向移动
逆向移动
逆向移动
正向移动
不移动
不移动
注意:若没有特殊说明,压强的改变就默认为改变容器容积的方法来实现,如增大压强,就默认为压缩气体体积使压强增大。
c2(NO2)
c(N2O4)
c2(NH3)
c(N2)·c3(H2)
·
Qc 与 K的相对大小
c(CO2)
c(CO)
三、压强变化对化学平衡的影响
2.压强对化学平衡移动的影响规律
②减小压强,化学平衡向 的方向移动。
当其他条件不变时:
①增大压强,化学平衡向 的方向移动。
③对于反应前后气体分子数目不变的反应,改变压强平衡 移动。
气体体积减小
气体体积增大
不
三、压强变化对化学平衡的影响
3.用v-t图像分析压强变化对化学平衡移动的影响
⑴当 m + n > p + q时:
V
t
0
V(正)
V(逆)
V(正)
V(逆)
V
t
0
V(正)
V(逆)
V(逆)
V(正)
①增大压强
②减小压强
mA (g) + nB(g) pC(g) + qD(g)
3.用v-t图像分析压强变化对化学平衡移动的影响
mA (g) + nB(g) pC(g) + qD(g)
⑵当 m + n < p + q 时:
V
t
0
V(正)
V(逆)
V’(逆)
V’(正)
③增大压强
④减小压强
V
t
0
V(正)
V(逆)
V’(正)
V’(逆)
压强引起平移图像特征:两突变。
3.用v-t图像分析压强变化对化学平衡移动的影响
mA (g) + nB(g) pC(g) + qD(g)
V
t
0
V(正)
V(逆)
⑤增大压强
⑥减小压强
V
t
0
V(正)
V(逆)
V正 = V逆
V正 = V逆
⑶当 m + n = p + q 时:
3.用v-t图像分析压强变化对化学平衡移动的影响
改变压强造成平衡移动时,增大压强,各气体组分的平衡浓度 ;减小压强,各气体组分的平衡浓度 。与平衡是否移动以及移动方向 。
均增大
均减小
无关
三、压强变化对化学平衡的影响
4.充入惰性气体对平衡移动的影响
恒容
原平衡体系
体系总压强增大
各组分浓度不变
平衡不移动
充入
“惰性气体”
恒温、恒容
三、压强变化对化学平衡的影响
4.充入惰性气体对平衡移动的影响
恒压
平衡向气体分子数
增大的方向移动
容器容积增大,各组分浓度同倍减小(等效于减压)
恒温、恒压
原平衡体系
充入
“惰性气体”
平衡不移动
反应前后气体体积变化
反应前后气体体积不变
三、压强变化对化学平衡的影响
4.充入惰性气体对平衡移动的影响
对于反应前后气体体积相等的反应[如H2(g)+I2(g) 2HI(g)],当向平衡体系中充入“惰性”气体时,则无论任何情况下平衡都不发生移动。
在恒容容器中,改变其中一种物质的浓度时,必然同时引起压强的改变,但判断平衡移动的方向时,应以浓度的影响进行分析,得出Qc与K 的关系。
总结·归纳
1.恒温恒容的条件下,充入惰性气体,使压强增大,
2.反应前后气体物质化学计量数之和相等的反应,缩小容器体积,使压强增大,平衡均不会发生移动
3.无气体参与或生成的反应,改变压强对反应平衡无影响。
增大压强平衡一定发生移动吗?
四、利用色度传感器探究压强对化学平衡的影响
习题研究
解析:
2. mA(g)+nB(g) pC(g)+qD(g)
增大
(1)①表示改变压强的方式是压强 ,化学平衡 移动,m+n p+q。
(2)②表示改变压强的方式是压强 ,化学平衡 移动,m+n p+q。
(3)③表示改变压强的方式是压强 ,化学平衡 移动,m+n p+q。
减小
减小
逆向
正向
不
<
<
=
习题研究
3.在密闭容器中,反应:xA(g)+yB(g) z C(g),在一定条件下达到平衡状态,试回答下列问题:
(1)若x+y>z,缩小体积,增大压强,则平衡 移动。
(2)若保持体积不变,通入氦气,则平衡 移动。
(3)若保持压强不变,通入氦气,平衡向正反应方向移动,则x、y、z的关系为 。
(4)若x+y=z,缩小体积,增大压强,则平衡 移动。
正向
不
X+Y<Z
不
压强对化学平衡影响的判断思路
1.如果是同等程度地改变各组分气体的浓度,则按照压强变化来考虑。
2.如果不是同等程度地改变各组分气体的浓度(比如改变一种或几种),则按照浓度变化来考虑。
