苏教版高中化学选择性必修1专题3水溶液中的离子反应3.4.2沉淀溶解平衡原理的应用教学课件(共15张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修1专题3水溶液中的离子反应3.4.2沉淀溶解平衡原理的应用教学课件(共15张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-21 18:01:21 | ||
图片预览





文档简介
(共15张PPT)
第四单元 沉淀溶解平衡
陕西商洛柞水县柞水溶洞
第2课时 沉淀溶解平衡原理的应用
专题3 水溶液中的离子反应
据有关资料介绍,全国目前有近40万余台锅炉,在每年的事故统计中,因水质不良、水垢严重引起的事故超过事故数的20%。由于结生水垢,每年要浪费燃料达千万吨,并造成了几亿元的经济损失。
锅炉的水垢的主要成分CaCO3、Mg(OH)2和CaSO4,用酸可以除去CaCO3、Mg(OH)2 , CaSO4怎么除去呢?
思考:
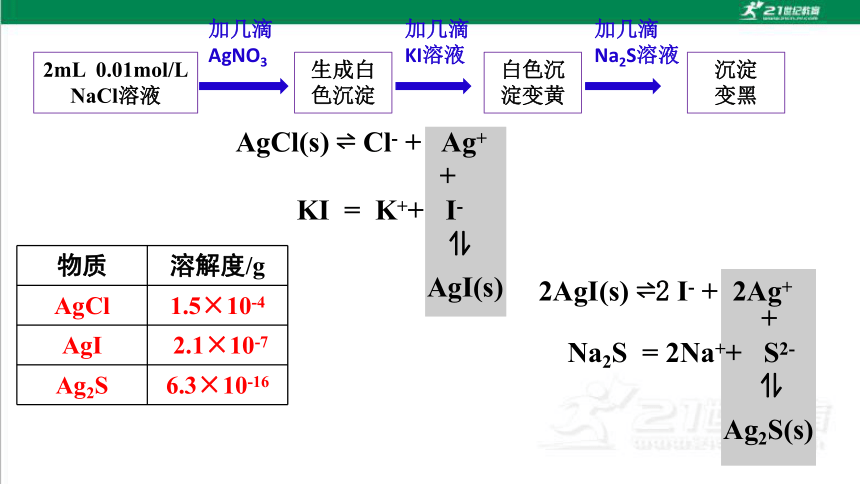
2mL 0.01mol/L
NaCl溶液
生成白色沉淀
加几滴
AgNO3
加几滴
KI溶液
白色沉淀变黄
加几滴
Na2S溶液
沉淀
变黑
AgCl(s) Cl- + Ag+
+
KI = K++ I-
AgI(s)
2AgI(s) 2 I- + 2Ag+
+
Na2S = 2Na++ S2-
Ag2S(s)
物质 溶解度/g
AgCl 1.5×10-4
AgI 2.1×10-7
Ag2S 6.3×10-16
一、沉淀的转化
1.实质:沉淀溶解平衡的移动
①一般溶解能力相对较强的物质易转化为溶解能力相对较弱的物质 。
2.沉淀转化的类型
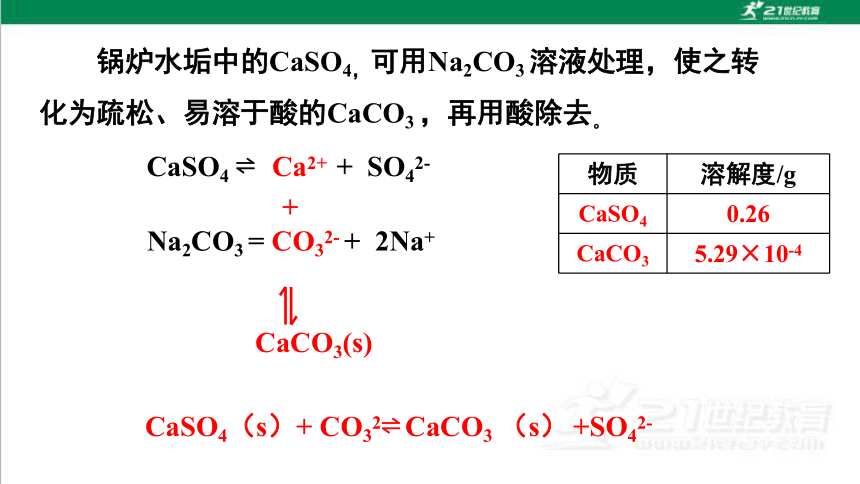
CaSO4 Ca2+ + SO42-
+
CaCO3(s)
CaSO4(s)+ CO32 CaCO3 (s) +SO42-
Na2CO3 = CO32- + 2Na+
锅炉水垢中的CaSO4,可用Na2CO3 溶液处理,使之转化为疏松、易溶于酸的CaCO3 ,再用酸除去。
物质 溶解度/g
CaSO4 0.26
CaCO3 5.29×10-4
例如:重晶石BaSO4转化为易溶于酸的BaCO3 。
②在某些特殊情况下,控制反应条件,也能使溶解能力相对较弱的物质转化为溶解能力相对较强的物质 。
BaSO4 Ba2+ + SO42-
+
BaCO3(s)
BaSO4(s)+ CO32 BaCO3 (s) +SO42-
Na2CO3 = CO32- + 2Na+
物质 溶解度/g
BaSO4 2.4×10-4
BaCO3 1.4×10-3
BaCO3
BaSO4
①饱和Na2CO3溶液
②移走上层溶液
BaSO4 、
BaCO3
(重复①②操作)
Ba2+
……
H+
龋齿的形成与预防
1. 牙釉质:主要成分为Ca5(PO4)3OH(羟基磷灰石);是一种难溶电解质。
2. 残留在牙齿上的糖发酵会产生H+。
Ca5(PO4)3OH(s) 5Ca2++ 3PO43- + OH-
3H+
3HPO42-
+
+
H+
H2O
Ca5(PO4)3OH(s)+F- Ca5(PO4)3F(s) + OH-
含氟牙膏中的氟离子会与 Ca5(PO4)3OH 反应生成Ca5(PO4)3F (氟磷灰石) 。
龋齿的预防
二、沉淀的生成
1.工业废水中除去Cu2+、Hg2+等重金属离子,应使生成沉淀溶解度越小越好,一般选择Na2S做沉淀剂。
KSP(MnS)=2.5×10-13mol2·L-2
KSP(FeS)=6.3×10-18 mol2·L-2
KSP(CuS)=1.3×10-36 mol2·L-2
KSP(HgS)=6.4×10-53 mol2·L-2
2.沉淀剂在沉淀杂质离子时,不影响其他离子的存在。
常温下,Cu2+/Sn4+混合液中c(Cu2+)=0.022mol·L-1, 若将Sn4+完全沉淀,调节溶液的pH范围为_______。
(当溶液中的离子浓度小于10-5mol·L-1时,沉淀完全,
已知:Ksp[Sn(OH)4]=1×10-55;Ksp[Cu(OH)2]=2.2×10-20)
思考: ①Sn4+完全沉淀时PH怎样计算?
②PH等于多少时Cu2+开始沉淀
交流与讨论
①为保证Sn4+沉淀完全(c(Sn4+) ≤10-5mol·L-1)
c(OH-)=
=
=
1×10-12.5mol·L-1
则c(H+)=1×10-1.5mol·L-1,pH=1.5
②为保证Cu2+(0.022mol·L-1)不沉淀
c ˊ(OH-)=
=
=
1×10-9mol·L-1
则c(H+)=1×10-5mol·L-1,pH=5
1.5≤PH<5
思考:
如果误食可溶性钡盐,造成钡中毒,应尽快用5.0%的Na2SO4溶液给患者洗胃,为什么?
BaSO4(s) Ba2+(aq) + SO42-(aq)
增大c(SO42-),使Qc>Ksp以产生BaSO4沉淀。
第四单元 沉淀溶解平衡
陕西商洛柞水县柞水溶洞
第2课时 沉淀溶解平衡原理的应用
专题3 水溶液中的离子反应
据有关资料介绍,全国目前有近40万余台锅炉,在每年的事故统计中,因水质不良、水垢严重引起的事故超过事故数的20%。由于结生水垢,每年要浪费燃料达千万吨,并造成了几亿元的经济损失。
锅炉的水垢的主要成分CaCO3、Mg(OH)2和CaSO4,用酸可以除去CaCO3、Mg(OH)2 , CaSO4怎么除去呢?
思考:
2mL 0.01mol/L
NaCl溶液
生成白色沉淀
加几滴
AgNO3
加几滴
KI溶液
白色沉淀变黄
加几滴
Na2S溶液
沉淀
变黑
AgCl(s) Cl- + Ag+
+
KI = K++ I-
AgI(s)
2AgI(s) 2 I- + 2Ag+
+
Na2S = 2Na++ S2-
Ag2S(s)
物质 溶解度/g
AgCl 1.5×10-4
AgI 2.1×10-7
Ag2S 6.3×10-16
一、沉淀的转化
1.实质:沉淀溶解平衡的移动
①一般溶解能力相对较强的物质易转化为溶解能力相对较弱的物质 。
2.沉淀转化的类型
CaSO4 Ca2+ + SO42-
+
CaCO3(s)
CaSO4(s)+ CO32 CaCO3 (s) +SO42-
Na2CO3 = CO32- + 2Na+
锅炉水垢中的CaSO4,可用Na2CO3 溶液处理,使之转化为疏松、易溶于酸的CaCO3 ,再用酸除去。
物质 溶解度/g
CaSO4 0.26
CaCO3 5.29×10-4
例如:重晶石BaSO4转化为易溶于酸的BaCO3 。
②在某些特殊情况下,控制反应条件,也能使溶解能力相对较弱的物质转化为溶解能力相对较强的物质 。
BaSO4 Ba2+ + SO42-
+
BaCO3(s)
BaSO4(s)+ CO32 BaCO3 (s) +SO42-
Na2CO3 = CO32- + 2Na+
物质 溶解度/g
BaSO4 2.4×10-4
BaCO3 1.4×10-3
BaCO3
BaSO4
①饱和Na2CO3溶液
②移走上层溶液
BaSO4 、
BaCO3
(重复①②操作)
Ba2+
……
H+
龋齿的形成与预防
1. 牙釉质:主要成分为Ca5(PO4)3OH(羟基磷灰石);是一种难溶电解质。
2. 残留在牙齿上的糖发酵会产生H+。
Ca5(PO4)3OH(s) 5Ca2++ 3PO43- + OH-
3H+
3HPO42-
+
+
H+
H2O
Ca5(PO4)3OH(s)+F- Ca5(PO4)3F(s) + OH-
含氟牙膏中的氟离子会与 Ca5(PO4)3OH 反应生成Ca5(PO4)3F (氟磷灰石) 。
龋齿的预防
二、沉淀的生成
1.工业废水中除去Cu2+、Hg2+等重金属离子,应使生成沉淀溶解度越小越好,一般选择Na2S做沉淀剂。
KSP(MnS)=2.5×10-13mol2·L-2
KSP(FeS)=6.3×10-18 mol2·L-2
KSP(CuS)=1.3×10-36 mol2·L-2
KSP(HgS)=6.4×10-53 mol2·L-2
2.沉淀剂在沉淀杂质离子时,不影响其他离子的存在。
常温下,Cu2+/Sn4+混合液中c(Cu2+)=0.022mol·L-1, 若将Sn4+完全沉淀,调节溶液的pH范围为_______。
(当溶液中的离子浓度小于10-5mol·L-1时,沉淀完全,
已知:Ksp[Sn(OH)4]=1×10-55;Ksp[Cu(OH)2]=2.2×10-20)
思考: ①Sn4+完全沉淀时PH怎样计算?
②PH等于多少时Cu2+开始沉淀
交流与讨论
①为保证Sn4+沉淀完全(c(Sn4+) ≤10-5mol·L-1)
c(OH-)=
=
=
1×10-12.5mol·L-1
则c(H+)=1×10-1.5mol·L-1,pH=1.5
②为保证Cu2+(0.022mol·L-1)不沉淀
c ˊ(OH-)=
=
=
1×10-9mol·L-1
则c(H+)=1×10-5mol·L-1,pH=5
1.5≤PH<5
思考:
如果误食可溶性钡盐,造成钡中毒,应尽快用5.0%的Na2SO4溶液给患者洗胃,为什么?
BaSO4(s) Ba2+(aq) + SO42-(aq)
增大c(SO42-),使Qc>Ksp以产生BaSO4沉淀。
