苏教版高中化学选择性必修1专题3水溶液中的离子反应3.4.1沉淀溶解平衡原理教学课件(共27张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修1专题3水溶液中的离子反应3.4.1沉淀溶解平衡原理教学课件(共27张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-21 18:01:40 | ||
图片预览




文档简介
(共27张PPT)
教 学 目 标
核 心 素 养
1.知道难溶电解质的沉淀溶解平衡及其影响因素。
2.掌握溶度积常数,能多角度、动态地分析难溶电解质的溶解平衡。
证据推理与模型认知:知道溶度积的意义,建立根据溶度积判断反应进行方向的思维模型。
珊瑚
溶洞
龋齿
化学· 生活
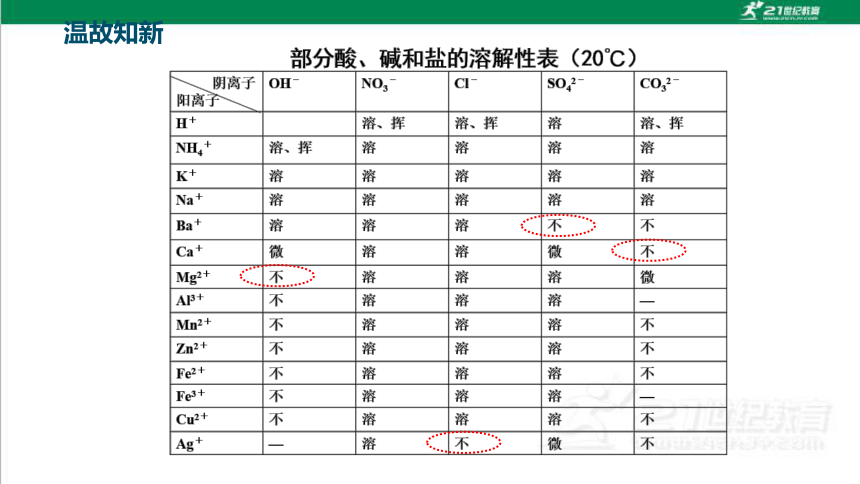
温故知新
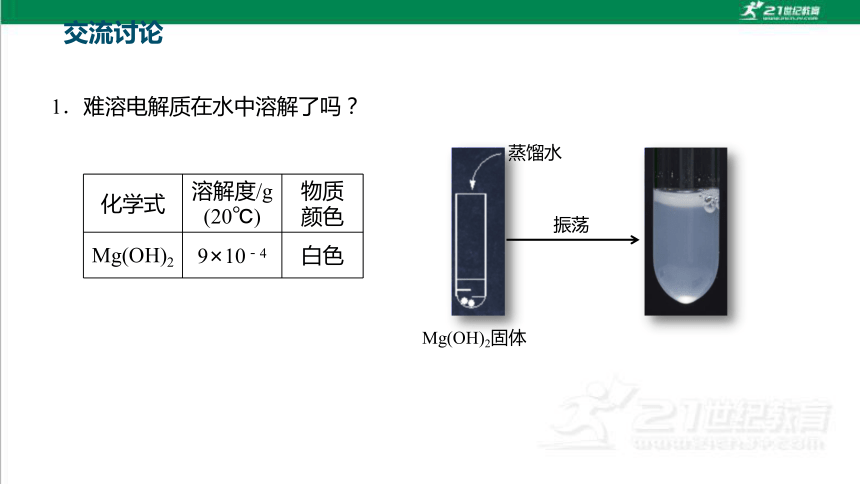
1.难溶电解质在水中溶解了吗?
Mg(OH)2固体
蒸馏水
振荡
化学式 溶解度/g
(20℃) 物质
颜色
Mg(OH)2 9×10-4 白色
交流讨论
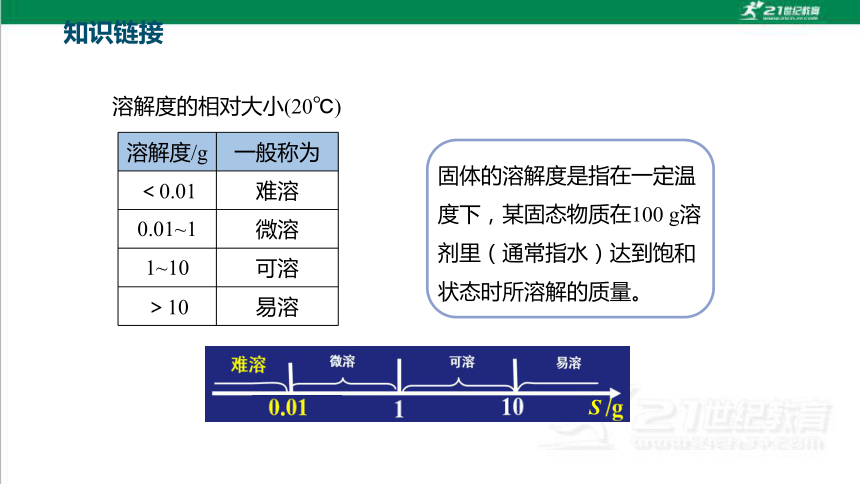
固体的溶解度是指在一定温度下,某固态物质在100 g溶剂里(通常指水)达到饱和状态时所溶解的质量。
溶解度/g 一般称为
<0.01 难溶
0.01~1 微溶
1~10 可溶
>10 易溶
溶解度的相对大小(20℃)
S
知识链接
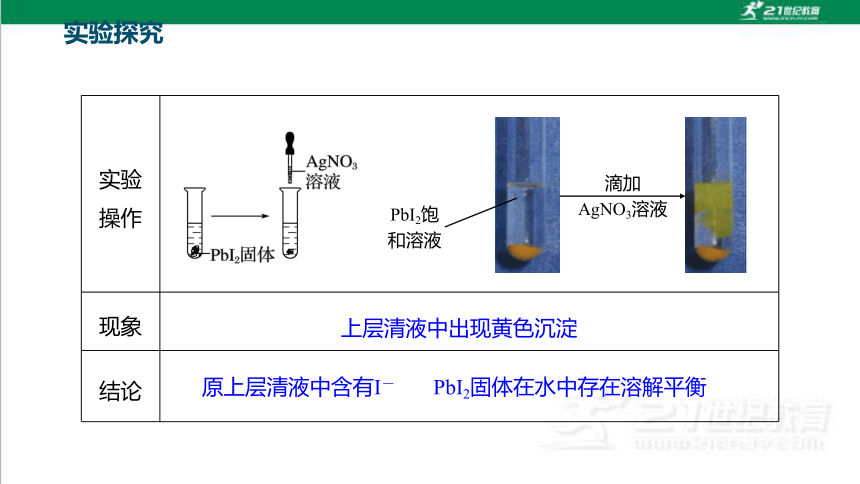
实验
操作
现象
结论
PbI2饱和溶液
上层清液中出现黄色沉淀
原上层清液中含有I-
PbI2固体在水中存在溶解平衡
滴加
AgNO3溶液
实验探究
PbI2
难溶电解质的溶解是绝对的,不溶是相对的
解释:尽管PbI2固体难溶于水,但仍有部分Pb2+和I-离开固体表面进入溶液,同时进入溶液的Pb2+和I-又会在固体表面沉淀下来,当这两个过程速率相等时,Pb2+和I-的沉淀与PbI2固体的溶解达到平衡状态。
实验结论
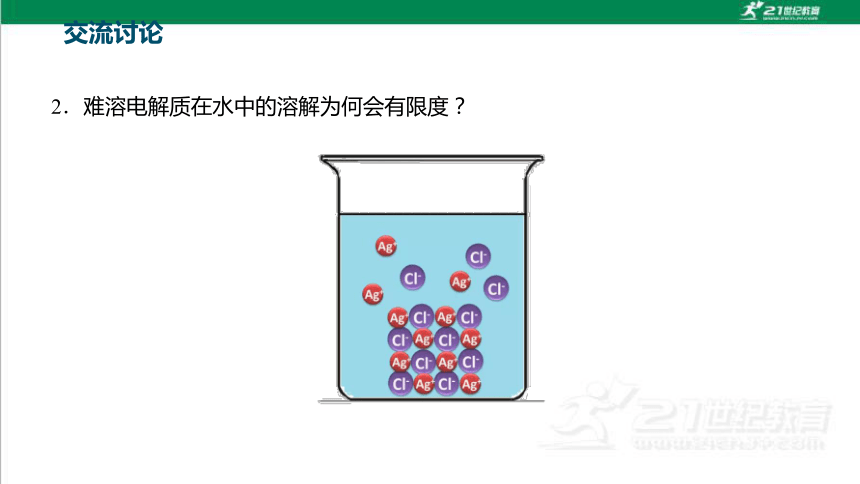
2.难溶电解质在水中的溶解为何会有限度?
交流讨论
1.沉淀溶解平衡的建立
v(溶解)=v(沉淀)
v
v(溶解)
v(沉淀)
t
AgCl(s) Ag+ (aq) + Cl-(aq)
沉淀
溶解
一、沉淀溶解平衡
在一定温度下,当难溶电解质溶于水形成饱和溶液时,溶解的速率和生成沉淀的速率相等,达到平衡状态,我们把这种平衡称为沉淀溶解平衡。
2.沉淀溶解平衡的表达式
一、沉淀溶解平衡
MmAn(s) mMn+(aq) + nAm- (aq)
3.沉淀溶解平衡的特征
v(溶解)=v(沉淀)
v
v(溶解)
v(沉淀)
t
逆——溶解和沉淀互为可逆过程
变—— 当条件改变时,溶解平衡可能发生移动
等—— v溶解 = v沉淀 ≠ 0
动—— 动态平衡,溶解和沉淀仍在进行
定—— 平衡状态下,难溶电解质的质量及相应离子的浓度不再变化,均为定值
一、沉淀溶解平衡
3.如何定量描述难溶电解质的溶解限度?
定性
定量
沉淀溶解平衡
平衡常数
PbI2(s) Pb2+(aq) +2 I- (aq)
交流讨论
1.定义
符号:Ksp
难溶电解质的沉淀溶解平衡的平衡常数,称为溶度积常数,简称溶度积
2.表达式
AgCl (s) Ag+(aq) + Cl- (aq)
Fe(OH)3(s) Fe3+(aq)+3OH- (aq)
MmAn(s) mMn+(aq) + nAm- (aq)
3.影响因素
Ksp的大小只与难溶电解质本身的性质和温度有关。
二、溶度积
4.分析Ksp值,可以得出哪些结论?
类型 化学式 溶度积Ksp 溶解度/g
AB AgBr 5.0×10-13 8.4×10-6
AB AgCl 1.8×10-10 1.5×10-4
A2B Ag2CrO4 1.1×10-12 2.2×10-3
A2B Ag2S 6.3×10-50 1.3×10-16
结论:相同类型的难溶电解质的Ksp越小,溶解度越小
交流讨论
一定的温度下,相同类型的难溶电解质的Ksp越小,溶解度越小。
(1)Ksp反映了难溶电解质在水中的溶解能力。
4.意义
二、溶度积
4.意义
二、溶度积
未达平衡状态
已达平衡状态
未达平衡状态
(2)借助Ksp可以判断难溶电解质在水中是否达到沉淀溶解平衡状态以及可逆过程进行的方向。
Q> Ksp,生成沉淀
Q= Ksp 沉淀溶解平衡
Q< Ksp,沉淀溶解
1.已知碳酸钙难溶于水。
(1)CaCO3在水中的溶解平衡可表示为__________________________________。
(2)碳酸钙的溶度积常数表达式为_____________________________。
(3)在常温下,将少量碳酸钙加入一定量的水中,充分搅拌后仍有固体存在。此时溶解过程是否停止?请说明理由。
未停止,溶解速率和沉淀速率相等,达到平衡。
学以致用
(5)请设计实验方案,使碳酸钙的沉淀溶解平衡向碳酸钙溶解的方向移动。
水中Ca2+浓度大
加水、加热、加酸等
学以致用
(4)将碳酸钙分别加入水和饱和碳酸钠溶液中,达到沉淀溶解平衡,请比较两个体系中Ca2+浓度的大小。
2.将10 mL 0.02 mol·L-1的CaCl2溶液与等体积、等浓度的Na2C2O4溶液相混合,已知CaC2O4的Ksp=2.32×10-9。判断是否有CaC2O4沉淀生成。
根据溶度积规则:
有沉淀生成
学以致用
PbI2饱和溶液
滴加KI溶液
你能从沉淀溶解平衡角度解释这个实验所观察到的现象吗?
c(I-)增大
Q 增大
Q = c(Pb2+)·c2(I-)
Q > Ksp
平衡逆向移动
PbI2(s)
Pb2+(aq) + 2I-(aq)
交流讨论
外界条件 Ksp Q 移动
方向 达到新平衡后
c(Mg2+) 达到新平衡后c(OH-)
升高温度
加入MgCl2固体
通入HCl
预测下列条件改变对氢氧化镁悬浊液沉淀溶解平衡的影响。
Mg(OH)2(s) Mg2+(aq)+2OH-(aq) ΔH >0
正向
不变
增大
增大
增大
逆向
增大
减小
不变
正向
不变
增大
增大
减小
减小
交流讨论
实验探究
2.外界条件对溶解平衡的影响
(1)温度升高,大多数溶解平衡向溶解的方向移动。
但如Ca(OH)2,温度越高,溶解度越小。
(2)加水稀释,浓度减小,溶解平衡向溶解的方向移动。
(4)加入与难溶电解质溶解所得的离子反应的物质,溶解平衡向溶解的方向移动。
(3)加入与难溶电解质构成粒子相同的物质,溶解平衡向生成沉淀的方向移动,称同离子效应。
三、影响沉淀溶解平衡的因素
1.内因
难溶电解质本身的性质
沉淀溶解平衡
特征
溶度积(Ksp)
逆、等、动、定、变
难溶电解质
定性
定量
只受温度影响
反映溶解程度
与Q比较做判断
课堂小结
1.将AgCl分别投入下列溶液中:
①40 mL 0.03 mol·L-1的HCl溶液 ②50 mL 0.03 mol·L-1的AgNO3溶液
③30 mL 0.02 mol·L-1的CaCl2溶液 ④10 mL蒸馏水。
AgCl的溶解度由大到小的顺序是_______________。
④>①=②>③
解析 AgCl(s)在溶液中存在如下沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq)
①中c(Cl-)=0.03 mol·L-1,抑制了AgCl(s)的溶解,使得AgCl(s)的溶解度减小,
②中c(Ag+)=0.03 mol·L-1,也抑制了AgCl(s)的溶解,且抑制程度与①相同,
③中的c(Cl-)=0.04 mol·L-1,抑制溶解,且抑制程度大于①和②,AgCl(s)的溶解度更小。
巩固练习
2.将足量的BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和。下列溶液中Ba2+的浓度最小的是 ( )
A.10 mL 0.2 mol·L-1 Na2CO3溶液
B.40 mL 水
C.50 mL 0.01 mol·L-1 BaCl2溶液
D.100 mL 0.01 mol·L-1盐酸
A
巩固练习
教 学 目 标
核 心 素 养
1.知道难溶电解质的沉淀溶解平衡及其影响因素。
2.掌握溶度积常数,能多角度、动态地分析难溶电解质的溶解平衡。
证据推理与模型认知:知道溶度积的意义,建立根据溶度积判断反应进行方向的思维模型。
珊瑚
溶洞
龋齿
化学· 生活
温故知新
1.难溶电解质在水中溶解了吗?
Mg(OH)2固体
蒸馏水
振荡
化学式 溶解度/g
(20℃) 物质
颜色
Mg(OH)2 9×10-4 白色
交流讨论
固体的溶解度是指在一定温度下,某固态物质在100 g溶剂里(通常指水)达到饱和状态时所溶解的质量。
溶解度/g 一般称为
<0.01 难溶
0.01~1 微溶
1~10 可溶
>10 易溶
溶解度的相对大小(20℃)
S
知识链接
实验
操作
现象
结论
PbI2饱和溶液
上层清液中出现黄色沉淀
原上层清液中含有I-
PbI2固体在水中存在溶解平衡
滴加
AgNO3溶液
实验探究
PbI2
难溶电解质的溶解是绝对的,不溶是相对的
解释:尽管PbI2固体难溶于水,但仍有部分Pb2+和I-离开固体表面进入溶液,同时进入溶液的Pb2+和I-又会在固体表面沉淀下来,当这两个过程速率相等时,Pb2+和I-的沉淀与PbI2固体的溶解达到平衡状态。
实验结论
2.难溶电解质在水中的溶解为何会有限度?
交流讨论
1.沉淀溶解平衡的建立
v(溶解)=v(沉淀)
v
v(溶解)
v(沉淀)
t
AgCl(s) Ag+ (aq) + Cl-(aq)
沉淀
溶解
一、沉淀溶解平衡
在一定温度下,当难溶电解质溶于水形成饱和溶液时,溶解的速率和生成沉淀的速率相等,达到平衡状态,我们把这种平衡称为沉淀溶解平衡。
2.沉淀溶解平衡的表达式
一、沉淀溶解平衡
MmAn(s) mMn+(aq) + nAm- (aq)
3.沉淀溶解平衡的特征
v(溶解)=v(沉淀)
v
v(溶解)
v(沉淀)
t
逆——溶解和沉淀互为可逆过程
变—— 当条件改变时,溶解平衡可能发生移动
等—— v溶解 = v沉淀 ≠ 0
动—— 动态平衡,溶解和沉淀仍在进行
定—— 平衡状态下,难溶电解质的质量及相应离子的浓度不再变化,均为定值
一、沉淀溶解平衡
3.如何定量描述难溶电解质的溶解限度?
定性
定量
沉淀溶解平衡
平衡常数
PbI2(s) Pb2+(aq) +2 I- (aq)
交流讨论
1.定义
符号:Ksp
难溶电解质的沉淀溶解平衡的平衡常数,称为溶度积常数,简称溶度积
2.表达式
AgCl (s) Ag+(aq) + Cl- (aq)
Fe(OH)3(s) Fe3+(aq)+3OH- (aq)
MmAn(s) mMn+(aq) + nAm- (aq)
3.影响因素
Ksp的大小只与难溶电解质本身的性质和温度有关。
二、溶度积
4.分析Ksp值,可以得出哪些结论?
类型 化学式 溶度积Ksp 溶解度/g
AB AgBr 5.0×10-13 8.4×10-6
AB AgCl 1.8×10-10 1.5×10-4
A2B Ag2CrO4 1.1×10-12 2.2×10-3
A2B Ag2S 6.3×10-50 1.3×10-16
结论:相同类型的难溶电解质的Ksp越小,溶解度越小
交流讨论
一定的温度下,相同类型的难溶电解质的Ksp越小,溶解度越小。
(1)Ksp反映了难溶电解质在水中的溶解能力。
4.意义
二、溶度积
4.意义
二、溶度积
未达平衡状态
已达平衡状态
未达平衡状态
(2)借助Ksp可以判断难溶电解质在水中是否达到沉淀溶解平衡状态以及可逆过程进行的方向。
Q> Ksp,生成沉淀
Q= Ksp 沉淀溶解平衡
Q< Ksp,沉淀溶解
1.已知碳酸钙难溶于水。
(1)CaCO3在水中的溶解平衡可表示为__________________________________。
(2)碳酸钙的溶度积常数表达式为_____________________________。
(3)在常温下,将少量碳酸钙加入一定量的水中,充分搅拌后仍有固体存在。此时溶解过程是否停止?请说明理由。
未停止,溶解速率和沉淀速率相等,达到平衡。
学以致用
(5)请设计实验方案,使碳酸钙的沉淀溶解平衡向碳酸钙溶解的方向移动。
水中Ca2+浓度大
加水、加热、加酸等
学以致用
(4)将碳酸钙分别加入水和饱和碳酸钠溶液中,达到沉淀溶解平衡,请比较两个体系中Ca2+浓度的大小。
2.将10 mL 0.02 mol·L-1的CaCl2溶液与等体积、等浓度的Na2C2O4溶液相混合,已知CaC2O4的Ksp=2.32×10-9。判断是否有CaC2O4沉淀生成。
根据溶度积规则:
有沉淀生成
学以致用
PbI2饱和溶液
滴加KI溶液
你能从沉淀溶解平衡角度解释这个实验所观察到的现象吗?
c(I-)增大
Q 增大
Q = c(Pb2+)·c2(I-)
Q > Ksp
平衡逆向移动
PbI2(s)
Pb2+(aq) + 2I-(aq)
交流讨论
外界条件 Ksp Q 移动
方向 达到新平衡后
c(Mg2+) 达到新平衡后c(OH-)
升高温度
加入MgCl2固体
通入HCl
预测下列条件改变对氢氧化镁悬浊液沉淀溶解平衡的影响。
Mg(OH)2(s) Mg2+(aq)+2OH-(aq) ΔH >0
正向
不变
增大
增大
增大
逆向
增大
减小
不变
正向
不变
增大
增大
减小
减小
交流讨论
实验探究
2.外界条件对溶解平衡的影响
(1)温度升高,大多数溶解平衡向溶解的方向移动。
但如Ca(OH)2,温度越高,溶解度越小。
(2)加水稀释,浓度减小,溶解平衡向溶解的方向移动。
(4)加入与难溶电解质溶解所得的离子反应的物质,溶解平衡向溶解的方向移动。
(3)加入与难溶电解质构成粒子相同的物质,溶解平衡向生成沉淀的方向移动,称同离子效应。
三、影响沉淀溶解平衡的因素
1.内因
难溶电解质本身的性质
沉淀溶解平衡
特征
溶度积(Ksp)
逆、等、动、定、变
难溶电解质
定性
定量
只受温度影响
反映溶解程度
与Q比较做判断
课堂小结
1.将AgCl分别投入下列溶液中:
①40 mL 0.03 mol·L-1的HCl溶液 ②50 mL 0.03 mol·L-1的AgNO3溶液
③30 mL 0.02 mol·L-1的CaCl2溶液 ④10 mL蒸馏水。
AgCl的溶解度由大到小的顺序是_______________。
④>①=②>③
解析 AgCl(s)在溶液中存在如下沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq)
①中c(Cl-)=0.03 mol·L-1,抑制了AgCl(s)的溶解,使得AgCl(s)的溶解度减小,
②中c(Ag+)=0.03 mol·L-1,也抑制了AgCl(s)的溶解,且抑制程度与①相同,
③中的c(Cl-)=0.04 mol·L-1,抑制溶解,且抑制程度大于①和②,AgCl(s)的溶解度更小。
巩固练习
2.将足量的BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和。下列溶液中Ba2+的浓度最小的是 ( )
A.10 mL 0.2 mol·L-1 Na2CO3溶液
B.40 mL 水
C.50 mL 0.01 mol·L-1 BaCl2溶液
D.100 mL 0.01 mol·L-1盐酸
A
巩固练习
