苏教版高中化学选择性必修1专题1第二单元化学能与电能的转化1.2.3燃料电池课件(共12张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修1专题1第二单元化学能与电能的转化1.2.3燃料电池课件(共12张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 893.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-21 18:03:54 | ||
图片预览




文档简介
(共12张PPT)
专题1 化学反应与能量变化
第二单元 化学能与电能的转化
第3课时 燃料电池
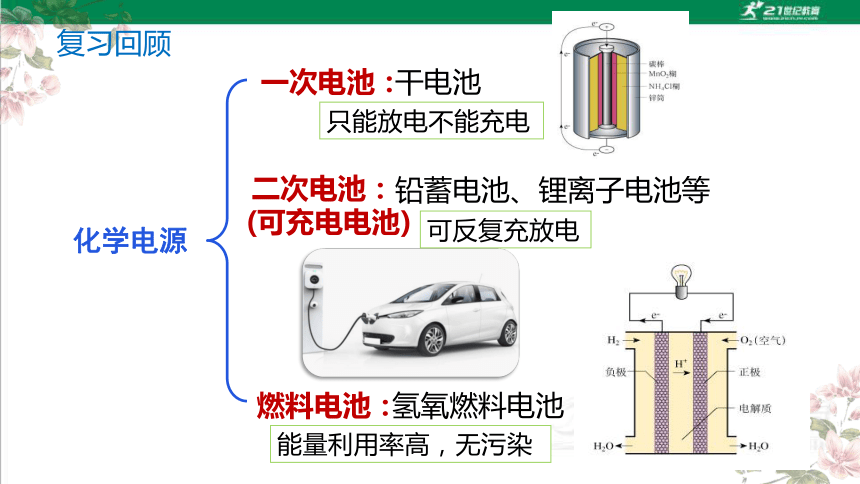
一次电池:
铅蓄电池、锂离子电池等
氢氧燃料电池
干电池
二次电池:
燃料电池:
(可充电电池)
化学电源
只能放电不能充电
可反复充放电
能量利用率高,无污染
复习回顾
燃料电池
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。
氢气、烃类、肼(N2H4)
、甲醇、氨、煤气等液态或气态的燃料。
1. 燃料电池的规律:
①燃料做负极,助燃剂氧气为正极
②电极材料一般不参加化学反应,只起传导电子的作用。
2. 元素的转化
C
H
O
CO2 、CO32-(碱性)
H+ 、H2O
OH-、H2O、CO32-(熔融碳酸盐) 、O2-(熔融氧化物)
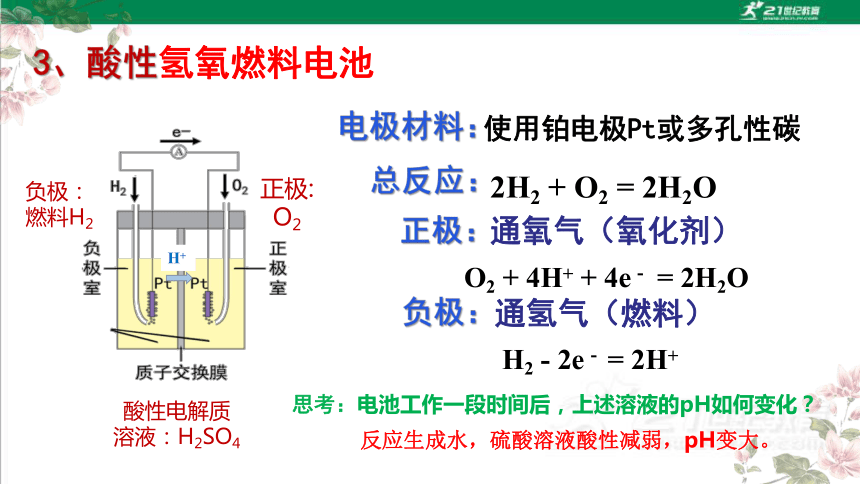
电极材料:
使用铂电极Pt或多孔性碳
负极:
通氢气(燃料)
H2 - 2e- = 2H+
O2 + 4H+ + 4e- = 2H2O
总反应:
2H2 + O2 = 2H2O
3、酸性氢氧燃料电池
正极:
通氧气(氧化剂)
正极:
O2
负极:
燃料H2
酸性电解质
溶液:H2SO4
H+
思考:电池工作一段时间后,上述溶液的pH如何变化?
反应生成水,硫酸溶液酸性减弱,pH变大。
电解质溶液:KOH溶液
正极:2O2+4H2O+8e- === 8OH-
负极:CH4-8e- +10OH-=== CO32- +7H2O
总反应:CH4+2O2 +2OH-=== CO32-+3H2O
4、碱性甲烷燃料电池
氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、甲醇、汽油等。
电解质溶液:KOH溶液
正极:O2+2H2O+4e- === 4OH-
负极:N2H4+4OH--4e- === N2↑+4H2O
总反应:N2H4+O2 === N2+2H2O
5.碱性肼燃料电池
该电池中导电离子是氧化物中的O2-。
以熔融金属氧化物为介质,高温下能传导O2-
6.丁烷-固体氧化物燃料电池
该电池中导电离子是碳酸盐中的CO32-
总反应:CH4+2O2===CO2+2H2O
7.CH4-熔融碳酸盐燃料电池
(1)写出燃烧反应的化学方程式(即总反应式);
(2)根据电解液改写燃料电池总反应;
(3)写出正极的电极反应式(一般较简单);
(4)负极的电极反应式 = 燃料电池总反应式 - 正极的电极反应式。
燃料电池的电极反应式的书写步骤
减少污染、节约资源
电池中含有大量的重金属如锌、铅、镉、汞、锰等。据专家测试,一节纽扣电池能污染60万升水;一节一号电池烂在地里,能使一平方米的土地失去利用价值。若将废旧电池混入生活垃圾一起填埋,渗出的重金属物质就会渗透土壤、污染地下水,进而进入鱼类、农作物等,破坏人类的生存环境,间接威胁到人类的健康,有的还能致癌。所以我们不要乱扔电池,要及时回收。
课堂检测
1.(福建·泉州现代中学高二月考)如图所示的氢氧燃料电池,下列有关该电池的说法错误的( )
A.b电极是正极
B.电子由b电极经过灯泡流向a电极
C.电池总反应式为2H2+O2=2H2O
D.氢氧燃料电池能量转化率可以
达到80%以上
B
专题1 化学反应与能量变化
第二单元 化学能与电能的转化
第3课时 燃料电池
一次电池:
铅蓄电池、锂离子电池等
氢氧燃料电池
干电池
二次电池:
燃料电池:
(可充电电池)
化学电源
只能放电不能充电
可反复充放电
能量利用率高,无污染
复习回顾
燃料电池
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。
氢气、烃类、肼(N2H4)
、甲醇、氨、煤气等液态或气态的燃料。
1. 燃料电池的规律:
①燃料做负极,助燃剂氧气为正极
②电极材料一般不参加化学反应,只起传导电子的作用。
2. 元素的转化
C
H
O
CO2 、CO32-(碱性)
H+ 、H2O
OH-、H2O、CO32-(熔融碳酸盐) 、O2-(熔融氧化物)
电极材料:
使用铂电极Pt或多孔性碳
负极:
通氢气(燃料)
H2 - 2e- = 2H+
O2 + 4H+ + 4e- = 2H2O
总反应:
2H2 + O2 = 2H2O
3、酸性氢氧燃料电池
正极:
通氧气(氧化剂)
正极:
O2
负极:
燃料H2
酸性电解质
溶液:H2SO4
H+
思考:电池工作一段时间后,上述溶液的pH如何变化?
反应生成水,硫酸溶液酸性减弱,pH变大。
电解质溶液:KOH溶液
正极:2O2+4H2O+8e- === 8OH-
负极:CH4-8e- +10OH-=== CO32- +7H2O
总反应:CH4+2O2 +2OH-=== CO32-+3H2O
4、碱性甲烷燃料电池
氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、甲醇、汽油等。
电解质溶液:KOH溶液
正极:O2+2H2O+4e- === 4OH-
负极:N2H4+4OH--4e- === N2↑+4H2O
总反应:N2H4+O2 === N2+2H2O
5.碱性肼燃料电池
该电池中导电离子是氧化物中的O2-。
以熔融金属氧化物为介质,高温下能传导O2-
6.丁烷-固体氧化物燃料电池
该电池中导电离子是碳酸盐中的CO32-
总反应:CH4+2O2===CO2+2H2O
7.CH4-熔融碳酸盐燃料电池
(1)写出燃烧反应的化学方程式(即总反应式);
(2)根据电解液改写燃料电池总反应;
(3)写出正极的电极反应式(一般较简单);
(4)负极的电极反应式 = 燃料电池总反应式 - 正极的电极反应式。
燃料电池的电极反应式的书写步骤
减少污染、节约资源
电池中含有大量的重金属如锌、铅、镉、汞、锰等。据专家测试,一节纽扣电池能污染60万升水;一节一号电池烂在地里,能使一平方米的土地失去利用价值。若将废旧电池混入生活垃圾一起填埋,渗出的重金属物质就会渗透土壤、污染地下水,进而进入鱼类、农作物等,破坏人类的生存环境,间接威胁到人类的健康,有的还能致癌。所以我们不要乱扔电池,要及时回收。
课堂检测
1.(福建·泉州现代中学高二月考)如图所示的氢氧燃料电池,下列有关该电池的说法错误的( )
A.b电极是正极
B.电子由b电极经过灯泡流向a电极
C.电池总反应式为2H2+O2=2H2O
D.氢氧燃料电池能量转化率可以
达到80%以上
B
