苏教版高中化学选择性必修1专题1第二单元化学能与电能的转化1.2.4电解池的工作原理课件(共21张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修1专题1第二单元化学能与电能的转化1.2.4电解池的工作原理课件(共21张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-21 18:04:35 | ||
图片预览




文档简介
(共21张PPT)
专题1 化学反应与能量变化
第二单元化学能与电能的转化
04
电解池的工作原理
精微电化学加工技术
电解原理
在工业生产和日常生活中,人们常常需要通过电解的方法使许多不能自发进行的反应顺利进行,
电解过程中电能转化为化学能。
电解原理
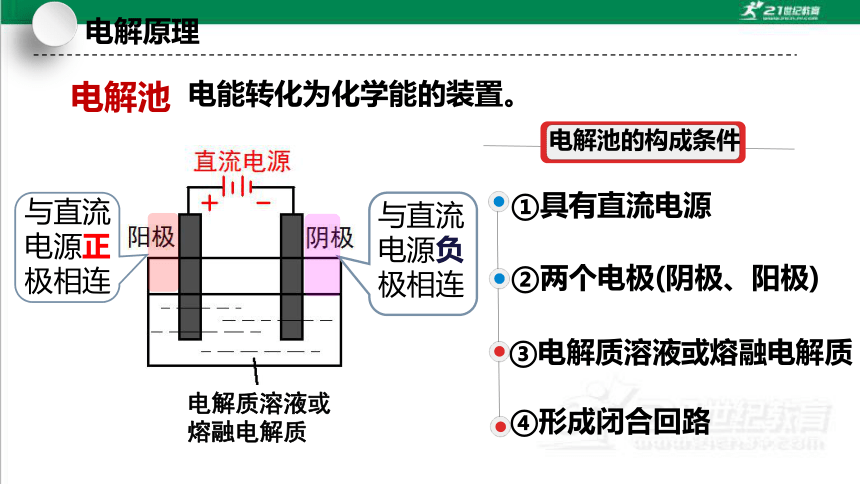
电能转化为化学能的装置。
电解池
与直流电源负极相连
与直流电源正极相连
电解质溶液或熔融电解质
①具有直流电源
②两个电极(阴极、阳极)
③电解质溶液或熔融电解质
④形成闭合回路
电解池的构成条件
电解原理
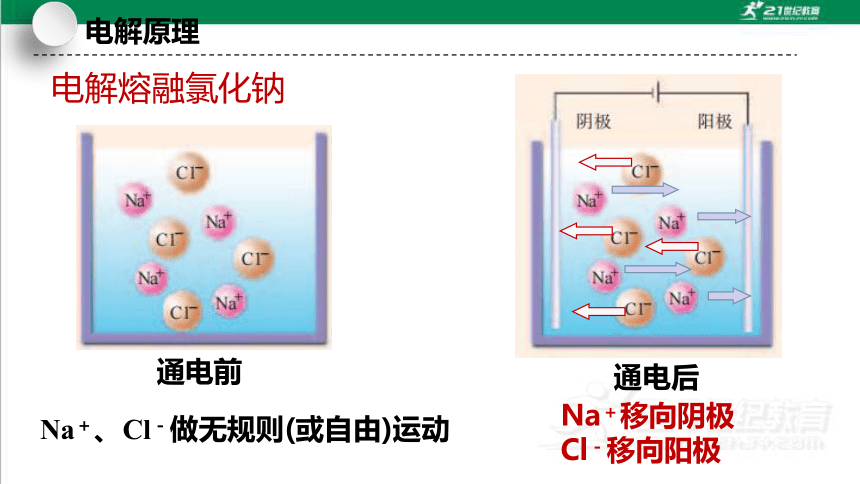
Na+、Cl-做无规则(或自由)运动
电解熔融氯化钠
通电前
通电后
Na+移向阴极
Cl-移向阳极
电解原理
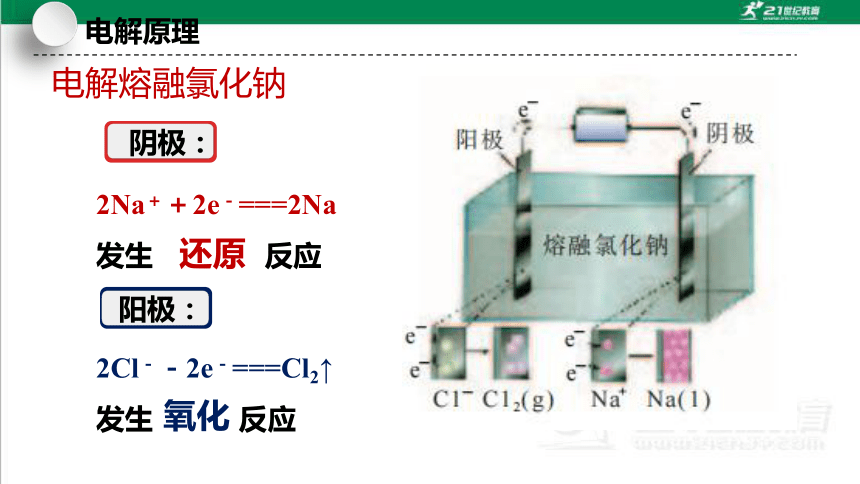
2Cl--2e-===Cl2↑
发生 反应
电解熔融氯化钠
2Na++2e-===2Na
发生 反应
阴极:
阳极:
还原
氧化
电解原理
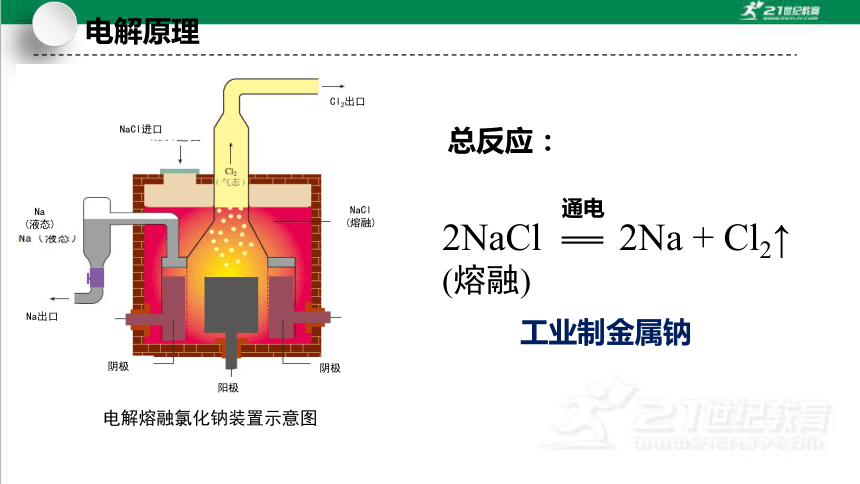
2NaCl(熔融)
通电
2Na + Cl2↑
工业制金属钠
总反应:
电解熔融氯化钠装置示意图
NaCl进口
NaCl
(熔融)
Cl2出口
Na
(液态)
Na出口
阴极
阴极
阳极
电解原理
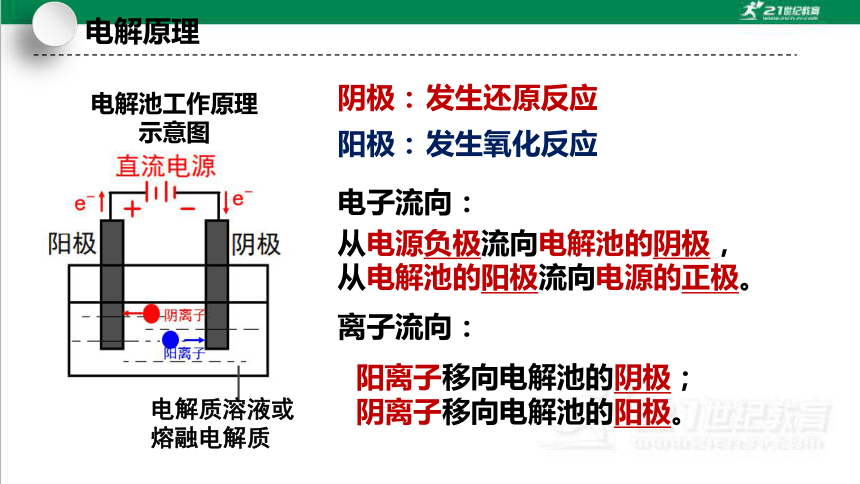
电解池工作原理
示意图
电解质溶液或熔融电解质
阳离子移向电解池的阴极;
阴离子移向电解池的阳极。
阴极:
阳极:
发生还原反应
发生氧化反应
电子流向:
从电源负极流向电解池的阴极,从电解池的阳极流向电源的正极。
离子流向:
电解原理
电解CuCl2溶液
电解原理
电解CuCl2溶液
微观
通电前:
CuCl2 == Cu2+ + 2Cl-
H2O H+ + OH-
电解原理
电解CuCl2溶液
通电前:
CuCl2 == Cu2+ + 2Cl-
H2O H+ + OH-
向阴极迁移
向阳极迁移
通电时:
电解原理
电解CuCl2溶液
通电前:
CuCl2 == Cu2+ + 2Cl-
H2O H+ + OH-
向阴极迁移
向阳极迁移
通电时:
氧化反应
放电顺序
Cl- > OH-
还原反应
Cu2+ >H+
放电顺序
2Cl--2e-==Cl2↑
Cu2++2e-==Cu
电解原理
电极反应规律
阴极
无论是惰性电极还是活泼电极都不参与电极反应,发生反应的是溶液中的阳离子。
阳离子放电顺序:
Ag+>Cu2+>H+>Pb2+>Fe2+>Zn2+……
氧化性:
阴极发生还原反应
Ag+>Cu2+>H+>Pb2+>Fe2+>Zn2+……
电解原理
电极反应规律
阳极
溶液中还原性强的阴离子失去电子被氧化,或者电极材料本身失去电子被氧化而溶入溶液中。
其放电顺序:
活泼金属阳极>S2->I->Cl->OH->含氧酸根。
还原性:
阳极发生氧化反应
活泼金属阳极>S2->I->Cl->OH->含氧酸根。
电解原理
用惰性电极电解酸、碱、盐溶液
电解质 H2SO4 NaOH Na2SO4
溶液中离子
离子放电顺序
阳极反应式
阴极反应式
pH变化
复原加入物质
H+ 、OH-、SO42-
H+ 、OH-、Na+
Na+ 、SO42- 、H+ 、OH-
OH->SO42-
H+>Na+
OH->SO42-
H+>Na+
4OH--4e-===O2↑+2H2O
4H++4e-===2H2↑
减小
增大
不变
加入H2O
1、电解水型
电解原理
用惰性电极电解酸、碱、盐溶液
电解质 HCl CuCl2
溶液中离子
离子放电顺序
阳极反应式
阴极反应式
pH变化 ——
复原加入物质
H+ 、Cl- 、OH-
Cu2+ 、Cl- 、H+ 、OH-
Cl- > OH-
Cu2+>H+
2Cl--2e-===Cl2↑
2H++2e-===H2↑
增大
加入HCl
2、电解电解质型
Cl- > OH-
Cu2++2e-===Cu
加入CuCl2
电解原理
用惰性电极电解酸、碱、盐溶液
电解质 NaCl CuSO4
溶液中离子
离子放电顺序
阳极反应式
阴极反应式
pH变化
复原加入物质
Na+ 、Cl- 、H+ 、OH-
Cu2+ 、SO42- 、H+ 、OH-
Cl- > OH-
Cu2+>H+
2Cl--2e-===Cl2↑
2H++2e-===H2↑
增大
加入HCl
3、电解质和水都发生电解型
Cu2++2e-===Cu
加入CuO或CuCO3
H+>Na+
OH->SO42-
4OH--4e-===O2↑+2H2O
减小
强化巩固
从H+、Cu2+、Na+、SO42- 、Cl-5种离子中两两恰当的组成电解质,按下列要求进行电解:
(1)以碳棒为电极,电解过程中电解质质量减少,水量不变,则采用的电解质是____________。若要恢复到电解前的状态,应加入的物质是____________。
(2)以碳棒为电极,电解过程中电解质质量不变,水量减少,则采用的电解质是_________________。若要恢复到电解前的状态,应加入的物质是__________。
(3)以碳棒为阳极,铁棒为阴极,电解过程中电解质和水量都减少,则电解质是___________________。若要恢复到电解前的状态,应加入的物质是_________________。
CuO(或CuCO3)、HCl
HCl、CuCl2
HCl、CuCl2
Na2SO4、H2SO4
H2O
CuSO4、NaCl
延时符
课堂小结
课堂练习
D
1、以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉)。下列说法错误的是( )
A.阴极附近溶液呈红色
B.阴极逸出气体
C.阳极附近溶液呈蓝色
D.溶液的pH变小
课堂练习
B
2、用惰性电极电解稀H2SO4、Cu(NO3)2、NaCl的混合液,最初一段时间阴极和阳极上析出的物质分别是( )
A.H2和Cl2
B.Cu和Cl2
C.H2和O2
D.Cu和O2
专题1 化学反应与能量变化
第二单元化学能与电能的转化
04
电解池的工作原理
精微电化学加工技术
电解原理
在工业生产和日常生活中,人们常常需要通过电解的方法使许多不能自发进行的反应顺利进行,
电解过程中电能转化为化学能。
电解原理
电能转化为化学能的装置。
电解池
与直流电源负极相连
与直流电源正极相连
电解质溶液或熔融电解质
①具有直流电源
②两个电极(阴极、阳极)
③电解质溶液或熔融电解质
④形成闭合回路
电解池的构成条件
电解原理
Na+、Cl-做无规则(或自由)运动
电解熔融氯化钠
通电前
通电后
Na+移向阴极
Cl-移向阳极
电解原理
2Cl--2e-===Cl2↑
发生 反应
电解熔融氯化钠
2Na++2e-===2Na
发生 反应
阴极:
阳极:
还原
氧化
电解原理
2NaCl(熔融)
通电
2Na + Cl2↑
工业制金属钠
总反应:
电解熔融氯化钠装置示意图
NaCl进口
NaCl
(熔融)
Cl2出口
Na
(液态)
Na出口
阴极
阴极
阳极
电解原理
电解池工作原理
示意图
电解质溶液或熔融电解质
阳离子移向电解池的阴极;
阴离子移向电解池的阳极。
阴极:
阳极:
发生还原反应
发生氧化反应
电子流向:
从电源负极流向电解池的阴极,从电解池的阳极流向电源的正极。
离子流向:
电解原理
电解CuCl2溶液
电解原理
电解CuCl2溶液
微观
通电前:
CuCl2 == Cu2+ + 2Cl-
H2O H+ + OH-
电解原理
电解CuCl2溶液
通电前:
CuCl2 == Cu2+ + 2Cl-
H2O H+ + OH-
向阴极迁移
向阳极迁移
通电时:
电解原理
电解CuCl2溶液
通电前:
CuCl2 == Cu2+ + 2Cl-
H2O H+ + OH-
向阴极迁移
向阳极迁移
通电时:
氧化反应
放电顺序
Cl- > OH-
还原反应
Cu2+ >H+
放电顺序
2Cl--2e-==Cl2↑
Cu2++2e-==Cu
电解原理
电极反应规律
阴极
无论是惰性电极还是活泼电极都不参与电极反应,发生反应的是溶液中的阳离子。
阳离子放电顺序:
Ag+>Cu2+>H+>Pb2+>Fe2+>Zn2+……
氧化性:
阴极发生还原反应
Ag+>Cu2+>H+>Pb2+>Fe2+>Zn2+……
电解原理
电极反应规律
阳极
溶液中还原性强的阴离子失去电子被氧化,或者电极材料本身失去电子被氧化而溶入溶液中。
其放电顺序:
活泼金属阳极>S2->I->Cl->OH->含氧酸根。
还原性:
阳极发生氧化反应
活泼金属阳极>S2->I->Cl->OH->含氧酸根。
电解原理
用惰性电极电解酸、碱、盐溶液
电解质 H2SO4 NaOH Na2SO4
溶液中离子
离子放电顺序
阳极反应式
阴极反应式
pH变化
复原加入物质
H+ 、OH-、SO42-
H+ 、OH-、Na+
Na+ 、SO42- 、H+ 、OH-
OH->SO42-
H+>Na+
OH->SO42-
H+>Na+
4OH--4e-===O2↑+2H2O
4H++4e-===2H2↑
减小
增大
不变
加入H2O
1、电解水型
电解原理
用惰性电极电解酸、碱、盐溶液
电解质 HCl CuCl2
溶液中离子
离子放电顺序
阳极反应式
阴极反应式
pH变化 ——
复原加入物质
H+ 、Cl- 、OH-
Cu2+ 、Cl- 、H+ 、OH-
Cl- > OH-
Cu2+>H+
2Cl--2e-===Cl2↑
2H++2e-===H2↑
增大
加入HCl
2、电解电解质型
Cl- > OH-
Cu2++2e-===Cu
加入CuCl2
电解原理
用惰性电极电解酸、碱、盐溶液
电解质 NaCl CuSO4
溶液中离子
离子放电顺序
阳极反应式
阴极反应式
pH变化
复原加入物质
Na+ 、Cl- 、H+ 、OH-
Cu2+ 、SO42- 、H+ 、OH-
Cl- > OH-
Cu2+>H+
2Cl--2e-===Cl2↑
2H++2e-===H2↑
增大
加入HCl
3、电解质和水都发生电解型
Cu2++2e-===Cu
加入CuO或CuCO3
H+>Na+
OH->SO42-
4OH--4e-===O2↑+2H2O
减小
强化巩固
从H+、Cu2+、Na+、SO42- 、Cl-5种离子中两两恰当的组成电解质,按下列要求进行电解:
(1)以碳棒为电极,电解过程中电解质质量减少,水量不变,则采用的电解质是____________。若要恢复到电解前的状态,应加入的物质是____________。
(2)以碳棒为电极,电解过程中电解质质量不变,水量减少,则采用的电解质是_________________。若要恢复到电解前的状态,应加入的物质是__________。
(3)以碳棒为阳极,铁棒为阴极,电解过程中电解质和水量都减少,则电解质是___________________。若要恢复到电解前的状态,应加入的物质是_________________。
CuO(或CuCO3)、HCl
HCl、CuCl2
HCl、CuCl2
Na2SO4、H2SO4
H2O
CuSO4、NaCl
延时符
课堂小结
课堂练习
D
1、以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉)。下列说法错误的是( )
A.阴极附近溶液呈红色
B.阴极逸出气体
C.阳极附近溶液呈蓝色
D.溶液的pH变小
课堂练习
B
2、用惰性电极电解稀H2SO4、Cu(NO3)2、NaCl的混合液,最初一段时间阴极和阳极上析出的物质分别是( )
A.H2和Cl2
B.Cu和Cl2
C.H2和O2
D.Cu和O2
