苏教版高中化学选择性必修1专题1第一单元化学反应的热效应1.1.1化学反应的焓变课件(共26张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修1专题1第一单元化学反应的热效应1.1.1化学反应的焓变课件(共26张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-21 18:05:41 | ||
图片预览




文档简介
(共26张PPT)
第一单元 化学反应的热效应
第1课时 化学反应的焓变
专题一 化学反应与能量变化
学习目标
1.能从宏观和微观角度理解化学反应中能量变化的本质,正确判断和认识放热反应和吸热反应。
2.辨识化学反应中的能量转化形式,形成能量可以相互转化的观念,正确理解反应热和焓变。
3.建立从定性到定量描述化学反应中的能量变化的思维模型、正确书写热化学方程式。
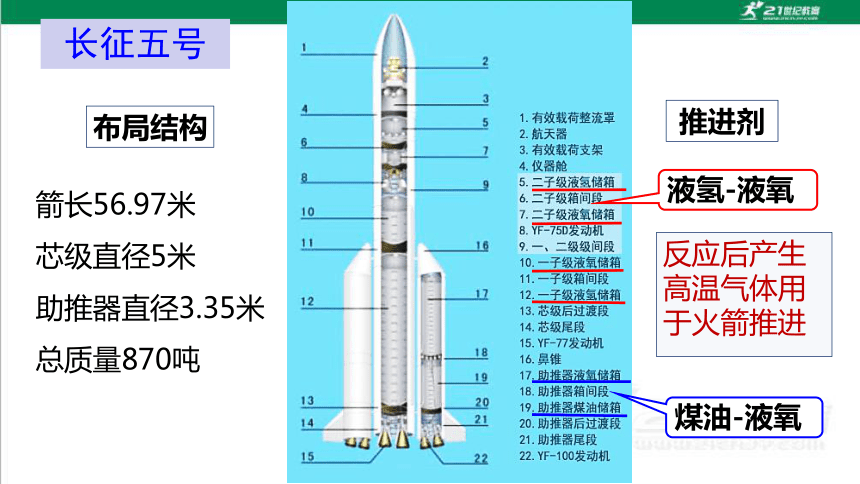
液氢-液氧
煤油-液氧
长征五号
布局结构
箭长56.97米
芯级直径5米
助推器直径3.35米
总质量870吨
推进剂
反应后产生高温气体用于火箭推进
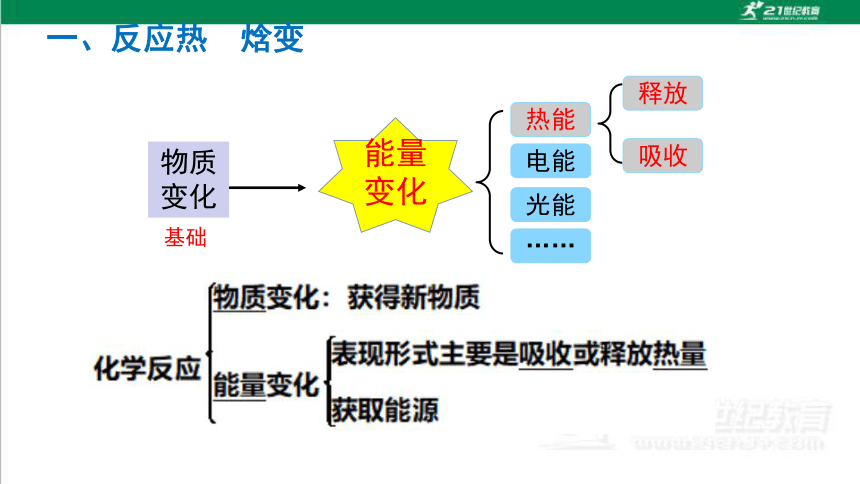
能量变化
物质
变化
基础
热能
电能
光能
……
吸收
释放
一、反应热 焓变
化学反应
放热反应
吸热反应
一、反应热 焓变
一、反应热 焓变
(二)药理作用
即:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
体系
环境
热量
在化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量称为化学反应的反应热。
产生
反应热
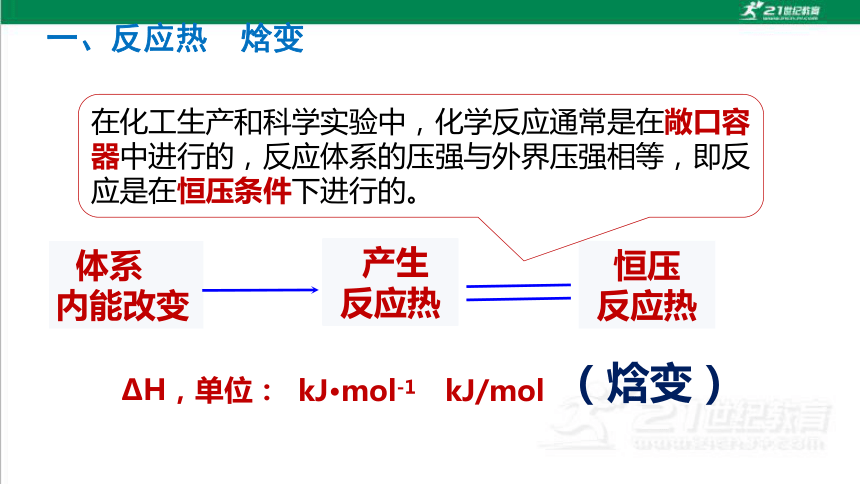
体系
内能改变
恒压
反应热
(焓变)
在化工生产和科学实验中,化学反应通常是在敞口容器中进行的,反应体系的压强与外界压强相等,即反应是在恒压条件下进行的。
一、反应热 焓变
ΔH,单位:
kJ·mol-1
kJ/mol
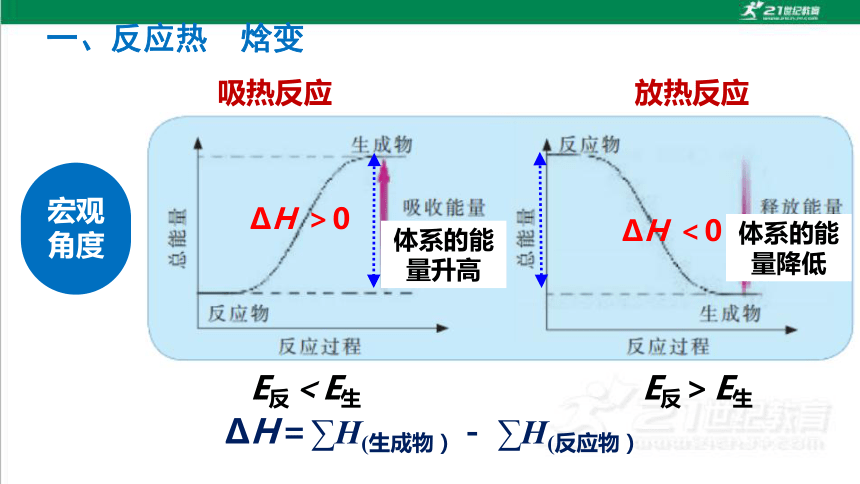
放热反应
吸热反应
H <0
H=∑H(生成物)- ∑H(反应物)
H >0
一、反应热 焓变
宏观角度
体系的能量升高
E反>E生
E反<E生
体系的能量降低
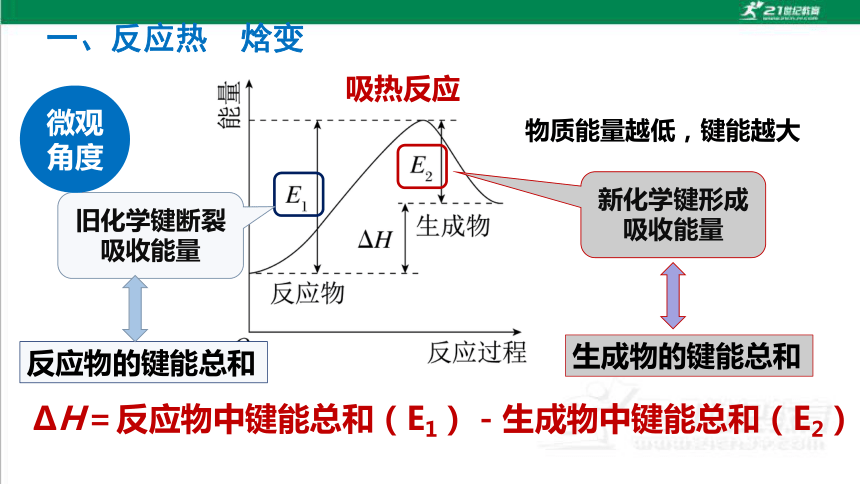
一、反应热 焓变
吸热反应
旧化学键断裂吸收能量
新化学键形成吸收能量
反应物的键能总和
生成物的键能总和
微观角度
物质能量越低,键能越大
ΔH=反应物中键能总和(E1)-生成物中键能总和(E2)
化学反应中能量变化的本质
一、反应热 焓变
化学键的断裂和形成是化学反应过程中伴随能量变化的根本原因。
一、反应热 焓变
1 mol N2分子中的化学键断裂吸收的能量是_ kJ,
1 mol O2分子中的化学键断裂吸收的能量是_ kJ,
2 mol NO分子中的化学键形成释放的能量是_ kJ,
则N2(g)+O2(g)===2NO(g)的反应吸收的热量为_ kJ。
946
498
1264
180
能力达成
例1:如图是H2与Cl2发生反应生成HCl的途径和三个状态的能量,有关说法错误的是( )
A.步骤2是放热过程B.三个状态的能量E2最大C.要实现步骤1的转化,必须加热D.该反应的ΔH<0
C
二、热化学方程式
热化学方程式
能够表示反应热的化学方程式
C(s)+O2(g)===CO2(g) ΔH=-393.6 kJ·mol-1
物质变化
能量变化
二、热化学方程式
热化学方程式的书写方法
写出相应的化学方程式。热化学方程式中各物质化学式前的化学计量数只表示其物质的量,可以是整数或分数,但必须是最简整数或最简分数。
同一化学反应,物质的化学计量数不同,反应的ΔH也不同。
(以氢气燃烧为例)
2H2 + O2 === 2H2O
H2 + O2 === H2O
1
2
热化学方程式的书写方法
不用标明反应条件,不用标“↑”或“↓”,标注各物质聚集状态。
在物质后面用括号标注各物质的聚集状态:气体用“g”,液体用“l”,固体用“s”,溶液用“aq”。
2H2 (g)+ O2 (g) === 2H2O(g)
H2 (g)+ O2 (g) === H2O(g)
1
2
H2 (g)+ O2 (g) === H2O(l)
1
2
二、热化学方程式
热化学方程式的书写方法
标注ΔH的正负。
化学方程式后面空一格标注ΔH,若为放热反应,ΔH为“-”;若为吸热反应,ΔH为“+”(“+”可省略不写)。
2H2 (g)+ O2 (g) === 2H2O(g) H=
H2 (g)+ O2 (g) === H2O(g) H=
1
2
H2 (g)+ O2 (g) === H2O(l) H=
1
2
二、热化学方程式
二、热化学方程式
计算ΔH的数值。根据化学方程式中的化学计量数计算写出ΔH的数值。ΔH单位是kJ·mol-1。
2H2 (g)+ O2 (g) === 2H2O(g)
H2 (g)+ O2 (g) === H2O(g)
1
2
H2 (g)+ O2 (g) === H2O(l)
1
2
H
H2O(l)
ΔH2=-285.8 kJ/mol
H2O(g)
ΔH1=-241.8 kJ/mol
H2(g)+ O2(g)
1
2
H= 241.8 kJ/mol
H= 285.8 kJ/mol
H= 483.6 kJ/mol
1、对一个热化学反应,ΔH的单位中“mol-1”不是指每摩尔具体物质,而是指“每摩尔反应”。因此ΔH必须与热化学方程式一一对应。
二、热化学方程式
2、可逆反应的ΔH表示的是当反应物按化学计量数完全反应时产生的热效应,实际反应中,若按化学计量数放入反应物,产生的热量偏小,如2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1,若2 mol SO2与1 mol O2反应,放出的热量小于196.6 kJ。
注意事项
H2O O2 N2 CO2
2个O—H 1个OO 1个N N 2个C O
CH4 金刚石 石墨 P4(白磷)
4个C—H 2个C—C 1.5个C—C 6个P—P
1.计算依据:ΔH=反应物中键能总和-生成物中键能总和
2.明确物质中化学键个数
二、热化学方程式
键能与反应热的计算
能力达成
1、已知一些化学键的键能数据如表所示:
化学键 C—H C—F H—F F—F
键能/(kJ mol-1) 414 489 565 155
请根据键能数据估算CH4(g)和F2(g)反应生成CF4(g)和HF(g)的热化学方程式:_________________________________________________________。
CH4(g)+4F2(g)===CF4(g)+4HF(g) ΔH=-1 940 kJ mol-1
能力达成
2、依据事实,写出下列反应的热化学方程式。
(1)16 g CH4(g)与适量O2(g)发生反应,生成CO2(g)和H2O(l),放出890.3 kJ热量: ________________________________________________________。
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ mol-1
(2)1 L 1 mol L-1 KOH溶液中和1 L 1 mol L-1 HNO3溶液,放出57.3 kJ热量: _________________________________________________________
KOH(aq)+HNO3(aq)===KNO3(aq)+H2O(l) ΔH=-57.3 kJ mol-1
能力达成
(3)12 g C(s)与适量O2(g)发生反应生成CO2(g),放出283.0 kJ热量:
_______________________________________________________
(4)1 mol葡萄糖[C6H12O6(s)]在人体中完全氧化,生成CO2(g)和H2O(l)产生2 800 kJ热量: ___________________________________
C(s) +O2(g)===CO2(g) ΔH=-283.0 kJ mol-1
C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l) ΔH=-2 800 kJ mol-1
课堂小结
反应热 焓变
热化学方程式
不良反应
反应热
焓变
能量变化的原因
(宏观、微观)
表示意义
书写方法
注意事项
随堂练习
(1)11.2 L(标准状况)H2在足量Cl2中燃烧生成HCl气体,放出91.5 kJ热量,其热化学方程式:_______________________________________________。
(2)已知1 mol C(石墨,s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量,请写出该反应的热化学方程式:_______________________________。
H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ mol-1
C(石墨,s)+H2O(g)===CO(g)+H2(g) ΔH=131.3 kJ mol-1
随堂练习
(3)1.7 g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ的热量,其热化学方程式:___________________________________________________。
(4)25 ℃、101 kPa下,强酸、强碱的稀溶液发生中和反应生成1 mol H2O(l)时,放出57.3 kJ的热量,其热化学方程式:______________________________________。
H+(aq)+OH-(aq)===H2O(l)
ΔH=-57.3 kJ mol-1
随堂练习
(5)已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ mol-1,请写出1 mol NH3分解对应的热化学方程式::___________________________________
若1 mol N2(g)和3 mol H2(g)在一定条件下发生反应,放出的热
量 (填“大于”“小于”或“等于”)92 kJ,理由是 。
ΔH=46 kJ mol-1
小于
该反应是可逆反应,不能进行完全
第一单元 化学反应的热效应
第1课时 化学反应的焓变
专题一 化学反应与能量变化
学习目标
1.能从宏观和微观角度理解化学反应中能量变化的本质,正确判断和认识放热反应和吸热反应。
2.辨识化学反应中的能量转化形式,形成能量可以相互转化的观念,正确理解反应热和焓变。
3.建立从定性到定量描述化学反应中的能量变化的思维模型、正确书写热化学方程式。
液氢-液氧
煤油-液氧
长征五号
布局结构
箭长56.97米
芯级直径5米
助推器直径3.35米
总质量870吨
推进剂
反应后产生高温气体用于火箭推进
能量变化
物质
变化
基础
热能
电能
光能
……
吸收
释放
一、反应热 焓变
化学反应
放热反应
吸热反应
一、反应热 焓变
一、反应热 焓变
(二)药理作用
即:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
体系
环境
热量
在化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量称为化学反应的反应热。
产生
反应热
体系
内能改变
恒压
反应热
(焓变)
在化工生产和科学实验中,化学反应通常是在敞口容器中进行的,反应体系的压强与外界压强相等,即反应是在恒压条件下进行的。
一、反应热 焓变
ΔH,单位:
kJ·mol-1
kJ/mol
放热反应
吸热反应
H <0
H=∑H(生成物)- ∑H(反应物)
H >0
一、反应热 焓变
宏观角度
体系的能量升高
E反>E生
E反<E生
体系的能量降低
一、反应热 焓变
吸热反应
旧化学键断裂吸收能量
新化学键形成吸收能量
反应物的键能总和
生成物的键能总和
微观角度
物质能量越低,键能越大
ΔH=反应物中键能总和(E1)-生成物中键能总和(E2)
化学反应中能量变化的本质
一、反应热 焓变
化学键的断裂和形成是化学反应过程中伴随能量变化的根本原因。
一、反应热 焓变
1 mol N2分子中的化学键断裂吸收的能量是_ kJ,
1 mol O2分子中的化学键断裂吸收的能量是_ kJ,
2 mol NO分子中的化学键形成释放的能量是_ kJ,
则N2(g)+O2(g)===2NO(g)的反应吸收的热量为_ kJ。
946
498
1264
180
能力达成
例1:如图是H2与Cl2发生反应生成HCl的途径和三个状态的能量,有关说法错误的是( )
A.步骤2是放热过程B.三个状态的能量E2最大C.要实现步骤1的转化,必须加热D.该反应的ΔH<0
C
二、热化学方程式
热化学方程式
能够表示反应热的化学方程式
C(s)+O2(g)===CO2(g) ΔH=-393.6 kJ·mol-1
物质变化
能量变化
二、热化学方程式
热化学方程式的书写方法
写出相应的化学方程式。热化学方程式中各物质化学式前的化学计量数只表示其物质的量,可以是整数或分数,但必须是最简整数或最简分数。
同一化学反应,物质的化学计量数不同,反应的ΔH也不同。
(以氢气燃烧为例)
2H2 + O2 === 2H2O
H2 + O2 === H2O
1
2
热化学方程式的书写方法
不用标明反应条件,不用标“↑”或“↓”,标注各物质聚集状态。
在物质后面用括号标注各物质的聚集状态:气体用“g”,液体用“l”,固体用“s”,溶液用“aq”。
2H2 (g)+ O2 (g) === 2H2O(g)
H2 (g)+ O2 (g) === H2O(g)
1
2
H2 (g)+ O2 (g) === H2O(l)
1
2
二、热化学方程式
热化学方程式的书写方法
标注ΔH的正负。
化学方程式后面空一格标注ΔH,若为放热反应,ΔH为“-”;若为吸热反应,ΔH为“+”(“+”可省略不写)。
2H2 (g)+ O2 (g) === 2H2O(g) H=
H2 (g)+ O2 (g) === H2O(g) H=
1
2
H2 (g)+ O2 (g) === H2O(l) H=
1
2
二、热化学方程式
二、热化学方程式
计算ΔH的数值。根据化学方程式中的化学计量数计算写出ΔH的数值。ΔH单位是kJ·mol-1。
2H2 (g)+ O2 (g) === 2H2O(g)
H2 (g)+ O2 (g) === H2O(g)
1
2
H2 (g)+ O2 (g) === H2O(l)
1
2
H
H2O(l)
ΔH2=-285.8 kJ/mol
H2O(g)
ΔH1=-241.8 kJ/mol
H2(g)+ O2(g)
1
2
H= 241.8 kJ/mol
H= 285.8 kJ/mol
H= 483.6 kJ/mol
1、对一个热化学反应,ΔH的单位中“mol-1”不是指每摩尔具体物质,而是指“每摩尔反应”。因此ΔH必须与热化学方程式一一对应。
二、热化学方程式
2、可逆反应的ΔH表示的是当反应物按化学计量数完全反应时产生的热效应,实际反应中,若按化学计量数放入反应物,产生的热量偏小,如2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1,若2 mol SO2与1 mol O2反应,放出的热量小于196.6 kJ。
注意事项
H2O O2 N2 CO2
2个O—H 1个OO 1个N N 2个C O
CH4 金刚石 石墨 P4(白磷)
4个C—H 2个C—C 1.5个C—C 6个P—P
1.计算依据:ΔH=反应物中键能总和-生成物中键能总和
2.明确物质中化学键个数
二、热化学方程式
键能与反应热的计算
能力达成
1、已知一些化学键的键能数据如表所示:
化学键 C—H C—F H—F F—F
键能/(kJ mol-1) 414 489 565 155
请根据键能数据估算CH4(g)和F2(g)反应生成CF4(g)和HF(g)的热化学方程式:_________________________________________________________。
CH4(g)+4F2(g)===CF4(g)+4HF(g) ΔH=-1 940 kJ mol-1
能力达成
2、依据事实,写出下列反应的热化学方程式。
(1)16 g CH4(g)与适量O2(g)发生反应,生成CO2(g)和H2O(l),放出890.3 kJ热量: ________________________________________________________。
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ mol-1
(2)1 L 1 mol L-1 KOH溶液中和1 L 1 mol L-1 HNO3溶液,放出57.3 kJ热量: _________________________________________________________
KOH(aq)+HNO3(aq)===KNO3(aq)+H2O(l) ΔH=-57.3 kJ mol-1
能力达成
(3)12 g C(s)与适量O2(g)发生反应生成CO2(g),放出283.0 kJ热量:
_______________________________________________________
(4)1 mol葡萄糖[C6H12O6(s)]在人体中完全氧化,生成CO2(g)和H2O(l)产生2 800 kJ热量: ___________________________________
C(s) +O2(g)===CO2(g) ΔH=-283.0 kJ mol-1
C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l) ΔH=-2 800 kJ mol-1
课堂小结
反应热 焓变
热化学方程式
不良反应
反应热
焓变
能量变化的原因
(宏观、微观)
表示意义
书写方法
注意事项
随堂练习
(1)11.2 L(标准状况)H2在足量Cl2中燃烧生成HCl气体,放出91.5 kJ热量,其热化学方程式:_______________________________________________。
(2)已知1 mol C(石墨,s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量,请写出该反应的热化学方程式:_______________________________。
H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ mol-1
C(石墨,s)+H2O(g)===CO(g)+H2(g) ΔH=131.3 kJ mol-1
随堂练习
(3)1.7 g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ的热量,其热化学方程式:___________________________________________________。
(4)25 ℃、101 kPa下,强酸、强碱的稀溶液发生中和反应生成1 mol H2O(l)时,放出57.3 kJ的热量,其热化学方程式:______________________________________。
H+(aq)+OH-(aq)===H2O(l)
ΔH=-57.3 kJ mol-1
随堂练习
(5)已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ mol-1,请写出1 mol NH3分解对应的热化学方程式::___________________________________
若1 mol N2(g)和3 mol H2(g)在一定条件下发生反应,放出的热
量 (填“大于”“小于”或“等于”)92 kJ,理由是 。
ΔH=46 kJ mol-1
小于
该反应是可逆反应,不能进行完全
