苏教版高中化学选择性必修1专题1第三单元1.3金属的腐蚀与防护课件
文档属性
| 名称 | 苏教版高中化学选择性必修1专题1第三单元1.3金属的腐蚀与防护课件 |  | |
| 格式 | ppt | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-21 18:07:26 | ||
图片预览




文档简介
(共25张PPT)
专题1 化学反应与能量变化
第三单元 金属的腐蚀与防护
01
金属的电化学腐蚀
一、金属的腐蚀
在生产生活中,金属腐蚀所带来的损失非常严重 !
全世界每年因金属腐蚀造成的直接经济损失约占各国国内生产总值的2%~4%。
01
概念
02
实质
03
类型
金属的腐蚀
金属腐蚀是指金属或合金与周围环境中的物质发生化学反应而腐蚀损耗的现象。
金属原子失电子被氧化,表示为:M-ne-=Mn+
化学腐蚀:金属与其他物质直接接触发生氧化还原反应(如O2、Cl2、SO2等),无电流产生。
电化学腐蚀:不纯的金属或合金与电解质溶液接触,形成原电池,使较活泼金属失去电子被氧化而被腐蚀。
金属的电化学腐蚀
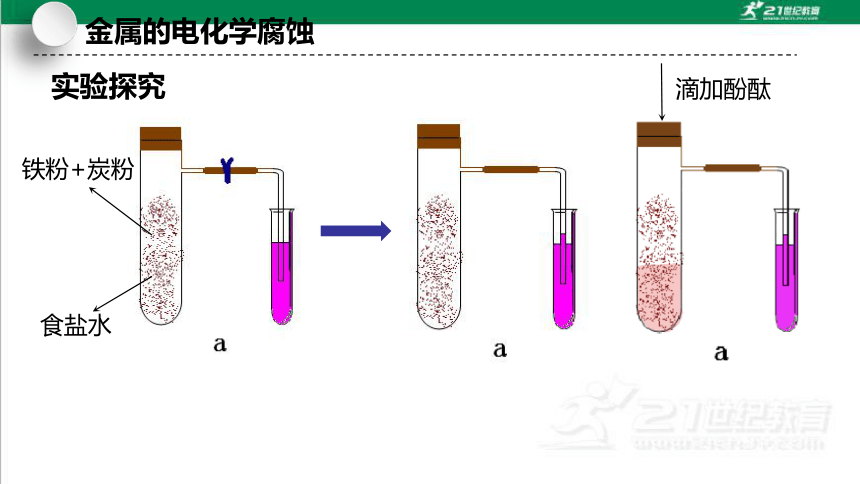
实验探究
铁粉+炭粉
食盐水
滴加酚酞
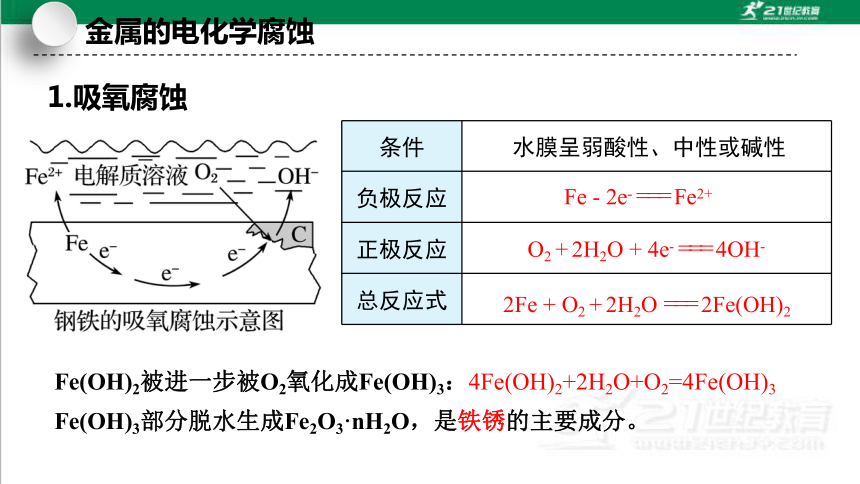
1.吸氧腐蚀
条件
负极反应
正极反应
总反应式
水膜呈弱酸性、中性或碱性
Fe - 2e- === Fe2+
O2 + 2H2O + 4e- === 4OH-
2Fe + O2 + 2H2O === 2Fe(OH)2
金属的电化学腐蚀
Fe(OH)3部分脱水生成Fe2O3·nH2O,是铁锈的主要成分。
Fe(OH)2被进一步被O2氧化成Fe(OH)3:4Fe(OH)2+2H2O+O2=4Fe(OH)3
金属的电化学腐蚀
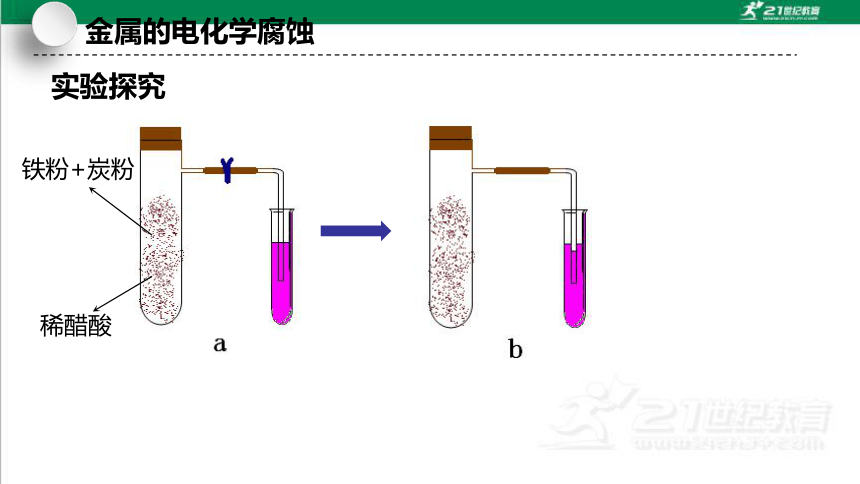
实验探究
铁粉+炭粉
稀醋酸
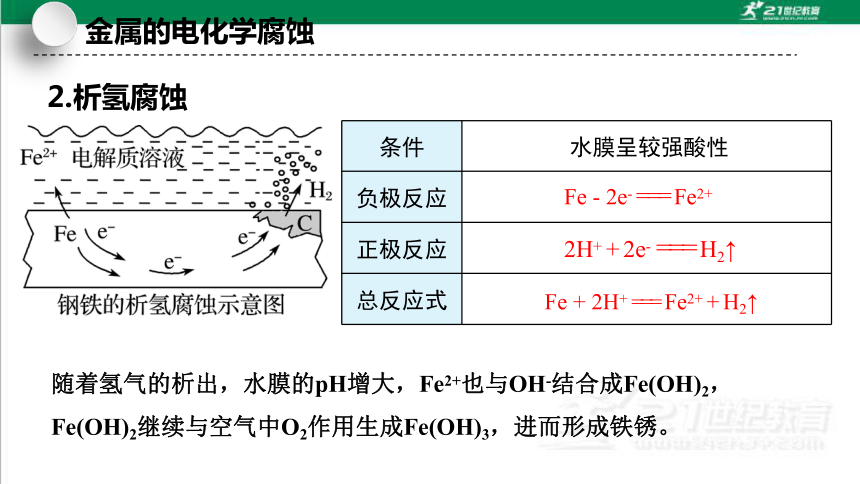
2.析氢腐蚀
条件
负极反应
正极反应
总反应式
水膜呈较强酸性
Fe - 2e- === Fe2+
Fe + 2H+ === Fe2+ + H2↑
金属的电化学腐蚀
随着氢气的析出,水膜的pH增大,Fe2+也与OH-结合成Fe(OH)2,
Fe(OH)2继续与空气中O2作用生成Fe(OH)3,进而形成铁锈。
2H+ + 2e- === H2↑
金属的电化学腐蚀
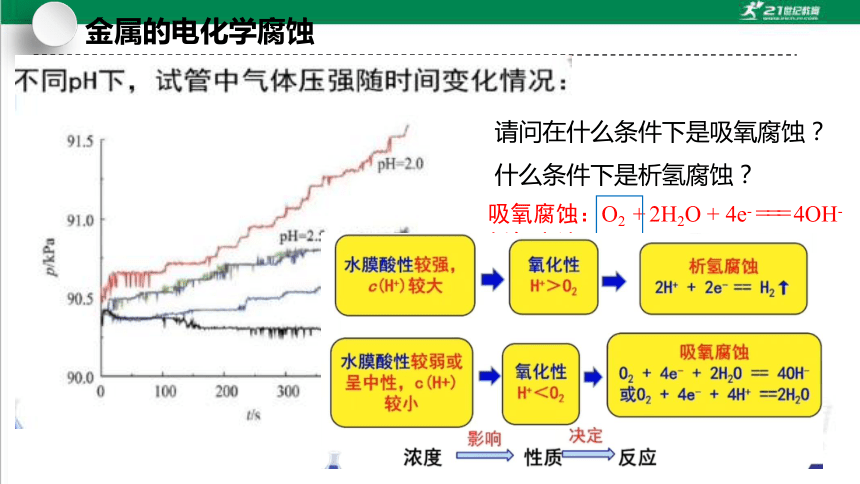
请问在什么条件下是吸氧腐蚀?
什么条件下是析氢腐蚀?
吸氧腐蚀:O2 + 2H2O + 4e- === 4OH-
析氢腐蚀:2H+ + 2e- === H2↑
铁生锈除了必须有空气及水的参与外还受其他一些因素的影响。请解释下列有关铁生锈现象的原因。
1.相对于内河行驶的轮船来说,海轮更容易被腐蚀
2.1910年遗留在南极的食品罐头盒,其表面至今很少有铁锈出现。
3.用于连接铜板的铁螺丝容易生锈。
交流与讨论
海水中电解质溶液的浓度大,腐蚀速率快
南极气温低,没有液态水,不能形成电解质溶液
铁与铜及空气、水形成原电池,铁作负极被氧化
请试着分析一下暖宝宝的发热原理?
02
第三单元 金属的腐蚀与防护
金属的电化学防护
金属的防护方法
在金属中添加其他金属或非金属制成性能优异的合金。如普通钢加入镍、铬制成不锈钢,钛合金不仅具有优异的抗腐蚀性能且具有良好的生物相容性。
1
改变金属材料的组成
金属的防护方法
在金属表面覆盖致密的保护层,从而使金属制品与周围物质(外界空气、水、电解质溶液等)隔离,这是一种被普遍采用的防护方法。
2
在金属表面覆盖保护层
①非金属保护层:如喷油漆、涂油脂、表面钝化。
②金属保护层:如铁制品上镀铜、锌等。
金属的防护方法
思考:在日常生活中,我们常常会接触到白铁皮(镀锌钢板)和马口铁(镀锡钢板),如果镀层破损后你认为谁更耐腐蚀?
白铁皮更耐腐蚀。金属活动性:锌>铁>锡,镀层破损后,锌、铁与附着的电解质溶液形成原电池,铁作为正极被保护,而铁、锡与附着的电解质溶液形成原电池,铁作为负极被腐蚀。
金属的防护方法
3
电化学防护法
利用原电池或电解池的原理,使被保护的金属始终处于电子流入端(正极/阴极),就不易被腐蚀。
金属的防护方法
3
电化学防护法
(1)牺牲阳极的阴极保护法
活泼性强的金属做负极,被保护金属做正极。
原理:
原电池原理
金属的防护方法
3
电化学防护法
(1)牺牲阳极的阴极保护法
此法常用于保护海轮外壳及石油管道等。
更活泼的金属(如镁、锌等)作阳极(负极),在不断被腐蚀后定期更换,而作为阴极(正极)的金属就不易被腐蚀而得到保护。
金属的防护方法
3
电化学防护法
(2)外加电流的阴极保护法
被保护的金属与外接电源负极相连做阴极。
原理:
电解池原理
金属的防护方法
3
电化学防护法
外加电流的阴极保护法
通电后,电子流向被保护的钢铁设备,在钢铁表面积累了大量的负电荷,从而抑制钢铁失去电子,阻止钢铁被腐蚀。
此主要用于防止土壤、海水及河水中金属设备的腐蚀。
金属的防护方法
如图所示的各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是什么?
④>②>①>③
01
电解引起的腐蚀 > 原电池引起的腐蚀 > 化学腐蚀
02
同一种金属在不同电解质溶液中,腐蚀快慢:
强电解质溶液 > 弱电解质溶液 > 非电解质溶液
03
活泼性不同的两金属,活泼性差别越大,腐蚀越快。
04
对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。
判断金属腐蚀快慢的规律
电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极
同一种金属在相同的电解质溶液中,腐蚀快慢:
如图所示,各烧杯中均盛有海水,铁在其中被腐蚀的速率由快到慢的顺序为( )
A.②①③④⑤⑥ B.⑤④③①②⑥
C.⑤④②①③⑥ D.⑤③②④①⑥
C
强化巩固
强化巩固
延时符
课堂小结
1.钢铁的防护有多种方法,下列对于图中的方法描述错误的是( )
A.a、b以导线连接,辅助电极发生氧化反应
B.a、b以导线连接或以电源连接,辅助电极的材料可能都含有Zn
C.a、b分别连接直流电源,通电后外电路电子被强制从辅助电极流向钢铁闸门
D.a、b分别连接直流电源的负极、正极,该方法是牺牲阳极法
D
课堂练习
2.炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图所示,下列说法正确的是 ( )
A.腐蚀过程中,负极是C
B.Fe失去电子经电解质溶液转移给C
C.正极的电极反应式为4OH--4e-==2H2O+O2↑
D.C是正极,O2在C表面上发生还原反应
D
课堂练习
专题1 化学反应与能量变化
第三单元 金属的腐蚀与防护
01
金属的电化学腐蚀
一、金属的腐蚀
在生产生活中,金属腐蚀所带来的损失非常严重 !
全世界每年因金属腐蚀造成的直接经济损失约占各国国内生产总值的2%~4%。
01
概念
02
实质
03
类型
金属的腐蚀
金属腐蚀是指金属或合金与周围环境中的物质发生化学反应而腐蚀损耗的现象。
金属原子失电子被氧化,表示为:M-ne-=Mn+
化学腐蚀:金属与其他物质直接接触发生氧化还原反应(如O2、Cl2、SO2等),无电流产生。
电化学腐蚀:不纯的金属或合金与电解质溶液接触,形成原电池,使较活泼金属失去电子被氧化而被腐蚀。
金属的电化学腐蚀
实验探究
铁粉+炭粉
食盐水
滴加酚酞
1.吸氧腐蚀
条件
负极反应
正极反应
总反应式
水膜呈弱酸性、中性或碱性
Fe - 2e- === Fe2+
O2 + 2H2O + 4e- === 4OH-
2Fe + O2 + 2H2O === 2Fe(OH)2
金属的电化学腐蚀
Fe(OH)3部分脱水生成Fe2O3·nH2O,是铁锈的主要成分。
Fe(OH)2被进一步被O2氧化成Fe(OH)3:4Fe(OH)2+2H2O+O2=4Fe(OH)3
金属的电化学腐蚀
实验探究
铁粉+炭粉
稀醋酸
2.析氢腐蚀
条件
负极反应
正极反应
总反应式
水膜呈较强酸性
Fe - 2e- === Fe2+
Fe + 2H+ === Fe2+ + H2↑
金属的电化学腐蚀
随着氢气的析出,水膜的pH增大,Fe2+也与OH-结合成Fe(OH)2,
Fe(OH)2继续与空气中O2作用生成Fe(OH)3,进而形成铁锈。
2H+ + 2e- === H2↑
金属的电化学腐蚀
请问在什么条件下是吸氧腐蚀?
什么条件下是析氢腐蚀?
吸氧腐蚀:O2 + 2H2O + 4e- === 4OH-
析氢腐蚀:2H+ + 2e- === H2↑
铁生锈除了必须有空气及水的参与外还受其他一些因素的影响。请解释下列有关铁生锈现象的原因。
1.相对于内河行驶的轮船来说,海轮更容易被腐蚀
2.1910年遗留在南极的食品罐头盒,其表面至今很少有铁锈出现。
3.用于连接铜板的铁螺丝容易生锈。
交流与讨论
海水中电解质溶液的浓度大,腐蚀速率快
南极气温低,没有液态水,不能形成电解质溶液
铁与铜及空气、水形成原电池,铁作负极被氧化
请试着分析一下暖宝宝的发热原理?
02
第三单元 金属的腐蚀与防护
金属的电化学防护
金属的防护方法
在金属中添加其他金属或非金属制成性能优异的合金。如普通钢加入镍、铬制成不锈钢,钛合金不仅具有优异的抗腐蚀性能且具有良好的生物相容性。
1
改变金属材料的组成
金属的防护方法
在金属表面覆盖致密的保护层,从而使金属制品与周围物质(外界空气、水、电解质溶液等)隔离,这是一种被普遍采用的防护方法。
2
在金属表面覆盖保护层
①非金属保护层:如喷油漆、涂油脂、表面钝化。
②金属保护层:如铁制品上镀铜、锌等。
金属的防护方法
思考:在日常生活中,我们常常会接触到白铁皮(镀锌钢板)和马口铁(镀锡钢板),如果镀层破损后你认为谁更耐腐蚀?
白铁皮更耐腐蚀。金属活动性:锌>铁>锡,镀层破损后,锌、铁与附着的电解质溶液形成原电池,铁作为正极被保护,而铁、锡与附着的电解质溶液形成原电池,铁作为负极被腐蚀。
金属的防护方法
3
电化学防护法
利用原电池或电解池的原理,使被保护的金属始终处于电子流入端(正极/阴极),就不易被腐蚀。
金属的防护方法
3
电化学防护法
(1)牺牲阳极的阴极保护法
活泼性强的金属做负极,被保护金属做正极。
原理:
原电池原理
金属的防护方法
3
电化学防护法
(1)牺牲阳极的阴极保护法
此法常用于保护海轮外壳及石油管道等。
更活泼的金属(如镁、锌等)作阳极(负极),在不断被腐蚀后定期更换,而作为阴极(正极)的金属就不易被腐蚀而得到保护。
金属的防护方法
3
电化学防护法
(2)外加电流的阴极保护法
被保护的金属与外接电源负极相连做阴极。
原理:
电解池原理
金属的防护方法
3
电化学防护法
外加电流的阴极保护法
通电后,电子流向被保护的钢铁设备,在钢铁表面积累了大量的负电荷,从而抑制钢铁失去电子,阻止钢铁被腐蚀。
此主要用于防止土壤、海水及河水中金属设备的腐蚀。
金属的防护方法
如图所示的各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是什么?
④>②>①>③
01
电解引起的腐蚀 > 原电池引起的腐蚀 > 化学腐蚀
02
同一种金属在不同电解质溶液中,腐蚀快慢:
强电解质溶液 > 弱电解质溶液 > 非电解质溶液
03
活泼性不同的两金属,活泼性差别越大,腐蚀越快。
04
对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。
判断金属腐蚀快慢的规律
电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极
同一种金属在相同的电解质溶液中,腐蚀快慢:
如图所示,各烧杯中均盛有海水,铁在其中被腐蚀的速率由快到慢的顺序为( )
A.②①③④⑤⑥ B.⑤④③①②⑥
C.⑤④②①③⑥ D.⑤③②④①⑥
C
强化巩固
强化巩固
延时符
课堂小结
1.钢铁的防护有多种方法,下列对于图中的方法描述错误的是( )
A.a、b以导线连接,辅助电极发生氧化反应
B.a、b以导线连接或以电源连接,辅助电极的材料可能都含有Zn
C.a、b分别连接直流电源,通电后外电路电子被强制从辅助电极流向钢铁闸门
D.a、b分别连接直流电源的负极、正极,该方法是牺牲阳极法
D
课堂练习
2.炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图所示,下列说法正确的是 ( )
A.腐蚀过程中,负极是C
B.Fe失去电子经电解质溶液转移给C
C.正极的电极反应式为4OH--4e-==2H2O+O2↑
D.C是正极,O2在C表面上发生还原反应
D
课堂练习
