苏教版高中化学选择性必修1专题2第三单元化学平衡的移动2.3.1浓度、压强变化对化学平衡的影响课件(共30张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修1专题2第三单元化学平衡的移动2.3.1浓度、压强变化对化学平衡的影响课件(共30张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-21 18:09:20 | ||
图片预览








文档简介
(共30张PPT)
01
浓度、压强变化对化学平衡的影响
专题2 化学反应速率与化学平衡
第三单元 化学平衡的移动
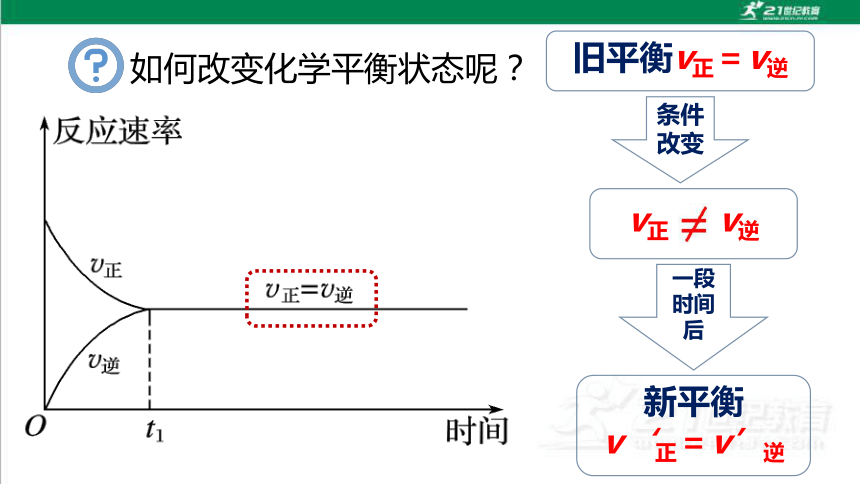
如何改变化学平衡状态呢?
旧平衡v正=v逆
条件改变
v正 v逆
一段时间后
新平衡
v‘正=v’逆
化学平衡移动
改变外界条件,破坏原有的平衡状态,建立起新的平衡状态的过程。
v正<v逆
v正=v逆
反应处于平衡状态
v正>v逆
平衡向正反应方向移动
平衡向逆反应方向移动
浓度、压强和温度
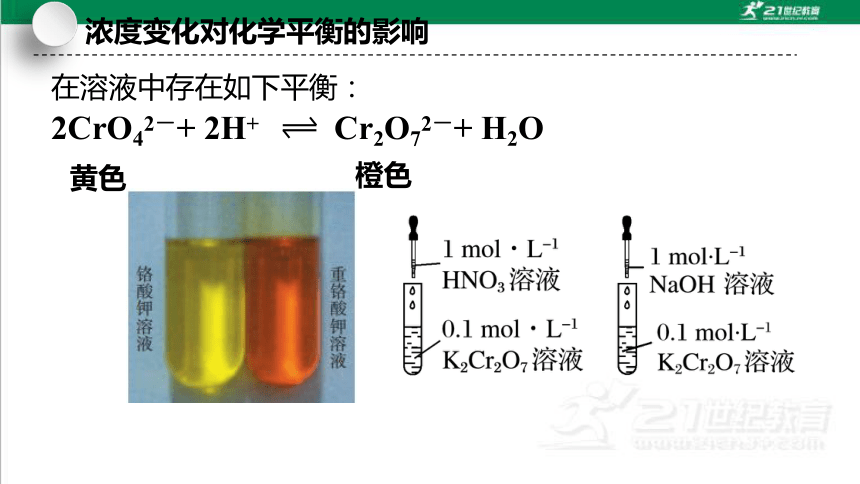
浓度变化对化学平衡的影响
2CrO42-+ 2H+ Cr2O72-+ H2O
黄色
橙色
在溶液中存在如下平衡:
浓度变化对化学平衡的影响
浓度变化对化学平衡的影响
平衡向逆反应方向移动
平衡向正反应方向移动
c(H+)增大
NaOH溶液使c(H+)变小
平衡向生成Cr2O72-或CrO42-减小方向移动
平衡向生成CrO42-或Cr2O72-减小方向移动
浓度变化对化学平衡的影响
②c(反应物)减小或c(生成物)增大,平衡向逆反应方向移动。
浓度对化学平衡移动的影响规律
当其他条件不变时:
①c(反应物)增大或c(生成物)减小,平衡向正反应方向移动。
反应物 生成物
向正反应方向移动
向逆反应方向移动
Q = K
Q < K
Q > K
平衡状态
浓度变化对化学平衡的影响
浓度对化学平衡的影响规律的解释
Q =
cp(C) cq(D)
cm(A) cn(B)
m A(g) + n B(g) p C(g) + q D(g)
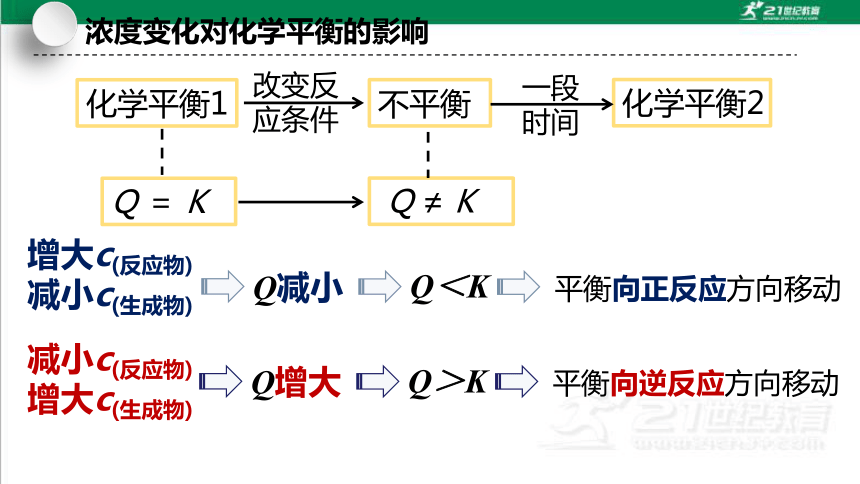
化学平衡1
Q = K
改变反
应条件
不平衡
Q ≠ K
一段时间
化学平衡2
浓度变化对化学平衡的影响
平衡向正反应方向移动
增大c(反应物)
减小c(生成物)
Q减小
Q<K
减小c(反应物)
增大c(生成物)
平衡向逆反应方向移动
Q增大
Q>K
浓度变化对化学平衡的影响
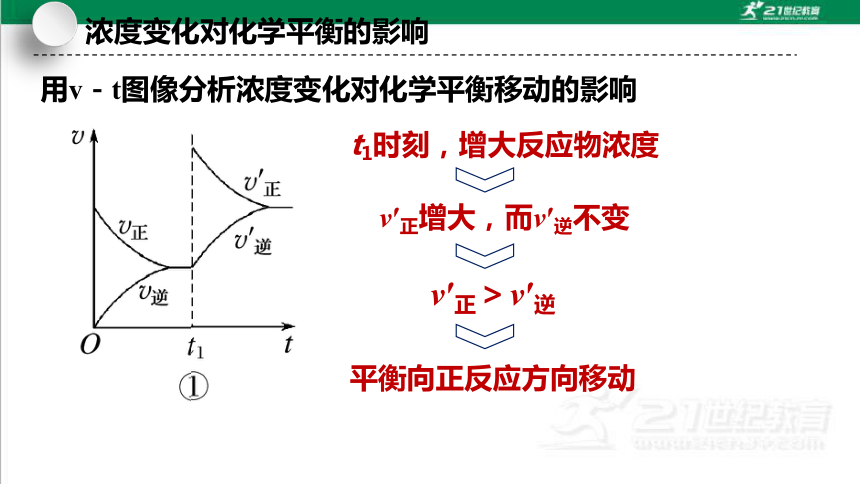
用v-t图像分析浓度变化对化学平衡移动的影响
平衡向正反应方向移动
t1时刻,增大反应物浓度
v′正增大,而v′逆不变
v′正>v′逆
浓度变化对化学平衡的影响
用v-t图像分析浓度变化对化学平衡移动的影响
平衡向正反应方向移动
t1时刻,减小生成物浓度
v′逆减小,而v′正不变
v′正>v′逆
浓度变化对化学平衡的影响
用v-t图像分析浓度变化对化学平衡移动的影响
平衡向逆反应方向移动
t1时刻,增大生成物浓度
v′逆增大,而v′正不变
v′逆>v′正
浓度变化对化学平衡的影响
用v-t图像分析浓度变化对化学平衡移动的影响
平衡向逆反应方向移动
t1时刻,减小反应物浓度
v′正减小,而v′逆不变
v′逆>v′正
浓度变化对化学平衡的影响
固体或纯液体的浓度是常数,改变固体或纯液体的量并不影响v正、v逆的大小,平衡不移动。
“浓度对化学平衡移动的影响”中的“浓度”是指与反应有关的气体或溶液中参加反应的离子的浓度。
对于离子平衡体系,注意离子浓度的改变方式,排除不参与反应的离子的干扰。
注意
浓度变化对化学平衡的影响
工业上用适当增加相对廉价的反应物或及时分离出生成物的方法提高产量、降低生产成本。
实际生产中的应用
压强变化对化学平衡的影响
2NO2(g) N2O4(g)
红棕色
无色
压强变化对化学平衡的影响
压强变化对化学平衡的影响
实验
(同温度下) 压强 各物质浓度
(mol·L-1) 浓度商
(Q )
NO2 N2O4
原化学平衡容器容积为V p1 a b
压缩容积至V/2 时
b
a2
= K
Q1=
2b
(2a)2
b
2a2
Q2=
2p1
2a
2b
=
通过计算Q2 =K/2 ,
即Q2 < K 向正反应方移动
2NO2(g) N2O4(g)
同温度:
压强变化对化学平衡的影响
向正反应方向移动
容积减小
原平衡气①
颜色变深②
颜色又变浅③
物质浓度瞬间增大
加压前
实验现象与分析
2NO2(g) N2O4(g)
红棕色
无色
加压
NO2浓度比②中的减小
向气体分子数减小方向移动
压强变化对化学平衡的影响
实验
(同温度下) 压强 各物质浓度
(mol·L-1) 浓度商
(Q )
NO2 N2O4
原化学平衡容器容积为V p1 a b
扩大容积至2V 时
b
( a)2
=
2b
a2
Q2=
b
a2
= K
P1
a
b
通过计算Q2 =2 K, 即Q2 > K 向逆反应方移动
1
2
1
2
1
2
1
2
1
2
2NO2(g) N2O4(g)
Q1=
同温度:
压强变化对化学平衡的影响
容积增大
原平衡气①
颜色变浅②
颜色又变深③
实验现象与分析
减压
向逆反应方向移动
物质浓度瞬间减小
减压前
NO2浓度比②中的增大
2NO2(g) N2O4(g)
红棕色
无色
向气体分子数增大方向移动
压强变化对化学平衡的影响
②减小压强,化学平衡向气体体积增大的方向移动。
压强对化学平衡移动的影响规律
当其他条件不变时:
①增大压强,化学平衡向气体体积减小的方向移动。
③对于反应前后气体分子数目不变的反应,改变压强平衡不移动。
压强变化对化学平衡的影响
用v-t图像分析压强变化对化学平衡移动的影响
平衡向正反应(气体体积减小)方向移动
t1时刻,增大压强
v′正、v′逆均增大
v′正>v′逆
N2(g)+3H2(g) 2NH3(g)为例
压强变化对化学平衡的影响
用v-t图像分析压强变化对化学平衡移动的影响
平衡向逆反应(气体体积增大)方向移动
t1时刻,减小压强
v′正、v′逆均减小
v′逆>v′正
N2(g)+3H2(g) 2NH3(g)为例
压强变化对化学平衡的影响
充入“惰性”气体对化学平衡的影响
恒容时,通入“惰性”气体
恒容
压强增大
平衡不移动
反应物生成物浓度不变
压强变化对化学平衡的影响
充入“惰性”气体对化学平衡的影响
恒压时,通入“惰性”气体
恒压
体积增大
平衡向气体体积增大的方向移动
压强变化对化学平衡的影响
对于反应前后气体体积相等的反应[如H2(g)+I2(g) 2HI(g)],当向平衡体系中充入“惰性”气体时,则无论任何情况下平衡都不发生移动。
充入“惰性”气体对化学平衡的影响
在恒容容器中,改变其中一种物质的浓度时,必然同时引起压强的改变,但判断平衡移动的方向时,应以浓度的影响进行分析,得出Qc与K的关系。
延时符
课堂小结
化学平衡状态
化学平衡移动
压强
浓度
改变
课堂练习
1、在一定条件下,反应:2SO2(g)+O2(g) 2SO3(g)达到了平衡,改变某一条件,发生下述变化,其中可确定该平衡一定发生移动的是( )
A.v(SO2)增大
B.v(SO3)减小
C.O2的百分含量发生变化
D.SO3的质量不变
C
课堂练习
2、在密闭容器中,反应:xA(g)+yB(g) zC(g),在一定条件下达到平衡状态,试回答下列问题:(1)若x+y>z,缩小体积,增大压强,则平衡向________方向移动。
(2)若保持体积不变,通入“He”气,则平衡________移动。
(3)若保持压强不变,通入“He”气,平衡向正反应方向移动,则x、y、z的关系为________。
(4)若x+y=z,缩小体积,增大压强,则平衡________移动。
不
正反应
不
x+y<z
01
浓度、压强变化对化学平衡的影响
专题2 化学反应速率与化学平衡
第三单元 化学平衡的移动
如何改变化学平衡状态呢?
旧平衡v正=v逆
条件改变
v正 v逆
一段时间后
新平衡
v‘正=v’逆
化学平衡移动
改变外界条件,破坏原有的平衡状态,建立起新的平衡状态的过程。
v正<v逆
v正=v逆
反应处于平衡状态
v正>v逆
平衡向正反应方向移动
平衡向逆反应方向移动
浓度、压强和温度
浓度变化对化学平衡的影响
2CrO42-+ 2H+ Cr2O72-+ H2O
黄色
橙色
在溶液中存在如下平衡:
浓度变化对化学平衡的影响
浓度变化对化学平衡的影响
平衡向逆反应方向移动
平衡向正反应方向移动
c(H+)增大
NaOH溶液使c(H+)变小
平衡向生成Cr2O72-或CrO42-减小方向移动
平衡向生成CrO42-或Cr2O72-减小方向移动
浓度变化对化学平衡的影响
②c(反应物)减小或c(生成物)增大,平衡向逆反应方向移动。
浓度对化学平衡移动的影响规律
当其他条件不变时:
①c(反应物)增大或c(生成物)减小,平衡向正反应方向移动。
反应物 生成物
向正反应方向移动
向逆反应方向移动
Q = K
Q < K
Q > K
平衡状态
浓度变化对化学平衡的影响
浓度对化学平衡的影响规律的解释
Q =
cp(C) cq(D)
cm(A) cn(B)
m A(g) + n B(g) p C(g) + q D(g)
化学平衡1
Q = K
改变反
应条件
不平衡
Q ≠ K
一段时间
化学平衡2
浓度变化对化学平衡的影响
平衡向正反应方向移动
增大c(反应物)
减小c(生成物)
Q减小
Q<K
减小c(反应物)
增大c(生成物)
平衡向逆反应方向移动
Q增大
Q>K
浓度变化对化学平衡的影响
用v-t图像分析浓度变化对化学平衡移动的影响
平衡向正反应方向移动
t1时刻,增大反应物浓度
v′正增大,而v′逆不变
v′正>v′逆
浓度变化对化学平衡的影响
用v-t图像分析浓度变化对化学平衡移动的影响
平衡向正反应方向移动
t1时刻,减小生成物浓度
v′逆减小,而v′正不变
v′正>v′逆
浓度变化对化学平衡的影响
用v-t图像分析浓度变化对化学平衡移动的影响
平衡向逆反应方向移动
t1时刻,增大生成物浓度
v′逆增大,而v′正不变
v′逆>v′正
浓度变化对化学平衡的影响
用v-t图像分析浓度变化对化学平衡移动的影响
平衡向逆反应方向移动
t1时刻,减小反应物浓度
v′正减小,而v′逆不变
v′逆>v′正
浓度变化对化学平衡的影响
固体或纯液体的浓度是常数,改变固体或纯液体的量并不影响v正、v逆的大小,平衡不移动。
“浓度对化学平衡移动的影响”中的“浓度”是指与反应有关的气体或溶液中参加反应的离子的浓度。
对于离子平衡体系,注意离子浓度的改变方式,排除不参与反应的离子的干扰。
注意
浓度变化对化学平衡的影响
工业上用适当增加相对廉价的反应物或及时分离出生成物的方法提高产量、降低生产成本。
实际生产中的应用
压强变化对化学平衡的影响
2NO2(g) N2O4(g)
红棕色
无色
压强变化对化学平衡的影响
压强变化对化学平衡的影响
实验
(同温度下) 压强 各物质浓度
(mol·L-1) 浓度商
(Q )
NO2 N2O4
原化学平衡容器容积为V p1 a b
压缩容积至V/2 时
b
a2
= K
Q1=
2b
(2a)2
b
2a2
Q2=
2p1
2a
2b
=
通过计算Q2 =K/2 ,
即Q2 < K 向正反应方移动
2NO2(g) N2O4(g)
同温度:
压强变化对化学平衡的影响
向正反应方向移动
容积减小
原平衡气①
颜色变深②
颜色又变浅③
物质浓度瞬间增大
加压前
实验现象与分析
2NO2(g) N2O4(g)
红棕色
无色
加压
NO2浓度比②中的减小
向气体分子数减小方向移动
压强变化对化学平衡的影响
实验
(同温度下) 压强 各物质浓度
(mol·L-1) 浓度商
(Q )
NO2 N2O4
原化学平衡容器容积为V p1 a b
扩大容积至2V 时
b
( a)2
=
2b
a2
Q2=
b
a2
= K
P1
a
b
通过计算Q2 =2 K, 即Q2 > K 向逆反应方移动
1
2
1
2
1
2
1
2
1
2
2NO2(g) N2O4(g)
Q1=
同温度:
压强变化对化学平衡的影响
容积增大
原平衡气①
颜色变浅②
颜色又变深③
实验现象与分析
减压
向逆反应方向移动
物质浓度瞬间减小
减压前
NO2浓度比②中的增大
2NO2(g) N2O4(g)
红棕色
无色
向气体分子数增大方向移动
压强变化对化学平衡的影响
②减小压强,化学平衡向气体体积增大的方向移动。
压强对化学平衡移动的影响规律
当其他条件不变时:
①增大压强,化学平衡向气体体积减小的方向移动。
③对于反应前后气体分子数目不变的反应,改变压强平衡不移动。
压强变化对化学平衡的影响
用v-t图像分析压强变化对化学平衡移动的影响
平衡向正反应(气体体积减小)方向移动
t1时刻,增大压强
v′正、v′逆均增大
v′正>v′逆
N2(g)+3H2(g) 2NH3(g)为例
压强变化对化学平衡的影响
用v-t图像分析压强变化对化学平衡移动的影响
平衡向逆反应(气体体积增大)方向移动
t1时刻,减小压强
v′正、v′逆均减小
v′逆>v′正
N2(g)+3H2(g) 2NH3(g)为例
压强变化对化学平衡的影响
充入“惰性”气体对化学平衡的影响
恒容时,通入“惰性”气体
恒容
压强增大
平衡不移动
反应物生成物浓度不变
压强变化对化学平衡的影响
充入“惰性”气体对化学平衡的影响
恒压时,通入“惰性”气体
恒压
体积增大
平衡向气体体积增大的方向移动
压强变化对化学平衡的影响
对于反应前后气体体积相等的反应[如H2(g)+I2(g) 2HI(g)],当向平衡体系中充入“惰性”气体时,则无论任何情况下平衡都不发生移动。
充入“惰性”气体对化学平衡的影响
在恒容容器中,改变其中一种物质的浓度时,必然同时引起压强的改变,但判断平衡移动的方向时,应以浓度的影响进行分析,得出Qc与K的关系。
延时符
课堂小结
化学平衡状态
化学平衡移动
压强
浓度
改变
课堂练习
1、在一定条件下,反应:2SO2(g)+O2(g) 2SO3(g)达到了平衡,改变某一条件,发生下述变化,其中可确定该平衡一定发生移动的是( )
A.v(SO2)增大
B.v(SO3)减小
C.O2的百分含量发生变化
D.SO3的质量不变
C
课堂练习
2、在密闭容器中,反应:xA(g)+yB(g) zC(g),在一定条件下达到平衡状态,试回答下列问题:(1)若x+y>z,缩小体积,增大压强,则平衡向________方向移动。
(2)若保持体积不变,通入“He”气,则平衡________移动。
(3)若保持压强不变,通入“He”气,平衡向正反应方向移动,则x、y、z的关系为________。
(4)若x+y=z,缩小体积,增大压强,则平衡________移动。
不
正反应
不
x+y<z
