苏教版高中化学选择性必修1专题3第三单元盐类的水解3.3.2影响盐类水解的因素盐类水解的应用(共23张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修1专题3第三单元盐类的水解3.3.2影响盐类水解的因素盐类水解的应用(共23张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 726.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-21 00:00:00 | ||
图片预览




文档简介
(共23张PPT)
第三单元 盐类的水解
第2课时 影响盐类水解的因素
盐类水解的应用
专题3 水溶液中的离子反应
已知:HCN、HClO、CH3COOH都是弱酸,它们的电离常数
Ka( HCN) =4.93×10-10、Ka( HClO) =2.95×10-8、Ka( CH3COOH) =1.76×10-5。试推测0.1mol/LNaCN、NaClO、CH3COONa溶液PH的大小顺序,并用PH计测量,验证你的推测。
盐溶液
(0.1mol/L) 水解的离子方程式 pH
NaCN
NaClO
CH3COONa
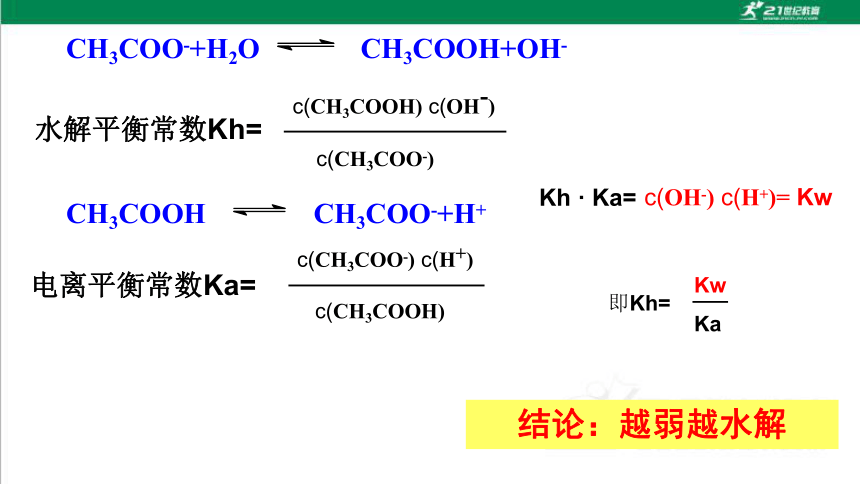
CH3COO-+H2O CH3COOH+OH-
CN-+H2O HCN+OH-
ClO-+H2O HClO+OH-
11.1
10.3
8.8
HCN<HClO<CH3COOH
酸性:
对应盐的碱性:
NaCN>NaClO>CH3COONa
CH3COO-+H2O CH3COOH+OH-
水解平衡常数Kh=
c(CH3COOH) c(OH-)
c(CH3COO-)
CH3COOH CH3COO-+H+
电离平衡常数Ka=
Kh · Ka=
c(OH-) c(H+)= Kw
c(CH3COO-) c(H+)
c(CH3COOH)
即Kh=
Kw
Ka
结论:越弱越水解
一、盐类水解的影响因素
1.内因—盐本身的性质。
组成盐的酸根离子对应的酸越弱,或阳离子对应的碱越弱,水解程度越大。
练习:比较下列盐的酸碱性强弱
①NaClO NaHCO3
② MgCl2 AlCl3
③Na2CO3 NaHCO3
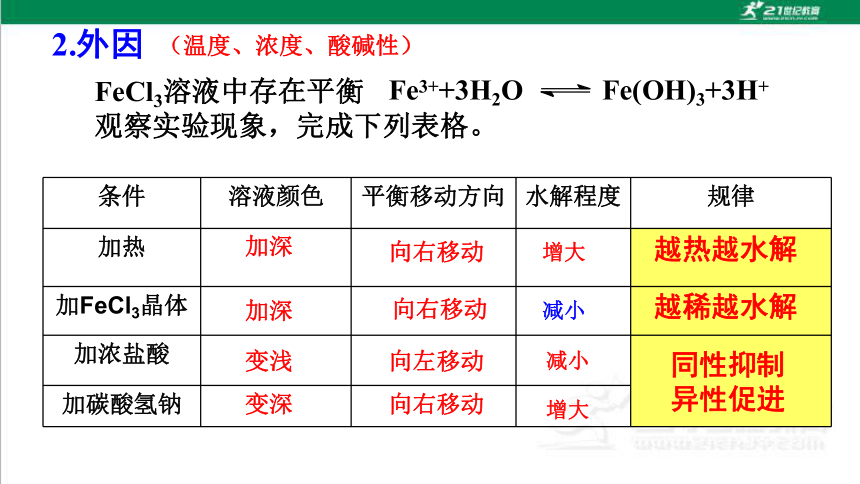
2.外因
Fe3++3H2O Fe(OH)3+3H+
FeCl3溶液中存在平衡
观察实验现象,完成下列表格。
条件 溶液颜色 平衡移动方向 水解程度 规律
加热
加FeCl3晶体
加浓盐酸
加碳酸氢钠
加深
加深
变浅
向右移动
向右移动
向左移动
增大
减小
减小
越热越水解
越稀越水解
变深
向右移动
增大
同性抑制
异性促进
(温度、浓度、酸碱性)
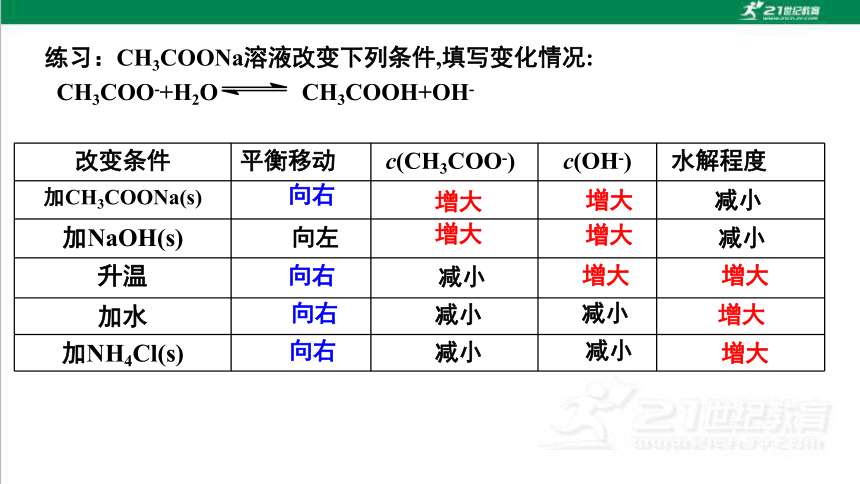
改变条件 平衡移动 c(CH3COO-) c(OH-) 水解程度
加CH3COONa(s)
加NaOH(s)
升温
加水
加NH4Cl(s)
向右
增大
增大
减小
向右
减小
增大
增大
向右
减小
减小
增大
向右
减小
减小
增大
练习:CH3COONa溶液改变下列条件,填写变化情况:
CH3COO-+H2O CH3COOH+OH-
向左
增大
增大
减小
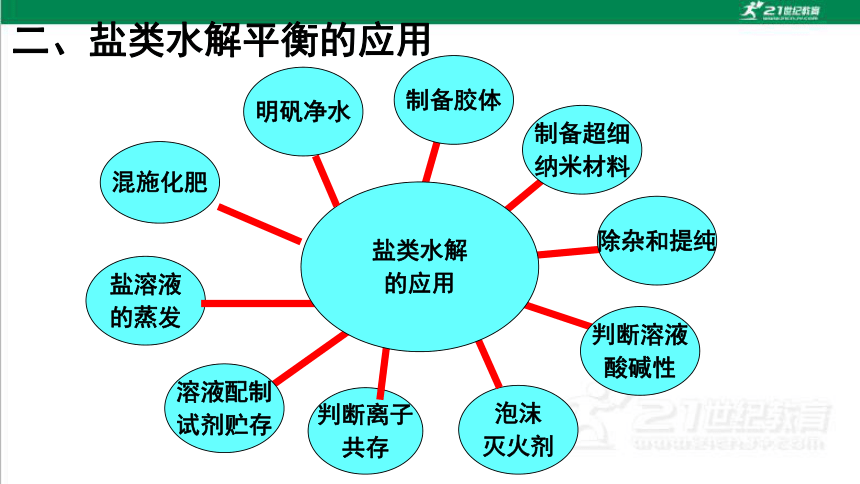
混施化肥
泡沫
灭火剂
制备胶体
制备超细
纳米材料
判断溶液
酸碱性
判断离子
共存
盐溶液
的蒸发
溶液配制
试剂贮存
盐类水解
的应用
二、盐类水解平衡的应用
明矾净水
除杂和提纯
(一) 判断盐溶液的酸碱性:
①NaCl溶液
②CH3COONa溶液
③NH4Cl溶液:
中性
碱性
酸性
④NaHCO3溶液
碱性
⑤NaHSO4溶液
酸性
⑥Na2CO3溶液
碱性
(相同温度和浓度)
并将以上溶液由PH由大到小顺序排序
⑥>④>②>①>③>⑤
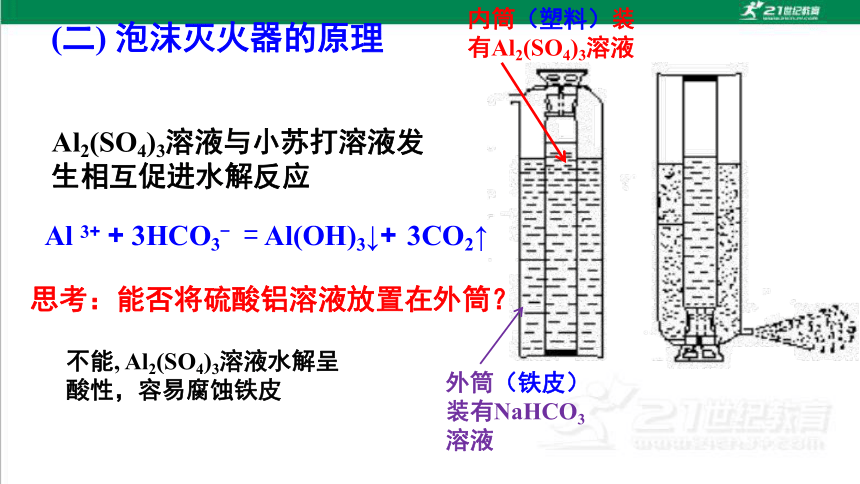
(二) 泡沫灭火器的原理
内筒(塑料)装有Al2(SO4)3溶液
外筒(铁皮)装有NaHCO3溶液
Al 3+ + 3HCO3- = Al(OH)3↓+ 3CO2↑
Al2(SO4)3溶液与小苏打溶液发生相互促进水解反应
思考:能否将硫酸铝溶液放置在外筒?
不能, Al2(SO4)3溶液水解呈酸性,容易腐蚀铁皮
(三)判断溶液中离子能否大量共存
Al3+
当有弱碱阳离子和弱酸阴离子之间能发生完全双水解,则不能在溶液中大量共存。
AlO2–
CO32–
HCO3–
S2–
HS–
SiO32–
Fe3+
AlO2–
CO32–
HCO3–
Al 3+ + 3AlO2 – + 6H2O= 4Al(OH)3↓
Al 3+ + 3HCO3 –=Al(OH)3↓+ 3CO2↑
2Al3++ 3CO32–+3H2O=2Al(OH)3 ↓+ 3CO2↑
(四) 易水解盐溶液的配制与保存:
(2)保存NaF溶液 :
方法:先将FeCl3溶于盐酸,再加水稀释到相应浓度。
应保存在铅容器或塑料瓶,不能存放在玻璃瓶中!
(1)配制 FeCl3溶液:
F-+ H2O HF+ OH-
(3)盛放Na2S 、Na2CO3的试剂瓶不能用玻璃塞,须用橡胶塞。
(4)酸和水解呈酸性的盐不能用铁(铝)制品保存运输
Fe3+ + 3H2O Fe(OH)3 + 3H+
(五) 某些盐的无水物,不能用蒸发溶液的方法制取
AlCl3溶液中水解:
方法:晶体只有在干燥的HCl气流中加热,才能得到无水MgCl2、 FeCl3、AlCl3晶体。
AlCl3+3H2O Al(OH)3+3HCl
2Al(OH)3=Al2O3+3H2O
△
同理,蒸干FeCl3、 MgCl2等溶液均不能得到对应的晶体。
FeCl3 溶液
Fe(NO3)3 溶液
Fe2(SO4)3 溶液
CuSO4 · 5H2O
(NH4)2CO3
Na2CO3 溶液
Na2SO3 溶液
Ca(HCO3)2 溶液
练习:下列盐溶液加热蒸干、灼烧后,得到什么固体物质?
Fe2O3
Fe2O3
Fe2(SO4)3
Na2CO3
无
CuSO4
Na2SO4
CaCO3
水解生成易挥发性酸
水解产物均易挥发
易被氧化的盐
不稳定化合物
草木灰(主要成分为K2CO3)和铵态氮肥(如主要成分为NH4Cl)不能混合使用,为什么
(六)化肥混合施用
草木灰的主要成分:K2CO3,水解呈碱性
铵态氮肥(铵盐): NH4Cl,水解呈酸性
2NH4+ + CO32-=== 2NH3↑ + CO2↑ + H2O
受热
混施后,两种盐的水解相互促进,生成大量的NH3·H2O,进一步分解成NH3逸出了,从而降低了肥效。
(七)盐作净化剂的原理
明矾KAl(SO4)2 ·12H2O可做净水剂
Al 3+ + 3H2O Al(OH)3 (胶体) + 3H +
水解产生的胶体可吸附不溶性杂质,起到净水作用。
(八) 实验室制备 Fe(OH)3胶体
向沸腾的蒸馏水中逐滴加入1~2mL饱和FeCl3溶液,继续煮沸至液体呈红褐色,停止加热.
Fe 3+ + 3H2O Fe (OH)3 (胶体) + 3H +
*
(九)制备纳米材料
如用TiCl4制备TiO2的反应可表示如下:
TiCl4 + (x+2)H2O(过量) TiO2.x H2O ↓+4HCl
纳米材料
(十)利用盐类水解除杂
如: MgCl2溶液中混有FeCl3杂质。
Fe3+ + 3H2O Fe(OH)3 + 3H+
可加入MgO、Mg(OH)2 、MgCO3
MgO+ 2H+ = Mg2+ + H2O
(十一) 热的纯碱去污能力更强
在碱性条件下热的碱水去油污能力强
(十二)活泼金属溶于强酸弱碱盐产生气体
Mg+2NH4Cl=MgCl2+2NH3↑ +H2↑
NH4++H2O NH3 H2O + H+
Mg+ 2H+ = Mg2+ + H2↑
“焊药”—金属焊接时常用于除去金属表面的氧化膜,常用ZnCl2、NH4Cl。
(十三)除锈剂
【巩固练习】
1.正误判断(正确的划“√”,错误的划“×”)。
(1)向氯化铁溶液中加入氯化铁固体,其水解程度增大。( )
(2)将氯化铵溶液加水稀释,其水解程度增大。( )
(3)热的纯碱溶液去污效果好。( )
(4)配制氯化铁溶液时,将氯化铁溶解在蒸馏水中即可。( )
(5)铝盐可用于净水,是因为铝离子水解产生的胶体具有吸附性。( )
×
√
√
√
×
2.下面的问题中,与盐类水解有关的是( )
①为保存FeCl3溶液,要在溶液中加入少量盐酸;
②实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡胶塞;
③在NH4Cl或AlCl3溶液中加入镁条会产生气泡;
④长期使用硫酸铵,土壤酸性增强。
A.只有①④ B.只有②③ C.只有③④ D.全部
D
3.下列关于盐类水解应用的说法中正确的是( )
A.AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、 灼烧,所得固体的成分相同
B.配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
C.向CuCl2溶液加入CuO调节pH可除去溶液中混有的Fe3+
D.泡沫灭火器中常使用的原料是碳酸钠和硫酸铝
C
4.在蒸发皿中用酒精灯加热蒸干下列物质的溶液然后灼烧,可以得到该物质固体的是( )
A.AlCl3 B.Na2SO3
C.KMnO4 D.MgSO4
D
第三单元 盐类的水解
第2课时 影响盐类水解的因素
盐类水解的应用
专题3 水溶液中的离子反应
已知:HCN、HClO、CH3COOH都是弱酸,它们的电离常数
Ka( HCN) =4.93×10-10、Ka( HClO) =2.95×10-8、Ka( CH3COOH) =1.76×10-5。试推测0.1mol/LNaCN、NaClO、CH3COONa溶液PH的大小顺序,并用PH计测量,验证你的推测。
盐溶液
(0.1mol/L) 水解的离子方程式 pH
NaCN
NaClO
CH3COONa
CH3COO-+H2O CH3COOH+OH-
CN-+H2O HCN+OH-
ClO-+H2O HClO+OH-
11.1
10.3
8.8
HCN<HClO<CH3COOH
酸性:
对应盐的碱性:
NaCN>NaClO>CH3COONa
CH3COO-+H2O CH3COOH+OH-
水解平衡常数Kh=
c(CH3COOH) c(OH-)
c(CH3COO-)
CH3COOH CH3COO-+H+
电离平衡常数Ka=
Kh · Ka=
c(OH-) c(H+)= Kw
c(CH3COO-) c(H+)
c(CH3COOH)
即Kh=
Kw
Ka
结论:越弱越水解
一、盐类水解的影响因素
1.内因—盐本身的性质。
组成盐的酸根离子对应的酸越弱,或阳离子对应的碱越弱,水解程度越大。
练习:比较下列盐的酸碱性强弱
①NaClO NaHCO3
② MgCl2 AlCl3
③Na2CO3 NaHCO3
2.外因
Fe3++3H2O Fe(OH)3+3H+
FeCl3溶液中存在平衡
观察实验现象,完成下列表格。
条件 溶液颜色 平衡移动方向 水解程度 规律
加热
加FeCl3晶体
加浓盐酸
加碳酸氢钠
加深
加深
变浅
向右移动
向右移动
向左移动
增大
减小
减小
越热越水解
越稀越水解
变深
向右移动
增大
同性抑制
异性促进
(温度、浓度、酸碱性)
改变条件 平衡移动 c(CH3COO-) c(OH-) 水解程度
加CH3COONa(s)
加NaOH(s)
升温
加水
加NH4Cl(s)
向右
增大
增大
减小
向右
减小
增大
增大
向右
减小
减小
增大
向右
减小
减小
增大
练习:CH3COONa溶液改变下列条件,填写变化情况:
CH3COO-+H2O CH3COOH+OH-
向左
增大
增大
减小
混施化肥
泡沫
灭火剂
制备胶体
制备超细
纳米材料
判断溶液
酸碱性
判断离子
共存
盐溶液
的蒸发
溶液配制
试剂贮存
盐类水解
的应用
二、盐类水解平衡的应用
明矾净水
除杂和提纯
(一) 判断盐溶液的酸碱性:
①NaCl溶液
②CH3COONa溶液
③NH4Cl溶液:
中性
碱性
酸性
④NaHCO3溶液
碱性
⑤NaHSO4溶液
酸性
⑥Na2CO3溶液
碱性
(相同温度和浓度)
并将以上溶液由PH由大到小顺序排序
⑥>④>②>①>③>⑤
(二) 泡沫灭火器的原理
内筒(塑料)装有Al2(SO4)3溶液
外筒(铁皮)装有NaHCO3溶液
Al 3+ + 3HCO3- = Al(OH)3↓+ 3CO2↑
Al2(SO4)3溶液与小苏打溶液发生相互促进水解反应
思考:能否将硫酸铝溶液放置在外筒?
不能, Al2(SO4)3溶液水解呈酸性,容易腐蚀铁皮
(三)判断溶液中离子能否大量共存
Al3+
当有弱碱阳离子和弱酸阴离子之间能发生完全双水解,则不能在溶液中大量共存。
AlO2–
CO32–
HCO3–
S2–
HS–
SiO32–
Fe3+
AlO2–
CO32–
HCO3–
Al 3+ + 3AlO2 – + 6H2O= 4Al(OH)3↓
Al 3+ + 3HCO3 –=Al(OH)3↓+ 3CO2↑
2Al3++ 3CO32–+3H2O=2Al(OH)3 ↓+ 3CO2↑
(四) 易水解盐溶液的配制与保存:
(2)保存NaF溶液 :
方法:先将FeCl3溶于盐酸,再加水稀释到相应浓度。
应保存在铅容器或塑料瓶,不能存放在玻璃瓶中!
(1)配制 FeCl3溶液:
F-+ H2O HF+ OH-
(3)盛放Na2S 、Na2CO3的试剂瓶不能用玻璃塞,须用橡胶塞。
(4)酸和水解呈酸性的盐不能用铁(铝)制品保存运输
Fe3+ + 3H2O Fe(OH)3 + 3H+
(五) 某些盐的无水物,不能用蒸发溶液的方法制取
AlCl3溶液中水解:
方法:晶体只有在干燥的HCl气流中加热,才能得到无水MgCl2、 FeCl3、AlCl3晶体。
AlCl3+3H2O Al(OH)3+3HCl
2Al(OH)3=Al2O3+3H2O
△
同理,蒸干FeCl3、 MgCl2等溶液均不能得到对应的晶体。
FeCl3 溶液
Fe(NO3)3 溶液
Fe2(SO4)3 溶液
CuSO4 · 5H2O
(NH4)2CO3
Na2CO3 溶液
Na2SO3 溶液
Ca(HCO3)2 溶液
练习:下列盐溶液加热蒸干、灼烧后,得到什么固体物质?
Fe2O3
Fe2O3
Fe2(SO4)3
Na2CO3
无
CuSO4
Na2SO4
CaCO3
水解生成易挥发性酸
水解产物均易挥发
易被氧化的盐
不稳定化合物
草木灰(主要成分为K2CO3)和铵态氮肥(如主要成分为NH4Cl)不能混合使用,为什么
(六)化肥混合施用
草木灰的主要成分:K2CO3,水解呈碱性
铵态氮肥(铵盐): NH4Cl,水解呈酸性
2NH4+ + CO32-=== 2NH3↑ + CO2↑ + H2O
受热
混施后,两种盐的水解相互促进,生成大量的NH3·H2O,进一步分解成NH3逸出了,从而降低了肥效。
(七)盐作净化剂的原理
明矾KAl(SO4)2 ·12H2O可做净水剂
Al 3+ + 3H2O Al(OH)3 (胶体) + 3H +
水解产生的胶体可吸附不溶性杂质,起到净水作用。
(八) 实验室制备 Fe(OH)3胶体
向沸腾的蒸馏水中逐滴加入1~2mL饱和FeCl3溶液,继续煮沸至液体呈红褐色,停止加热.
Fe 3+ + 3H2O Fe (OH)3 (胶体) + 3H +
*
(九)制备纳米材料
如用TiCl4制备TiO2的反应可表示如下:
TiCl4 + (x+2)H2O(过量) TiO2.x H2O ↓+4HCl
纳米材料
(十)利用盐类水解除杂
如: MgCl2溶液中混有FeCl3杂质。
Fe3+ + 3H2O Fe(OH)3 + 3H+
可加入MgO、Mg(OH)2 、MgCO3
MgO+ 2H+ = Mg2+ + H2O
(十一) 热的纯碱去污能力更强
在碱性条件下热的碱水去油污能力强
(十二)活泼金属溶于强酸弱碱盐产生气体
Mg+2NH4Cl=MgCl2+2NH3↑ +H2↑
NH4++H2O NH3 H2O + H+
Mg+ 2H+ = Mg2+ + H2↑
“焊药”—金属焊接时常用于除去金属表面的氧化膜,常用ZnCl2、NH4Cl。
(十三)除锈剂
【巩固练习】
1.正误判断(正确的划“√”,错误的划“×”)。
(1)向氯化铁溶液中加入氯化铁固体,其水解程度增大。( )
(2)将氯化铵溶液加水稀释,其水解程度增大。( )
(3)热的纯碱溶液去污效果好。( )
(4)配制氯化铁溶液时,将氯化铁溶解在蒸馏水中即可。( )
(5)铝盐可用于净水,是因为铝离子水解产生的胶体具有吸附性。( )
×
√
√
√
×
2.下面的问题中,与盐类水解有关的是( )
①为保存FeCl3溶液,要在溶液中加入少量盐酸;
②实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡胶塞;
③在NH4Cl或AlCl3溶液中加入镁条会产生气泡;
④长期使用硫酸铵,土壤酸性增强。
A.只有①④ B.只有②③ C.只有③④ D.全部
D
3.下列关于盐类水解应用的说法中正确的是( )
A.AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、 灼烧,所得固体的成分相同
B.配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
C.向CuCl2溶液加入CuO调节pH可除去溶液中混有的Fe3+
D.泡沫灭火器中常使用的原料是碳酸钠和硫酸铝
C
4.在蒸发皿中用酒精灯加热蒸干下列物质的溶液然后灼烧,可以得到该物质固体的是( )
A.AlCl3 B.Na2SO3
C.KMnO4 D.MgSO4
D
