苏教版高中化学选择性必修1专题3第三单元盐类的水解3.3.1盐类水解的原理课件(共30张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修1专题3第三单元盐类的水解3.3.1盐类水解的原理课件(共30张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-21 18:12:10 | ||
图片预览






文档简介
(共30张PPT)
盐类水解的原理
第1课时
专题3 水溶液中的离子反应
第三单元 盐类的水解
1.通过实验探究盐溶液的酸碱性,掌握盐的类型与其溶液酸碱性的关系。
2.能分析盐溶液呈现不同酸碱性的原因,掌握盐类水解的原理及盐溶液呈现不同酸碱性的规律。
3.理解盐类水解的概念,认识盐类水解有一定限度,能正确书写盐类水解的 离子方程式和化学方程式。
1.盐类水解的实质和规律。
2.盐类水解的离子方程式的书写。
[学习目标]
[重点难点]
新课导入
1.Na2CO3俗称纯碱,经常用于面食制作和油污清洗等,明明是盐,为什么叫纯碱?
Na2CO3溶液呈碱性
盐溶液可能呈中性、酸性、也可能呈碱性
2.酸溶液呈酸性,碱溶液呈碱性,那么盐溶液呢?一定呈中性吗?
3.盐溶液的酸碱性与盐的类型之间有什么关系?
探究讨论
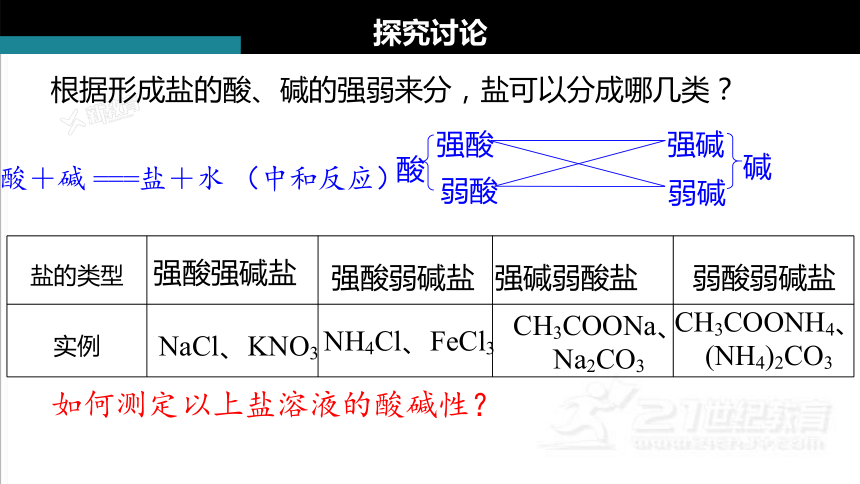
酸
强酸
弱酸
弱碱
强碱
碱
酸+碱 ===盐+水 (中和反应)
根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?
盐的类型
实例
强酸强碱盐
强酸弱碱盐
强碱弱酸盐
弱酸弱碱盐
NaCl、KNO3
NH4Cl、FeCl3
CH3COONa、Na2CO3
CH3COONH4、(NH4)2CO3
如何测定以上盐溶液的酸碱性?
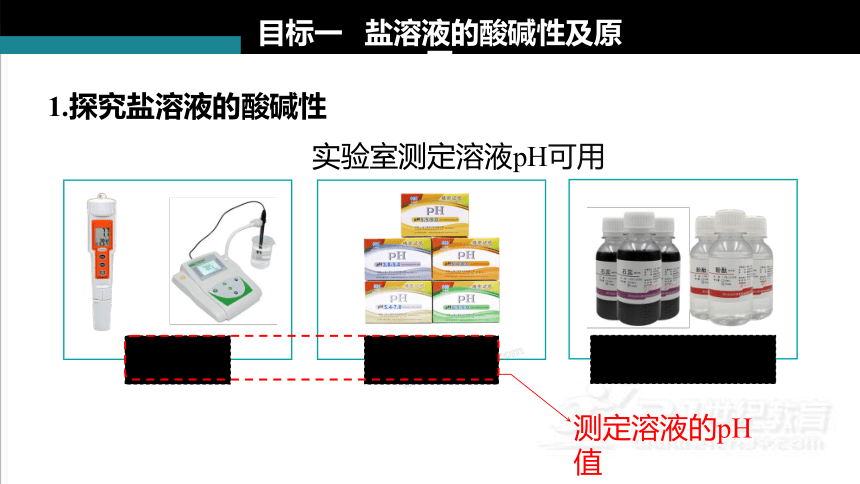
1.探究盐溶液的酸碱性
目标一 盐溶液的酸碱性及原因
实验室测定溶液pH可用
测定溶液的pH值
pH试纸法
酸碱指示剂法
pH计法
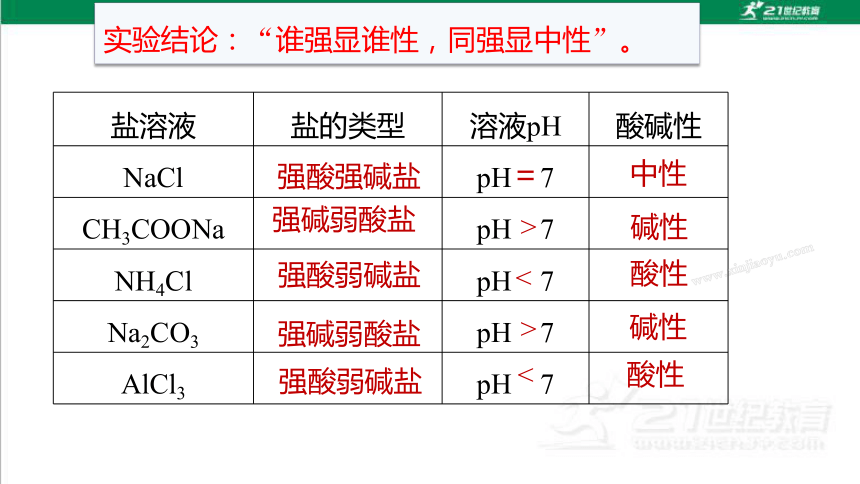
盐溶液 盐的类型 溶液pH 酸碱性
NaCl pH 7
CH3COONa pH 7
NH4Cl pH 7
Na2CO3 pH 7
AlCl3 pH 7
实验结论:“谁强显谁性,同强显中性”。
强酸强碱盐
=
中性
强碱弱酸盐
强酸弱碱盐
强碱弱酸盐
强酸弱碱盐
碱性
酸性
碱性
酸性
>
<
>
<
c(H+) = c(OH-)
溶液呈中性
NaCl电离产生的Na+ 和Cl– 均不能与水电离产生的H+ 和 OH– 相互作用生成弱电解质。
即加NaCl后不影响水的电离平衡。
不结合
不结合
NaCl Cl– + Na+
H2O H+ + OH–
溶质
溶剂
物质
存在的离子及互相作用
水的电离平衡移动
宏观现象
任务3 模型应用,分析氯化钠溶液中性原因
溶剂
溶质
物质
存在的离子
平衡移动
宏观现象
相互反应
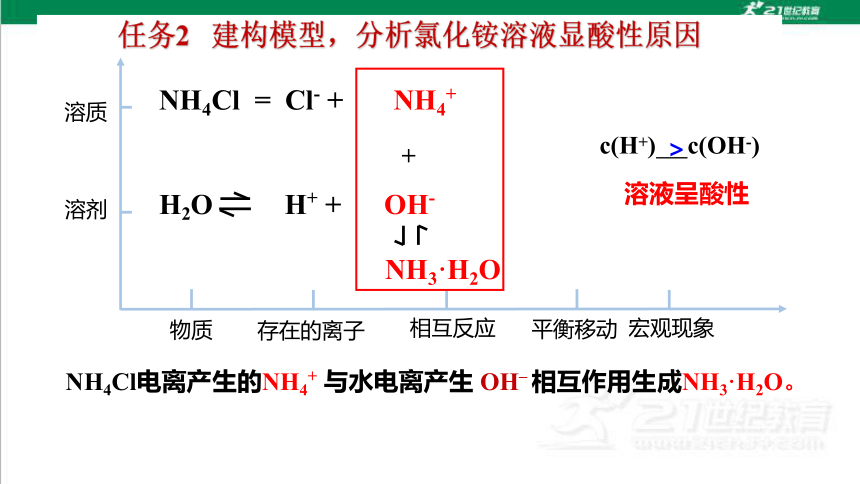
c(H+) c(OH-)
NH4Cl = Cl- + NH4+
H2O H+ + OH-
+
NH3·H2O
>
溶液呈酸性
任务2 建构模型,分析氯化铵溶液显酸性原因
NH4Cl电离产生的NH4+ 与水电离产生 OH– 相互作用生成NH3·H2O。
溶剂
溶质
物质
存在的离子
平衡移动
宏观现象
相互反应
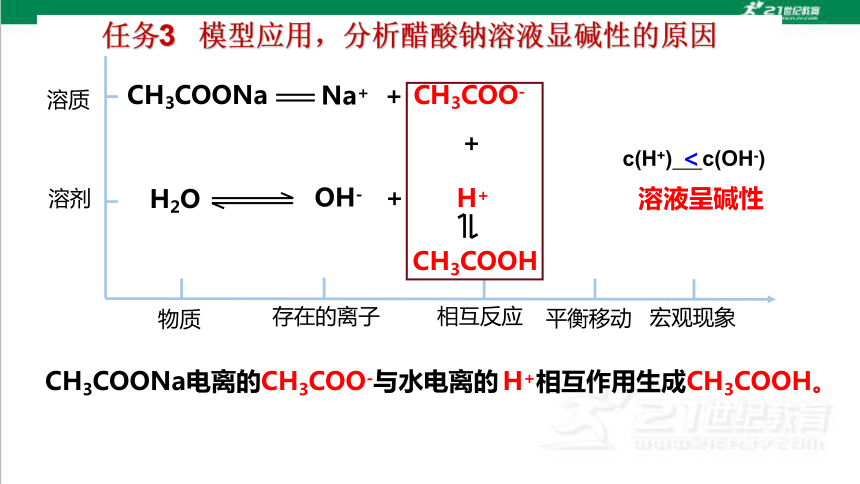
CH3COONa
H2O
CH3COO-
Na+ +
H+
OH- +
+
CH3COOH
c(H+) c(OH-)
<
溶液呈碱性
任务3 模型应用,分析醋酸钠溶液显碱性的原因
CH3COONa电离的CH3COO-与水电离的 H+相互作用生成CH3COOH。
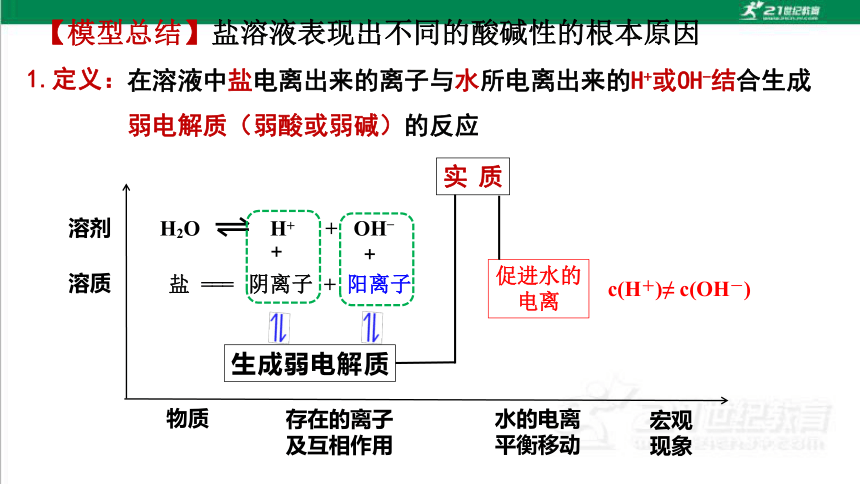
【模型总结】盐溶液表现出不同的酸碱性的根本原因
溶质
溶剂
物质
存在的离子及互相作用
水的电离平衡移动
宏观现象
H2O H+ + OH–
盐 === 阴离子 + 阳离子
+
+
生成弱电解质
促进水的电离
c(H+)≠ c(OH-)
实质
1.定义:
在溶液中盐电离出来的离子与水所电离出来的H+或OH-结合生成弱电解质(弱酸或弱碱)的反应
3.盐类的水解
定义:盐在水溶液中电离出的离子与水电离出的H+或OH-结合生成弱电解质的反应。
条件
条件:盐易溶,且有弱离子
实质:促进水的电离
水解反应是可逆反应
可逆
吸热
微弱
分步
水解反应可以看成酸碱中和反应的逆过程,是吸热反应
水解反应程度很微弱
多元弱酸的酸根水解是分步进行的,但以第一步为主
特点
4.盐类水解的规律
强酸弱碱盐
强碱弱酸盐
弱酸弱碱盐
强酸强碱盐
pH<7
pH>7
pH=7
越弱越水解
谁弱谁水解,都弱都水解
无弱不水解
同强显中性
谁强显谁性
常见的“弱”离子
目标二 盐类水解方程式的书写
盐的类型 实例 水解的离子方程式
一元弱酸盐/弱碱盐 NaClO
(NH4)2SO4
谁弱写谁
盐类的水解可以看作酸碱中和反应的逆过程。
盐的类型 实例 水解的离子方程式
多元弱酸盐 Na2CO3
2. 多元弱酸,其酸根离子的水解是分步进行的,以第一步为主。
3. 多元弱碱阳离子水解反应过程复杂,要求一步写到底。
盐的类型 实例 水解的离子方程式
多元弱碱盐 AlCl3
Al3++3H2O Al(OH)3+3H+
4. 弱酸弱碱盐中阴、阳离子水解相互促进。
1.下列有水参与的反应属于盐类水解反应的是
√
导练
化合反应
为H3BO3的电离方程式
2.写下列物质发生水解反应的离子方程式,并指明水溶液的酸碱性:
Na2S:_____________________________________________________。
CuSO4:_________________________________。
CH3COONa:_________________________________________。
Fe2(SO4)3:_________________________________。
NH4NO3:________________________________。
1.正误判断
(1)酸式盐溶液可能呈酸性,也可能呈碱性( )
(2)某盐溶液呈酸性,该盐一定发生了水解反应( )
(3)常温下,pH=10的CH3COONa溶液与pH=4的NH4Cl溶液,水的电离程度相同( )
√
×
√
导思
酸式盐要根据电离和水解程度分析溶液的酸碱性。
强酸的酸式盐(如NaHSO4)只电离,不水解,溶液呈酸性
2.室温下,测得等浓度的CH3COONa和NaClO的pH,发现NaClO溶液的pH大,试分析原因。
3.实验测得常温下NaHCO3溶液的pH>7,请从电离和水解两方面分析NaHCO3溶液呈碱性的原因
提示 因为酸性:CH3COOH>HClO,故ClO-在溶液中的水解能力较强,因此NaClO溶液的pH大。
提示
水解>电离
多元弱酸的酸式盐即水解又电离
水解>电离 显碱性:NaHCO3 NaHS Na2HPO4
电离>水解 显酸性: NaHSO3 NaHC2O4 NaH2PO4
4.常温下,Ka(CH3COOH)=1.8×10-5,Kb(NH3·H2O)=1.8×10-5,解释CH3COONH4溶液呈中性的原因。
1.有下列盐溶液:
①KNO3 ②CuSO4 ③K2CO3 ④FeCl3 ⑤K2SO4 ⑥NaClO ⑦NH4Cl ⑧AgNO3
呈酸性的是 (填序号,下同),呈碱性的是 ,呈中性的是 。
导练
②④⑦⑧
③⑥
①⑤
CuSO4、AgNO3、FeCl3、NH4Cl属于强酸弱碱盐,溶液呈酸性;
K2CO3、NaClO属于强碱弱酸盐,溶液呈碱性;
KNO3、K2SO4属于强酸强碱盐,溶液呈中性。
2.等物质的量浓度的下列物质的溶液,其pH由小到大的顺序是_____________
(填序号)。
①CH3COONa ②NaOH ③NaNO3 ④HCl
⑤Al2(SO4)3 ⑥CH3COOH
④⑥⑤③①②
强酸
强碱
中性
弱酸
碱性
酸性
3.常温下,某浓度的NH4Cl溶液的pH为4,回答下列问题:
(1)该NH4Cl溶液中含氮元素的微粒有 。
(2)该NH4Cl溶液中c水(H+)与pH=4的盐酸中c水(H+)比值为 。
106
pH=4的NH4Cl溶液中水电离的c水(H+)=10-4 mol·L-1
pH=4的盐酸中水电离的c水(H+)=10-10 mol·L-1
1.下列有关盐类水解的说法不正确的是
A.盐类的水解过程破坏了纯水的电离平衡
B.盐类的水解是酸碱中和反应的逆过程
C.盐类水解的结果使溶液一定不呈中性
1
2
3
自我测试
4
√
5
谁强显谁性,同强显中性
2.温度相同、浓度均为0.2 mol·L-1的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、⑤Na2CO3、⑥CH3COONa溶液,它们的pH由小到大的顺序为
A.③①④②⑥⑤ B.①③⑥④②⑤
C.③②①⑥④⑤ D.②④①③⑤⑥
√
自我测试
1
2
3
4
5
酸性
强酸性
中性
酸性
碱性
碱性
3.物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是
A.HX、HZ、HY B.HX、HY、HZ
C.HZ、HY、HX D.HY、HZ、HX
自我测试
1
2
3
√
4
5
越弱越水解
4.室温下,在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-浓度分别为a mol·L-1与b mol·L-1,则a和b关系为
A.a>b B.a=10-4b C.b=10-4a D.a=b
自我测试
1
2
3
4
√
5
5.盐是一类常见的电解质,事实表明盐溶液不一定呈中性。
(1)CH3COONa、NH4Cl、KNO3的水溶液分别呈 性、 性、
性。
自我测试
1
2
3
4
碱
酸
中
5
(2)盐中阴、阳离子的水解使盐溶液呈现的酸碱性不同,盐水解的离
子方程式也不同,如CH3COONa和NH4Cl水解的离子方程式分别为
、 。
(3)氯化铝水溶液呈 性,原因是 (用离子方程式表示)。
酸
盐类水解的原理
第1课时
专题3 水溶液中的离子反应
第三单元 盐类的水解
1.通过实验探究盐溶液的酸碱性,掌握盐的类型与其溶液酸碱性的关系。
2.能分析盐溶液呈现不同酸碱性的原因,掌握盐类水解的原理及盐溶液呈现不同酸碱性的规律。
3.理解盐类水解的概念,认识盐类水解有一定限度,能正确书写盐类水解的 离子方程式和化学方程式。
1.盐类水解的实质和规律。
2.盐类水解的离子方程式的书写。
[学习目标]
[重点难点]
新课导入
1.Na2CO3俗称纯碱,经常用于面食制作和油污清洗等,明明是盐,为什么叫纯碱?
Na2CO3溶液呈碱性
盐溶液可能呈中性、酸性、也可能呈碱性
2.酸溶液呈酸性,碱溶液呈碱性,那么盐溶液呢?一定呈中性吗?
3.盐溶液的酸碱性与盐的类型之间有什么关系?
探究讨论
酸
强酸
弱酸
弱碱
强碱
碱
酸+碱 ===盐+水 (中和反应)
根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?
盐的类型
实例
强酸强碱盐
强酸弱碱盐
强碱弱酸盐
弱酸弱碱盐
NaCl、KNO3
NH4Cl、FeCl3
CH3COONa、Na2CO3
CH3COONH4、(NH4)2CO3
如何测定以上盐溶液的酸碱性?
1.探究盐溶液的酸碱性
目标一 盐溶液的酸碱性及原因
实验室测定溶液pH可用
测定溶液的pH值
pH试纸法
酸碱指示剂法
pH计法
盐溶液 盐的类型 溶液pH 酸碱性
NaCl pH 7
CH3COONa pH 7
NH4Cl pH 7
Na2CO3 pH 7
AlCl3 pH 7
实验结论:“谁强显谁性,同强显中性”。
强酸强碱盐
=
中性
强碱弱酸盐
强酸弱碱盐
强碱弱酸盐
强酸弱碱盐
碱性
酸性
碱性
酸性
>
<
>
<
c(H+) = c(OH-)
溶液呈中性
NaCl电离产生的Na+ 和Cl– 均不能与水电离产生的H+ 和 OH– 相互作用生成弱电解质。
即加NaCl后不影响水的电离平衡。
不结合
不结合
NaCl Cl– + Na+
H2O H+ + OH–
溶质
溶剂
物质
存在的离子及互相作用
水的电离平衡移动
宏观现象
任务3 模型应用,分析氯化钠溶液中性原因
溶剂
溶质
物质
存在的离子
平衡移动
宏观现象
相互反应
c(H+) c(OH-)
NH4Cl = Cl- + NH4+
H2O H+ + OH-
+
NH3·H2O
>
溶液呈酸性
任务2 建构模型,分析氯化铵溶液显酸性原因
NH4Cl电离产生的NH4+ 与水电离产生 OH– 相互作用生成NH3·H2O。
溶剂
溶质
物质
存在的离子
平衡移动
宏观现象
相互反应
CH3COONa
H2O
CH3COO-
Na+ +
H+
OH- +
+
CH3COOH
c(H+) c(OH-)
<
溶液呈碱性
任务3 模型应用,分析醋酸钠溶液显碱性的原因
CH3COONa电离的CH3COO-与水电离的 H+相互作用生成CH3COOH。
【模型总结】盐溶液表现出不同的酸碱性的根本原因
溶质
溶剂
物质
存在的离子及互相作用
水的电离平衡移动
宏观现象
H2O H+ + OH–
盐 === 阴离子 + 阳离子
+
+
生成弱电解质
促进水的电离
c(H+)≠ c(OH-)
实质
1.定义:
在溶液中盐电离出来的离子与水所电离出来的H+或OH-结合生成弱电解质(弱酸或弱碱)的反应
3.盐类的水解
定义:盐在水溶液中电离出的离子与水电离出的H+或OH-结合生成弱电解质的反应。
条件
条件:盐易溶,且有弱离子
实质:促进水的电离
水解反应是可逆反应
可逆
吸热
微弱
分步
水解反应可以看成酸碱中和反应的逆过程,是吸热反应
水解反应程度很微弱
多元弱酸的酸根水解是分步进行的,但以第一步为主
特点
4.盐类水解的规律
强酸弱碱盐
强碱弱酸盐
弱酸弱碱盐
强酸强碱盐
pH<7
pH>7
pH=7
越弱越水解
谁弱谁水解,都弱都水解
无弱不水解
同强显中性
谁强显谁性
常见的“弱”离子
目标二 盐类水解方程式的书写
盐的类型 实例 水解的离子方程式
一元弱酸盐/弱碱盐 NaClO
(NH4)2SO4
谁弱写谁
盐类的水解可以看作酸碱中和反应的逆过程。
盐的类型 实例 水解的离子方程式
多元弱酸盐 Na2CO3
2. 多元弱酸,其酸根离子的水解是分步进行的,以第一步为主。
3. 多元弱碱阳离子水解反应过程复杂,要求一步写到底。
盐的类型 实例 水解的离子方程式
多元弱碱盐 AlCl3
Al3++3H2O Al(OH)3+3H+
4. 弱酸弱碱盐中阴、阳离子水解相互促进。
1.下列有水参与的反应属于盐类水解反应的是
√
导练
化合反应
为H3BO3的电离方程式
2.写下列物质发生水解反应的离子方程式,并指明水溶液的酸碱性:
Na2S:_____________________________________________________。
CuSO4:_________________________________。
CH3COONa:_________________________________________。
Fe2(SO4)3:_________________________________。
NH4NO3:________________________________。
1.正误判断
(1)酸式盐溶液可能呈酸性,也可能呈碱性( )
(2)某盐溶液呈酸性,该盐一定发生了水解反应( )
(3)常温下,pH=10的CH3COONa溶液与pH=4的NH4Cl溶液,水的电离程度相同( )
√
×
√
导思
酸式盐要根据电离和水解程度分析溶液的酸碱性。
强酸的酸式盐(如NaHSO4)只电离,不水解,溶液呈酸性
2.室温下,测得等浓度的CH3COONa和NaClO的pH,发现NaClO溶液的pH大,试分析原因。
3.实验测得常温下NaHCO3溶液的pH>7,请从电离和水解两方面分析NaHCO3溶液呈碱性的原因
提示 因为酸性:CH3COOH>HClO,故ClO-在溶液中的水解能力较强,因此NaClO溶液的pH大。
提示
水解>电离
多元弱酸的酸式盐即水解又电离
水解>电离 显碱性:NaHCO3 NaHS Na2HPO4
电离>水解 显酸性: NaHSO3 NaHC2O4 NaH2PO4
4.常温下,Ka(CH3COOH)=1.8×10-5,Kb(NH3·H2O)=1.8×10-5,解释CH3COONH4溶液呈中性的原因。
1.有下列盐溶液:
①KNO3 ②CuSO4 ③K2CO3 ④FeCl3 ⑤K2SO4 ⑥NaClO ⑦NH4Cl ⑧AgNO3
呈酸性的是 (填序号,下同),呈碱性的是 ,呈中性的是 。
导练
②④⑦⑧
③⑥
①⑤
CuSO4、AgNO3、FeCl3、NH4Cl属于强酸弱碱盐,溶液呈酸性;
K2CO3、NaClO属于强碱弱酸盐,溶液呈碱性;
KNO3、K2SO4属于强酸强碱盐,溶液呈中性。
2.等物质的量浓度的下列物质的溶液,其pH由小到大的顺序是_____________
(填序号)。
①CH3COONa ②NaOH ③NaNO3 ④HCl
⑤Al2(SO4)3 ⑥CH3COOH
④⑥⑤③①②
强酸
强碱
中性
弱酸
碱性
酸性
3.常温下,某浓度的NH4Cl溶液的pH为4,回答下列问题:
(1)该NH4Cl溶液中含氮元素的微粒有 。
(2)该NH4Cl溶液中c水(H+)与pH=4的盐酸中c水(H+)比值为 。
106
pH=4的NH4Cl溶液中水电离的c水(H+)=10-4 mol·L-1
pH=4的盐酸中水电离的c水(H+)=10-10 mol·L-1
1.下列有关盐类水解的说法不正确的是
A.盐类的水解过程破坏了纯水的电离平衡
B.盐类的水解是酸碱中和反应的逆过程
C.盐类水解的结果使溶液一定不呈中性
1
2
3
自我测试
4
√
5
谁强显谁性,同强显中性
2.温度相同、浓度均为0.2 mol·L-1的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、⑤Na2CO3、⑥CH3COONa溶液,它们的pH由小到大的顺序为
A.③①④②⑥⑤ B.①③⑥④②⑤
C.③②①⑥④⑤ D.②④①③⑤⑥
√
自我测试
1
2
3
4
5
酸性
强酸性
中性
酸性
碱性
碱性
3.物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是
A.HX、HZ、HY B.HX、HY、HZ
C.HZ、HY、HX D.HY、HZ、HX
自我测试
1
2
3
√
4
5
越弱越水解
4.室温下,在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-浓度分别为a mol·L-1与b mol·L-1,则a和b关系为
A.a>b B.a=10-4b C.b=10-4a D.a=b
自我测试
1
2
3
4
√
5
5.盐是一类常见的电解质,事实表明盐溶液不一定呈中性。
(1)CH3COONa、NH4Cl、KNO3的水溶液分别呈 性、 性、
性。
自我测试
1
2
3
4
碱
酸
中
5
(2)盐中阴、阳离子的水解使盐溶液呈现的酸碱性不同,盐水解的离
子方程式也不同,如CH3COONa和NH4Cl水解的离子方程式分别为
、 。
(3)氯化铝水溶液呈 性,原因是 (用离子方程式表示)。
酸
