苏教版高中化学选择性必修1专题3第四单元沉淀溶解平衡3.4.2沉淀溶解平衡原理的应用课件(共27张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修1专题3第四单元沉淀溶解平衡3.4.2沉淀溶解平衡原理的应用课件(共27张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-21 18:13:23 | ||
图片预览








文档简介
(共27张PPT)
专题3 水溶液中的离子反应
沉淀溶解平衡原理的应用
第2课时
第四单元 沉淀溶解平衡
1、1、能用平衡移动原理分析理解沉淀的溶解与生成、沉淀转化的实质。
2、学会用沉淀溶解平衡的移动解决生产、生活中的实际问题,并设计实验探究方案,进行沉淀转化等实验探究。能用平衡移动原理分析理解沉淀的溶解与生成、沉淀转化的实质。
2、学会用沉淀溶解平衡的移动解决生产、生活中的实际问题,并设计实验探究方案,进行沉淀转化等实验探究。
核心素养目标:
1、通过锅炉除水垢了解沉淀的溶解与沉淀转化,能用平衡移动原理解释
沉淀的溶解与沉淀转化。
2、学会通过比较Q与Ksp的大小,从定量的角度分析沉淀的溶解与沉淀转化。
3.能用平衡移动原理解释解决生产、生活中的实际问题。
锅炉水垢既会降低燃料的利用率,造成能源浪费,也会影响锅炉的使用寿命,还存在安全隐患,因此要定期除去锅炉水垢。
任务一:探究锅炉除水垢
1.水垢中含有Mg(OH)2 ,CaSO4,CaCO3等除去水垢的方法有酸洗,即有盐酸浸泡。请运用沉淀溶解平衡 解释稀盐酸除Mg(OH)2 和CaCO3 原理。
Mg(OH)2 (s) Mg2+ (aq) + 2OH- (aq)
寻找核心物质:
寻找平衡:
Mg(OH)2 ,CaCO3,HCl
平衡向溶解的方向
移动
Mg(OH)2
溶解
加
盐酸
Q < Ksp
消耗
OH-
c(OH- )
减小
任务一:探究锅炉水垢
分析
加入盐酸对于Mg(OH)2 (s) Mg2+ (aq) + 2OH- (aq)的影响。
HCl == Cl- + H+
+
H2O
2.除去CaSO4水垢需要另一种方法:碱洗。即用Na2CO3溶液浸泡一段时间。再辅以“酸洗”,可除去CaSO4。
①请运用沉淀溶解平衡的原理解释原因
②写出除去水垢中的CaSO4的化学方程式和离子方程式。
核心物质:
寻找平衡:
任务一:探究锅炉除水垢
思考:稀盐酸能除去CaSO4吗?
CaSO4、Na2CO3、HCl
CaSO4(s) SO42- (aq) + Ca2+ (aq)
CaSO4(s) SO42- (aq) + Ca2+ (aq)的影响
CO32-
+
CaCO3(s)
CaSO4(s)+CO32- CaCO3(s)+SO42-;
离子方程式:
锅炉除垢
CaSO4(s)转化为CaCO3(s)即沉淀的转化
加入Na2CO3溶液对
任务一:探究锅炉除水垢
Ksp(CaSO4)=4.9×10-5
Ksp(CaCO3)=3.4×10-9
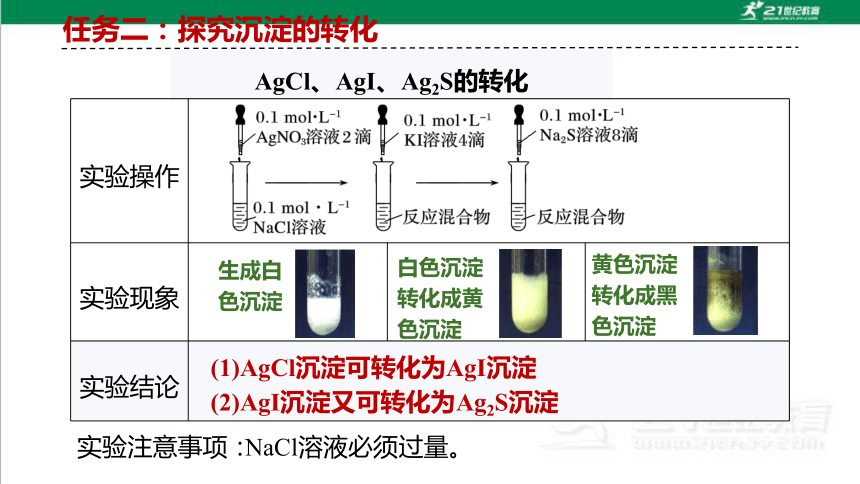
任务二:探究沉淀的转化
AgCl、AgI、Ag2S的转化
实验操作
实验现象
实验结论
生成白色沉淀
白色沉淀
转化成黄色沉淀
黄色沉淀
转化成黑色沉淀
(2)AgI沉淀又可转化为Ag2S沉淀
(1)AgCl沉淀可转化为AgI沉淀
任务二:探究沉淀的转化
实验注意事项:
NaCl溶液必须过量。
已知在20 ℃时,AgCl、 AgI、 Ag2S在水中的溶解度分别为1.5×10-4 g、2.1× 10-7 g、6.3×10-16 g,你能根据它们溶解能力的差异分析上述现象产生的原因吗 请以AgCl沉淀转化为AgI沉淀为例进行说明。
白色沉淀转化为黄色沉淀
AgCl(s) Ag+(aq) + Cl- (aq)
AgI(s)
任务二:探究沉淀的转化
分析:
滴加一定浓度的KI时,使得Q(AgI)>Ksp(AgI),故会生成AgI沉淀;c(Ag+ )减小,导致AgCl的溶解平衡向溶解的方向移动。
KI + K+
Na2S S2- + 2Na+
2AgI(s) 2Ag+(aq) + 2I-(aq)
+
Ag2S(s)
2AgI(s)+S2- Ag2S(s)+2I-;
沉淀转化的离子方程式:
任务二:探究沉淀的转化
现象:黄色沉淀转化为黑色沉淀
1.沉淀转化的离子方程式:
;
。
2.沉淀转化的实质: 。
3.沉淀转化的条件:溶液中的离子浓度幂之积 Ksp。
(1)一般是 的物质容易转化成 的物质。两种物质的溶解能力差别越大,沉淀转化越容易。
(2)在特殊情况下,控制反应的条件,也能使 的物质转化为 的物质。
沉淀溶解平衡的移动
大于
溶解能力相对较强
溶解能力相对较弱
溶解能力相对较弱
溶解能力相对较强
小结:
任务三:沉淀转化的应用
CuS(铜蓝)
原生铜的硫化物
氧化
淋滤
CuSO4(溶液)
ZnS闪锌矿
PbS方铅矿
问题:请运用沉淀溶解平衡的原理解释原因。
应用1
ZnS(s) Zn2+ + S2-
+
CuS(s)
CuSO4 = SO42- + Cu2+
PbS(s) Pb2+ + S2-
CuSO4 = SO42- + Cu2+
+
CuS(s)
任务三:沉淀转化的应用
铜蓝矿的形成过程
在铜蓝矿的形成过程中,实质上就是沉淀的转化过程。
生成铜蓝的有关化学方程式:
ZnS(s)+CuSO4? CuS(s)+ZnSO4
PbS(s)+CuSO4? CuS(s)+PbSO4
应用1
牙齿表面由一层硬的组成为Ca5(PO4)3(OH)的物质保护着,
它在唾液中存在下列平衡:
阅读生活向导:龋齿的形成
问题:①请运用沉淀溶解的原理解释龋齿原因。
应用2
龋齿的成因可能是食物在口腔细菌和酶的作用下产生的有机酸(例如糖类分解产生的乳酸)穿透牙釉质表面,使牙齿表面的矿物质羟基磷灰石[Ca5(PO4)3(OH)]溶解。由于细菌在牙齿表面形成一层黏膜——齿斑(或称菌斑),有机酸能够长时间与牙齿表面密切接触,羟基磷灰石持续溶解,最终形成龋齿。
氟磷灰石比羟基磷灰石更能抵抗酸的侵蚀,并且氟离子还能抑制口腔细菌产生有机酸。含氟牙膏的使用显著降低了龋齿的发生率,使人们的牙齿更健康。
已知Ca5(PO4)3F的Ksp=2.8×10-61,比Ca5(PO4)3(OH) 更坚固。
问题:②含氟牙膏的使用显著降低了龋齿的发生率的原因。
Ca5(PO4)3(OH)(s)+F- Ca5(PO4)3F(s)+OH-
应用2
牙膏中的氟化物还有氟化钠(NaF)和氟化锶(SrF2)单氟磷酸钠(Na2PO3F)等。
任务三:沉淀转化的应用
重晶石(主要成分是BaSO4)是制备钡化合物的重要原料,但是BaSO4不溶于水也不溶于酸、碱,难以直接利用。
思路:在分析化学中常常先将难溶强酸盐转化为难溶弱酸盐,然后用酸溶解,使阳离子进入溶液。
应用3
任务三:沉淀转化的应用
重晶石
(主要成分:BaSO4)
多次重复
饱和Na2CO3溶液
BaCO3(s)
盐酸
Ba2+(aq)
转化过程:用饱和Na2CO3溶液处理BaSO4沉淀,一段时间后移走上层溶液;再加入饱和Na2CO3溶液,重复处理多次,可使大部分BaSO4转化为BaCO3,最后加入盐酸,Ba2+便转入到溶液中。
任务三:沉淀转化的应用
问题:请运用沉淀溶解平衡的原理解释。
Na2CO3 CO32- + 2Na+
BaSO4(s) Ba2+(aq) + SO42-(aq)
+
BaCO3(s)
BaSO4(s)+CO32- BaCO3(s)+SO42-;
沉淀转化的离子方程式:
加酸溶解离子方程式为
BaCO3(s)+
2H+===Ba2++H2O+CO2↑
Ksp(BaSO4)=1.1×10-10
Ksp(BaCO3)=2.59×10-9
BaSO4(s)+CO32- BaCO3(s)+SO42-
问题:写出该反应的化学平衡常数表达式并计算。
总结:可以通过加大CO32-浓度的方法,多次转化。
任务三:沉淀转化的应用
由于Fe(OH)3的溶解度比Cu(OH)2小得多,调节溶液的 pH至3~4时,Cu2+留在溶液中, Fe3+水解生成Fe(OH)3而析出,达到除去Fe3+的目的。
物质的提纯——除去CuSO4溶液中混有的少量Fe3+
应用4
0.10 mol·L-1 Cu2+和0.010 mol·L-1 Fe3+混合溶液,计算使 Fe3+开始沉淀及沉淀完全时的pH。
(Ksp[Fe(OH)3]=2.6×10-39,Ksp[Cu(OH)2]=2.2×10-20)
Fe(OH)3(s) Fe3++3OH-,
Fe3+开始沉淀时,c(Fe3+)=0.010 mol·L-1,
c(OH-)≈6.4×10-13 mol·L-1,pOH≈12.2,pH=1.8;
Fe3+完全沉淀时,c(Fe3+)=1.0×10-5 mol·L-1,
c(OH-)≥6.4×10-12 mol·L-1,pH=2.8。
此时:Cu2+还未开始沉淀
BaSO4(s) Ba2+(aq) + SO42-(aq)
增大c(SO42-),使Qc>Ksp以产生BaSO4沉淀。
1.遇到不慎误食可溶性钡盐造成中毒的病人,应尽快用5.0%硫酸钠溶液给患者洗胃,为什么 提示:胃里有:盐酸
交流讨论
BaSO4沉淀溶解平衡向沉淀生成的方向移动
所以选用5.0% 的Na2SO4溶液可以给钡中毒的患者洗胃。
2.能否用碳酸钠稀溶液代替硫酸钠溶液给患者洗胃?为什么?
不能,胃里有:盐酸
CO2↑+H2O
===
Q < Ksp
BaCO3沉淀溶解平衡向沉淀溶解的方向移动,Ba2+进入人体导致中毒。
交流讨论
CO32-减小
延时符
课堂小结
应用
沉淀的生成
沉淀溶解平衡
沉淀的溶解
沉淀的转化
核心物质
寻找平衡
比较Q、Ksp
改变条件
向沉淀
生成方向
进行
向沉淀
溶解方向
进行
1.当氢氧化镁固体在水中达到沉淀溶解平衡Mg(OH)2(s) Mg2++2OH-时,为使Mg(OH)2固体的量减少,需加入少量的
A.NH4NO3 B.NaOH
C.MgSO4 D.Na2SO4
√
要使Mg(OH)2固体的量减小,应使Mg(OH)2的沉淀溶解平衡右移,可减小c(Mg2+)或c(OH-)。NH4NO3电离出的 能结合OH-,使平衡右移。
课堂练习
2.某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,为了除去FeCl3杂质,需将溶液调至pH=4。在调节溶液pH时,应选用的试剂是
A.NaOH B.ZnO
C.ZnSO4 D.Fe2O3
√
溶液中含有FeCl3杂质,将溶液调至pH=4,可使Fe3+水解生成Fe(OH)3沉淀而除去,注意不能引入新的杂质,可加入ZnO和酸反应调节溶液pH,使铁离子全部沉淀。
3.下列叙述不正确的是
A.向AgCl的白色悬浊液中加入0.1 mol·L-1 KI溶液,有黄色沉淀产生
B.25 ℃时,AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度相同
C.25 ℃,AgCl固体在等物质的量浓度NaCl、CaCl2溶液中的溶度积相同
D.在5 mL 1.8×10-6 mol·L-1 NaCl溶液中,加入1滴(20滴约为1 mL)1×
10-3 mol·L-1 AgNO3溶液,不能产生白色沉淀
√
物质 AgCl AgBr AgI Ag2S
颜色 白 淡黄 黄 黑
Ksp 1.8×10-10 5.4×10-13 8.5×10-17 1.8×10-50
专题3 水溶液中的离子反应
沉淀溶解平衡原理的应用
第2课时
第四单元 沉淀溶解平衡
1、1、能用平衡移动原理分析理解沉淀的溶解与生成、沉淀转化的实质。
2、学会用沉淀溶解平衡的移动解决生产、生活中的实际问题,并设计实验探究方案,进行沉淀转化等实验探究。能用平衡移动原理分析理解沉淀的溶解与生成、沉淀转化的实质。
2、学会用沉淀溶解平衡的移动解决生产、生活中的实际问题,并设计实验探究方案,进行沉淀转化等实验探究。
核心素养目标:
1、通过锅炉除水垢了解沉淀的溶解与沉淀转化,能用平衡移动原理解释
沉淀的溶解与沉淀转化。
2、学会通过比较Q与Ksp的大小,从定量的角度分析沉淀的溶解与沉淀转化。
3.能用平衡移动原理解释解决生产、生活中的实际问题。
锅炉水垢既会降低燃料的利用率,造成能源浪费,也会影响锅炉的使用寿命,还存在安全隐患,因此要定期除去锅炉水垢。
任务一:探究锅炉除水垢
1.水垢中含有Mg(OH)2 ,CaSO4,CaCO3等除去水垢的方法有酸洗,即有盐酸浸泡。请运用沉淀溶解平衡 解释稀盐酸除Mg(OH)2 和CaCO3 原理。
Mg(OH)2 (s) Mg2+ (aq) + 2OH- (aq)
寻找核心物质:
寻找平衡:
Mg(OH)2 ,CaCO3,HCl
平衡向溶解的方向
移动
Mg(OH)2
溶解
加
盐酸
Q < Ksp
消耗
OH-
c(OH- )
减小
任务一:探究锅炉水垢
分析
加入盐酸对于Mg(OH)2 (s) Mg2+ (aq) + 2OH- (aq)的影响。
HCl == Cl- + H+
+
H2O
2.除去CaSO4水垢需要另一种方法:碱洗。即用Na2CO3溶液浸泡一段时间。再辅以“酸洗”,可除去CaSO4。
①请运用沉淀溶解平衡的原理解释原因
②写出除去水垢中的CaSO4的化学方程式和离子方程式。
核心物质:
寻找平衡:
任务一:探究锅炉除水垢
思考:稀盐酸能除去CaSO4吗?
CaSO4、Na2CO3、HCl
CaSO4(s) SO42- (aq) + Ca2+ (aq)
CaSO4(s) SO42- (aq) + Ca2+ (aq)的影响
CO32-
+
CaCO3(s)
CaSO4(s)+CO32- CaCO3(s)+SO42-;
离子方程式:
锅炉除垢
CaSO4(s)转化为CaCO3(s)即沉淀的转化
加入Na2CO3溶液对
任务一:探究锅炉除水垢
Ksp(CaSO4)=4.9×10-5
Ksp(CaCO3)=3.4×10-9
任务二:探究沉淀的转化
AgCl、AgI、Ag2S的转化
实验操作
实验现象
实验结论
生成白色沉淀
白色沉淀
转化成黄色沉淀
黄色沉淀
转化成黑色沉淀
(2)AgI沉淀又可转化为Ag2S沉淀
(1)AgCl沉淀可转化为AgI沉淀
任务二:探究沉淀的转化
实验注意事项:
NaCl溶液必须过量。
已知在20 ℃时,AgCl、 AgI、 Ag2S在水中的溶解度分别为1.5×10-4 g、2.1× 10-7 g、6.3×10-16 g,你能根据它们溶解能力的差异分析上述现象产生的原因吗 请以AgCl沉淀转化为AgI沉淀为例进行说明。
白色沉淀转化为黄色沉淀
AgCl(s) Ag+(aq) + Cl- (aq)
AgI(s)
任务二:探究沉淀的转化
分析:
滴加一定浓度的KI时,使得Q(AgI)>Ksp(AgI),故会生成AgI沉淀;c(Ag+ )减小,导致AgCl的溶解平衡向溶解的方向移动。
KI + K+
Na2S S2- + 2Na+
2AgI(s) 2Ag+(aq) + 2I-(aq)
+
Ag2S(s)
2AgI(s)+S2- Ag2S(s)+2I-;
沉淀转化的离子方程式:
任务二:探究沉淀的转化
现象:黄色沉淀转化为黑色沉淀
1.沉淀转化的离子方程式:
;
。
2.沉淀转化的实质: 。
3.沉淀转化的条件:溶液中的离子浓度幂之积 Ksp。
(1)一般是 的物质容易转化成 的物质。两种物质的溶解能力差别越大,沉淀转化越容易。
(2)在特殊情况下,控制反应的条件,也能使 的物质转化为 的物质。
沉淀溶解平衡的移动
大于
溶解能力相对较强
溶解能力相对较弱
溶解能力相对较弱
溶解能力相对较强
小结:
任务三:沉淀转化的应用
CuS(铜蓝)
原生铜的硫化物
氧化
淋滤
CuSO4(溶液)
ZnS闪锌矿
PbS方铅矿
问题:请运用沉淀溶解平衡的原理解释原因。
应用1
ZnS(s) Zn2+ + S2-
+
CuS(s)
CuSO4 = SO42- + Cu2+
PbS(s) Pb2+ + S2-
CuSO4 = SO42- + Cu2+
+
CuS(s)
任务三:沉淀转化的应用
铜蓝矿的形成过程
在铜蓝矿的形成过程中,实质上就是沉淀的转化过程。
生成铜蓝的有关化学方程式:
ZnS(s)+CuSO4? CuS(s)+ZnSO4
PbS(s)+CuSO4? CuS(s)+PbSO4
应用1
牙齿表面由一层硬的组成为Ca5(PO4)3(OH)的物质保护着,
它在唾液中存在下列平衡:
阅读生活向导:龋齿的形成
问题:①请运用沉淀溶解的原理解释龋齿原因。
应用2
龋齿的成因可能是食物在口腔细菌和酶的作用下产生的有机酸(例如糖类分解产生的乳酸)穿透牙釉质表面,使牙齿表面的矿物质羟基磷灰石[Ca5(PO4)3(OH)]溶解。由于细菌在牙齿表面形成一层黏膜——齿斑(或称菌斑),有机酸能够长时间与牙齿表面密切接触,羟基磷灰石持续溶解,最终形成龋齿。
氟磷灰石比羟基磷灰石更能抵抗酸的侵蚀,并且氟离子还能抑制口腔细菌产生有机酸。含氟牙膏的使用显著降低了龋齿的发生率,使人们的牙齿更健康。
已知Ca5(PO4)3F的Ksp=2.8×10-61,比Ca5(PO4)3(OH) 更坚固。
问题:②含氟牙膏的使用显著降低了龋齿的发生率的原因。
Ca5(PO4)3(OH)(s)+F- Ca5(PO4)3F(s)+OH-
应用2
牙膏中的氟化物还有氟化钠(NaF)和氟化锶(SrF2)单氟磷酸钠(Na2PO3F)等。
任务三:沉淀转化的应用
重晶石(主要成分是BaSO4)是制备钡化合物的重要原料,但是BaSO4不溶于水也不溶于酸、碱,难以直接利用。
思路:在分析化学中常常先将难溶强酸盐转化为难溶弱酸盐,然后用酸溶解,使阳离子进入溶液。
应用3
任务三:沉淀转化的应用
重晶石
(主要成分:BaSO4)
多次重复
饱和Na2CO3溶液
BaCO3(s)
盐酸
Ba2+(aq)
转化过程:用饱和Na2CO3溶液处理BaSO4沉淀,一段时间后移走上层溶液;再加入饱和Na2CO3溶液,重复处理多次,可使大部分BaSO4转化为BaCO3,最后加入盐酸,Ba2+便转入到溶液中。
任务三:沉淀转化的应用
问题:请运用沉淀溶解平衡的原理解释。
Na2CO3 CO32- + 2Na+
BaSO4(s) Ba2+(aq) + SO42-(aq)
+
BaCO3(s)
BaSO4(s)+CO32- BaCO3(s)+SO42-;
沉淀转化的离子方程式:
加酸溶解离子方程式为
BaCO3(s)+
2H+===Ba2++H2O+CO2↑
Ksp(BaSO4)=1.1×10-10
Ksp(BaCO3)=2.59×10-9
BaSO4(s)+CO32- BaCO3(s)+SO42-
问题:写出该反应的化学平衡常数表达式并计算。
总结:可以通过加大CO32-浓度的方法,多次转化。
任务三:沉淀转化的应用
由于Fe(OH)3的溶解度比Cu(OH)2小得多,调节溶液的 pH至3~4时,Cu2+留在溶液中, Fe3+水解生成Fe(OH)3而析出,达到除去Fe3+的目的。
物质的提纯——除去CuSO4溶液中混有的少量Fe3+
应用4
0.10 mol·L-1 Cu2+和0.010 mol·L-1 Fe3+混合溶液,计算使 Fe3+开始沉淀及沉淀完全时的pH。
(Ksp[Fe(OH)3]=2.6×10-39,Ksp[Cu(OH)2]=2.2×10-20)
Fe(OH)3(s) Fe3++3OH-,
Fe3+开始沉淀时,c(Fe3+)=0.010 mol·L-1,
c(OH-)≈6.4×10-13 mol·L-1,pOH≈12.2,pH=1.8;
Fe3+完全沉淀时,c(Fe3+)=1.0×10-5 mol·L-1,
c(OH-)≥6.4×10-12 mol·L-1,pH=2.8。
此时:Cu2+还未开始沉淀
BaSO4(s) Ba2+(aq) + SO42-(aq)
增大c(SO42-),使Qc>Ksp以产生BaSO4沉淀。
1.遇到不慎误食可溶性钡盐造成中毒的病人,应尽快用5.0%硫酸钠溶液给患者洗胃,为什么 提示:胃里有:盐酸
交流讨论
BaSO4沉淀溶解平衡向沉淀生成的方向移动
所以选用5.0% 的Na2SO4溶液可以给钡中毒的患者洗胃。
2.能否用碳酸钠稀溶液代替硫酸钠溶液给患者洗胃?为什么?
不能,胃里有:盐酸
CO2↑+H2O
===
Q < Ksp
BaCO3沉淀溶解平衡向沉淀溶解的方向移动,Ba2+进入人体导致中毒。
交流讨论
CO32-减小
延时符
课堂小结
应用
沉淀的生成
沉淀溶解平衡
沉淀的溶解
沉淀的转化
核心物质
寻找平衡
比较Q、Ksp
改变条件
向沉淀
生成方向
进行
向沉淀
溶解方向
进行
1.当氢氧化镁固体在水中达到沉淀溶解平衡Mg(OH)2(s) Mg2++2OH-时,为使Mg(OH)2固体的量减少,需加入少量的
A.NH4NO3 B.NaOH
C.MgSO4 D.Na2SO4
√
要使Mg(OH)2固体的量减小,应使Mg(OH)2的沉淀溶解平衡右移,可减小c(Mg2+)或c(OH-)。NH4NO3电离出的 能结合OH-,使平衡右移。
课堂练习
2.某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,为了除去FeCl3杂质,需将溶液调至pH=4。在调节溶液pH时,应选用的试剂是
A.NaOH B.ZnO
C.ZnSO4 D.Fe2O3
√
溶液中含有FeCl3杂质,将溶液调至pH=4,可使Fe3+水解生成Fe(OH)3沉淀而除去,注意不能引入新的杂质,可加入ZnO和酸反应调节溶液pH,使铁离子全部沉淀。
3.下列叙述不正确的是
A.向AgCl的白色悬浊液中加入0.1 mol·L-1 KI溶液,有黄色沉淀产生
B.25 ℃时,AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度相同
C.25 ℃,AgCl固体在等物质的量浓度NaCl、CaCl2溶液中的溶度积相同
D.在5 mL 1.8×10-6 mol·L-1 NaCl溶液中,加入1滴(20滴约为1 mL)1×
10-3 mol·L-1 AgNO3溶液,不能产生白色沉淀
√
物质 AgCl AgBr AgI Ag2S
颜色 白 淡黄 黄 黑
Ksp 1.8×10-10 5.4×10-13 8.5×10-17 1.8×10-50
