苏教版高中化学选择性必修1专题1化学反应与能量变化第一单元化学反应的热效应第2课时反应热的测量与计算课件
文档属性
| 名称 | 苏教版高中化学选择性必修1专题1化学反应与能量变化第一单元化学反应的热效应第2课时反应热的测量与计算课件 |

|
|
| 格式 | ppt | ||
| 文件大小 | 9.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-21 18:23:08 | ||
图片预览











文档简介
(共53张PPT)
第2课时 反应热的测量与计算
1.理解反应热测定的原理和方法,会分析产生误差的原因,不断完善和改
进测定方法。
2.构建盖斯定律模型,理解盖斯定律的本质,形成运用盖斯定律进行相关
判断或计算的思维模型。
2.实验装置
(1)简易量热计的构造
量热计中各仪器的作用为①环形玻璃搅拌棒:
①____________________________;②保温层:②
________________;③温度计:测定反应前后反应
体系的③______。
使反应物混合均匀,充分接触
减少热量的散失
温度
(2)常见其他测量装置
装置中防止热量散失的方法:
①两个烧杯口要相平;
②在两个烧杯之间填充碎泡沫塑料或碎纸片;
③用环形玻璃搅拌棒搅拌,而不能用环形金属
搅拌棒搅拌;
④实验时倒入碱溶液要迅速。
4.实验步骤及测量数据
(3)重复实验操作三次,记录每次的实验数据,取其平均值作为计算依据。
两温度平均值
环形玻璃搅拌棒
最高温度
(1)将酸碱迅速混合后,待温度计读数稳定后记录终止温度( )
×
√
×
×
×
(6)在实验过程中,环形玻璃搅拌棒可用铜制搅拌棒代替( )
×
√
√
简易量热计的隔热层绝
热效果不好,酸、碱溶液混合不迅速(任写一条)
(2)中和反应的反应热测定实验中产生误差的可能原因
①量取溶液的体积有误差。
②温度计的读数有误差。
③混合酸、碱溶液时,动作缓慢,导致实验误差。
④隔热操作不到位,致使实验过程中热量损失而导致误差。
⑤测了酸后的温度计未用水清洗便立即去测碱的温度,会使热量损失而引
起误差。
完全相等
起始状态
最终状态
途径
3.多角度理解盖斯定律
(1)从反应途径的角度理解盖斯定律
__________________ 如同山的高度与上山的途径无关一样,A点相当于反应体系的始
态,B点相当于反应体系的终态,山的高度相当于化学反应的反
应热
(2)从能量守恒的角度理解盖斯定律
__________________________________________________________
放出
吸收
(3)实例
______________________________________________________
从反应途径角度
从能量守恒角度
4.意义:应用盖斯定律可以间接计算出反应速率很小的或不容易直接进行
的或伴有副反应发生的反应的反应热。
(1)虚拟路径法
-110.5
(1)对一个化学反应,如果反应的途径不同,其焓变也可能不同( )
×
(2)化学反应的反应热只与反应体系的始态和终态有关,和反应途径及
条件无关( )
√
(3)可以通过实验直接测定任一反应的反应热 ( )
×
(4)反应热的数值和热化学方程式的化学计量数无关( )
×
×
√
解析:选A。
2.依据图示关系,下列说法不正确的是( )
√
√
4.盖斯定律认为:不管化学反应的过程是一步完成或分多步完成的,整个
过程总的热效应相同。回答下列问题:
D
“四步骤”突破盖斯定律在反应热计算中的应用
03
课堂检测 巩固落实
1.下列说法不正确的是( )
A.应用盖斯定律,可计算某些难以测定的反应的焓变
B.一个化学反应的焓变与反应途径无关
C.在特定条件下,反应热可以等于焓变
D.一个反应一步完成或分几步完成,二者相比,经过的步骤越多,放出的
热量越多
√
解析:选D。A.有些化学反应的焓变难以测定,应用盖斯定律,通过易测
定反应的焓变,可计算某些难以测定的反应的焓变,A说法正确;B.一个
化学反应的焓变只与反应的始态和终态有关,与反应途径无关,B说法正
确;C.在恒压条件下,反应热可以等于焓变,C说法正确;D.一个反应一
步完成或分几步完成,二者相比,经过不同的步骤,反应的焓变是相同的,
D说法错误。
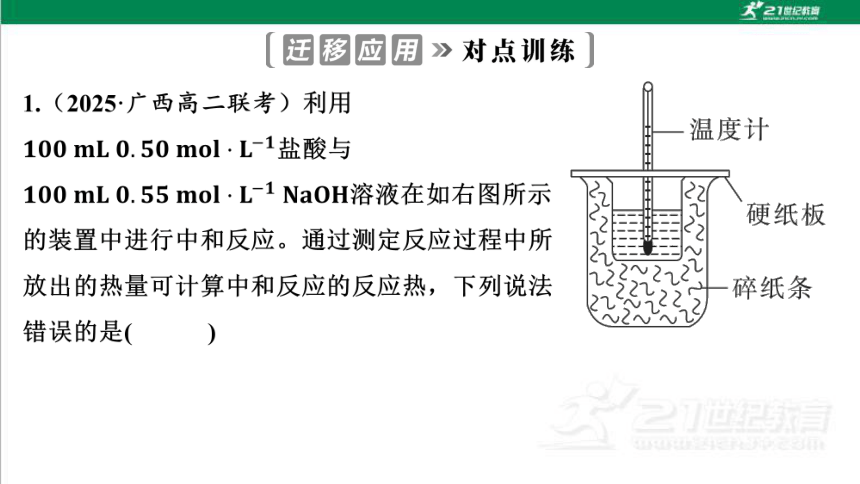
2.实验设计的科学性反映了实验者的科学素养。下列有关测定中和反应反
应热的实验说法正确的是( )
√
√
√
已知:
吸
587.02
第2课时 反应热的测量与计算
1.理解反应热测定的原理和方法,会分析产生误差的原因,不断完善和改
进测定方法。
2.构建盖斯定律模型,理解盖斯定律的本质,形成运用盖斯定律进行相关
判断或计算的思维模型。
2.实验装置
(1)简易量热计的构造
量热计中各仪器的作用为①环形玻璃搅拌棒:
①____________________________;②保温层:②
________________;③温度计:测定反应前后反应
体系的③______。
使反应物混合均匀,充分接触
减少热量的散失
温度
(2)常见其他测量装置
装置中防止热量散失的方法:
①两个烧杯口要相平;
②在两个烧杯之间填充碎泡沫塑料或碎纸片;
③用环形玻璃搅拌棒搅拌,而不能用环形金属
搅拌棒搅拌;
④实验时倒入碱溶液要迅速。
4.实验步骤及测量数据
(3)重复实验操作三次,记录每次的实验数据,取其平均值作为计算依据。
两温度平均值
环形玻璃搅拌棒
最高温度
(1)将酸碱迅速混合后,待温度计读数稳定后记录终止温度( )
×
√
×
×
×
(6)在实验过程中,环形玻璃搅拌棒可用铜制搅拌棒代替( )
×
√
√
简易量热计的隔热层绝
热效果不好,酸、碱溶液混合不迅速(任写一条)
(2)中和反应的反应热测定实验中产生误差的可能原因
①量取溶液的体积有误差。
②温度计的读数有误差。
③混合酸、碱溶液时,动作缓慢,导致实验误差。
④隔热操作不到位,致使实验过程中热量损失而导致误差。
⑤测了酸后的温度计未用水清洗便立即去测碱的温度,会使热量损失而引
起误差。
完全相等
起始状态
最终状态
途径
3.多角度理解盖斯定律
(1)从反应途径的角度理解盖斯定律
__________________ 如同山的高度与上山的途径无关一样,A点相当于反应体系的始
态,B点相当于反应体系的终态,山的高度相当于化学反应的反
应热
(2)从能量守恒的角度理解盖斯定律
__________________________________________________________
放出
吸收
(3)实例
______________________________________________________
从反应途径角度
从能量守恒角度
4.意义:应用盖斯定律可以间接计算出反应速率很小的或不容易直接进行
的或伴有副反应发生的反应的反应热。
(1)虚拟路径法
-110.5
(1)对一个化学反应,如果反应的途径不同,其焓变也可能不同( )
×
(2)化学反应的反应热只与反应体系的始态和终态有关,和反应途径及
条件无关( )
√
(3)可以通过实验直接测定任一反应的反应热 ( )
×
(4)反应热的数值和热化学方程式的化学计量数无关( )
×
×
√
解析:选A。
2.依据图示关系,下列说法不正确的是( )
√
√
4.盖斯定律认为:不管化学反应的过程是一步完成或分多步完成的,整个
过程总的热效应相同。回答下列问题:
D
“四步骤”突破盖斯定律在反应热计算中的应用
03
课堂检测 巩固落实
1.下列说法不正确的是( )
A.应用盖斯定律,可计算某些难以测定的反应的焓变
B.一个化学反应的焓变与反应途径无关
C.在特定条件下,反应热可以等于焓变
D.一个反应一步完成或分几步完成,二者相比,经过的步骤越多,放出的
热量越多
√
解析:选D。A.有些化学反应的焓变难以测定,应用盖斯定律,通过易测
定反应的焓变,可计算某些难以测定的反应的焓变,A说法正确;B.一个
化学反应的焓变只与反应的始态和终态有关,与反应途径无关,B说法正
确;C.在恒压条件下,反应热可以等于焓变,C说法正确;D.一个反应一
步完成或分几步完成,二者相比,经过不同的步骤,反应的焓变是相同的,
D说法错误。
2.实验设计的科学性反映了实验者的科学素养。下列有关测定中和反应反
应热的实验说法正确的是( )
√
√
√
已知:
吸
587.02
