苏教版高中化学选择性必修1专题2化学反应速率与化学平衡第二单元化学反应的方向与限度第2课时化学平衡状态课件(共43张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修1专题2化学反应速率与化学平衡第二单元化学反应的方向与限度第2课时化学平衡状态课件(共43张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 8.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-21 18:40:04 | ||
图片预览









文档简介
(共43张PPT)
第二单元 化学反应的方向与限度
第2课时 化学平衡状态
1.了解化学反应的可逆性,认识化学变化有一定限度。
2.了解化学平衡建立的过程,理解化学平衡的特征。
3.学会平衡状态的判断方法,建立化学平衡状态判断的思维模型。
1.可逆反应
(1)定义:在相同条件下,既能向①________方向进行,同时又能向
②_________方向进行的反应。
(2)表示方法:可逆反应的化学方程式常用“③___”连接,把从左向右进行
的反应称为④________,对应的速率为⑤____,把从右向左进行的反应称为
⑥________,对应的速率为⑦____。
正反应
逆反应
正反应
逆反应
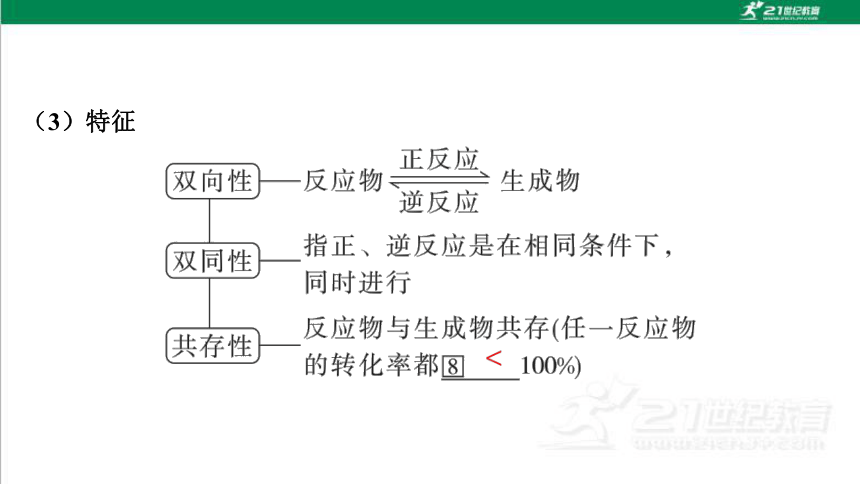
(3)特征
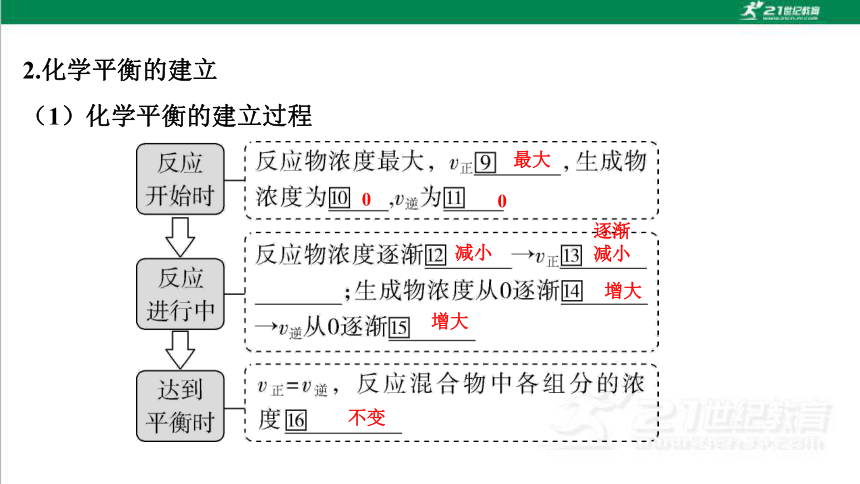
2.化学平衡的建立
(1)化学平衡的建立过程
最大
0
0
减小
逐渐减小
增大
增大
不变
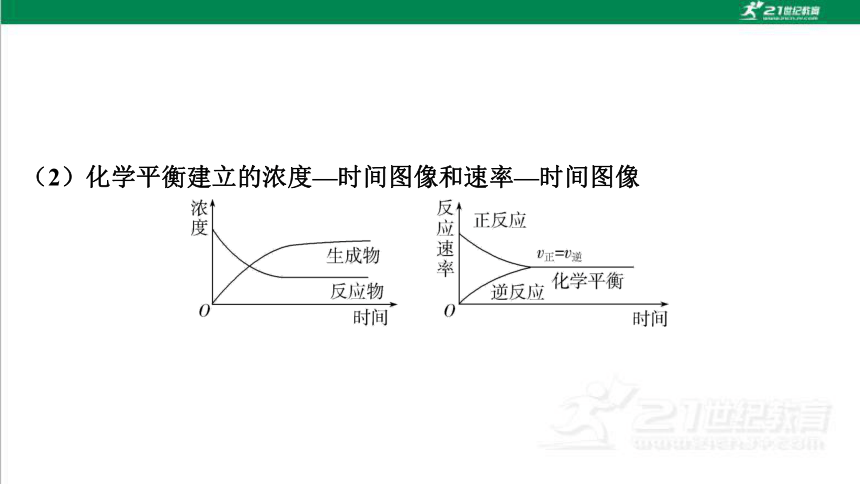
(2)化学平衡建立的浓度—时间图像和速率—时间图像
3.化学平衡状态
(1)概念:当外界条件不变时,可逆反应进行到一定程度,反应物和生
成物的浓度不再随时间而发生变化,我们称之为化学平衡状态。
(2)化学平衡的特征
可逆反应
动态
相等
×
(2)化学平衡状态时,所有物质的速率都相等( )
×
(3)平衡状态是一种静止的状态,反应物和生成物的浓度已经不再改变
( )
×
(4)反应达到化学平衡状态时,反应混合物中各组分的浓度保持不变且
相等( )
×
(5)只有可逆反应才存在平衡状态( )
√
√
√
√
2.利用“变量不变”判断
确定反应中
“变量” 随反应进行而变化的量,当变量不再变化时,表明反应已
达到平衡状态。而当“不变量”不变时,不能判断反应是否
处于平衡状态
把握常见的
“变量” 气体的颜色
对于气体体积有变化的反应,恒压反应中的体积、恒容反
应中的压强
把握常见的
“变量” 对于反应体系中全部为气体,且气体物质的量有变化的反
应,混合气体的平均相对分子质量
对于反应体系中不全部为气体的反应,恒容时混合气体的
密度等
√
×
√
×
√
√
③⑤⑥
4.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体
的压强;②混合气体的密度;③混合气体的总物质的量;④混合气体的平
均相对分子质量;⑤混合气体的颜色;⑥各反应物或生成物的反应速率之
比都等于化学计量数之比。
①③④
⑤
②④
项目 是否平衡
总压强 是
不一定
是
不一定
(2)利用“气体密度”判断——要注意反应前后是否有非气态物质参加。
反应 是否平衡
是
不一定
不一定
课堂检测 巩固落实
1.(2025·邯郸高二月考)下列关于可逆反应的叙述正确的是( )
√
√
√
√
①③
第二单元 化学反应的方向与限度
第2课时 化学平衡状态
1.了解化学反应的可逆性,认识化学变化有一定限度。
2.了解化学平衡建立的过程,理解化学平衡的特征。
3.学会平衡状态的判断方法,建立化学平衡状态判断的思维模型。
1.可逆反应
(1)定义:在相同条件下,既能向①________方向进行,同时又能向
②_________方向进行的反应。
(2)表示方法:可逆反应的化学方程式常用“③___”连接,把从左向右进行
的反应称为④________,对应的速率为⑤____,把从右向左进行的反应称为
⑥________,对应的速率为⑦____。
正反应
逆反应
正反应
逆反应
(3)特征
2.化学平衡的建立
(1)化学平衡的建立过程
最大
0
0
减小
逐渐减小
增大
增大
不变
(2)化学平衡建立的浓度—时间图像和速率—时间图像
3.化学平衡状态
(1)概念:当外界条件不变时,可逆反应进行到一定程度,反应物和生
成物的浓度不再随时间而发生变化,我们称之为化学平衡状态。
(2)化学平衡的特征
可逆反应
动态
相等
×
(2)化学平衡状态时,所有物质的速率都相等( )
×
(3)平衡状态是一种静止的状态,反应物和生成物的浓度已经不再改变
( )
×
(4)反应达到化学平衡状态时,反应混合物中各组分的浓度保持不变且
相等( )
×
(5)只有可逆反应才存在平衡状态( )
√
√
√
√
2.利用“变量不变”判断
确定反应中
“变量” 随反应进行而变化的量,当变量不再变化时,表明反应已
达到平衡状态。而当“不变量”不变时,不能判断反应是否
处于平衡状态
把握常见的
“变量” 气体的颜色
对于气体体积有变化的反应,恒压反应中的体积、恒容反
应中的压强
把握常见的
“变量” 对于反应体系中全部为气体,且气体物质的量有变化的反
应,混合气体的平均相对分子质量
对于反应体系中不全部为气体的反应,恒容时混合气体的
密度等
√
×
√
×
√
√
③⑤⑥
4.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体
的压强;②混合气体的密度;③混合气体的总物质的量;④混合气体的平
均相对分子质量;⑤混合气体的颜色;⑥各反应物或生成物的反应速率之
比都等于化学计量数之比。
①③④
⑤
②④
项目 是否平衡
总压强 是
不一定
是
不一定
(2)利用“气体密度”判断——要注意反应前后是否有非气态物质参加。
反应 是否平衡
是
不一定
不一定
课堂检测 巩固落实
1.(2025·邯郸高二月考)下列关于可逆反应的叙述正确的是( )
√
√
√
√
①③
