苏教版高中化学选择性必修1专题2化学反应速率与化学平衡第一单元化学反应速率第2课时影响化学反应速率的因素课件(共43张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修1专题2化学反应速率与化学平衡第一单元化学反应速率第2课时影响化学反应速率的因素课件(共43张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 6.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-21 18:42:10 | ||
图片预览











文档简介
(共43张PPT)
第一单元 化学反应速率
第2课时 影响化学反应速率的因素
1.知道化学反应是有历程的,认识基元反应的活化能对化学反应速率的影响。
2.通过实验探究,了解温度、浓度、压强和催化剂对化学反应速率的影响。
3.能运用温度、浓度、压强和催化剂对化学反应速率的影响规律解释生产、
生活、实验室中的实际问题,能讨论化学反应条件的选择和优化。
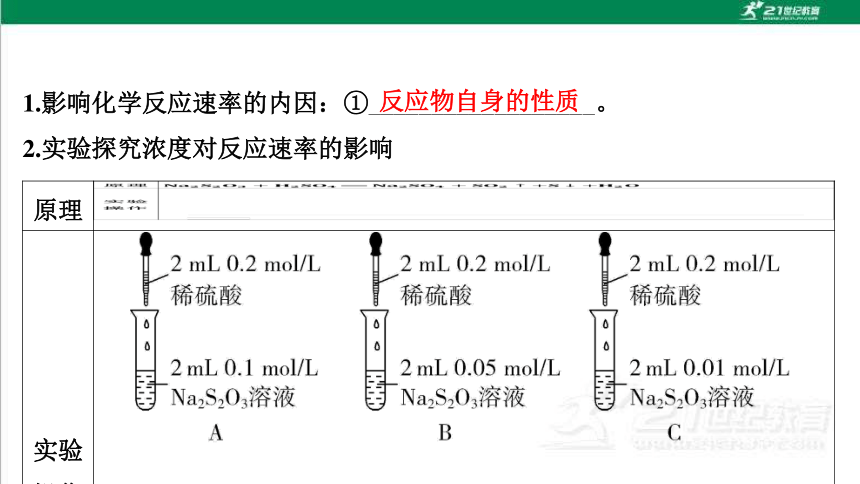
1.影响化学反应速率的内因:①__________________。
2.实验探究浓度对反应速率的影响
反应物自身的性质
原理
实验
操作 ________________________________________________________________________________________________________________________________________________________________________
实验
现象 均出现浑浊,先后顺序为A、B、C
实验
结论
规律 其他条件相同时,增大反应物的浓度,反应速率②______;减小反
应物的浓度,反应速率③______
增大
减小
续表
[特别提醒] 浓度对化学反应速率的影响注意点
(1)对于固体或纯液体,其浓度可视为常数,其质量改变时不影响化学
反应速率。增大其接触面积,才能增大反应速率。
(2)对于离子反应,只有实际参加反应的各离子浓度发生变化,才会引
起化学反应速率的改变。
3.理论解释
(1)碰撞理论——化学反应的微观条件
①活化分子:化学反应中,能量较高、有可能发生④__________的分子。
②活化能:⑤__________的平均能量与⑥__________的平均能量之差。
有效碰撞
活化分子
所有分子
③用碰撞理论理解化学反应的过程
④有效碰撞与化学反应速率的关系
有效碰撞的次数越多,化学反应速率越⑦____。
大
增多
增多
增大
减小
4.基元反应
(1)概念
许多化学反应的过程较为复杂,反应物往往不是一步转化为生成物的。化
学家用最简单的化学反应模型来说明反应发生的过程。反应物分子经过
______碰撞就转化为产物分子的反应,称为基元反应。
一次
(2)基元反应的活化能与反应速率的关系
每个基元反应都有对应的活化能,反应的活化能越大,活化分子所占比例
越 ____,有效碰撞的比例也就越 ____,化学反应速率越 ____。
小
小
小
×
(2)活化分子间的碰撞一定能发生化学反应( )
×
(3)所有的化学反应都是经历几步基元反应完成的( )
×
(4)增加固体反应物的质量,化学反应速率增大( )
×
(5)增大反应物的浓度,虽然活化分子所占比例未变,但单位体积内分
子数目增多,使单位体积内活化分子数目增多,化学反应速率增大( )
√
1.下列说法正确的是( )
A.活化分子具有的能量是活化能
B.活化分子数目越多,反应速率越大
C.当增大反应物的浓度时,反应物的活化分子比例增大
D.单位时间内有效碰撞次数越多,反应速率越大
解析:选D。活化分子的平均能量与所有分子的平均能量之差称为活化能,
A错误;单位体积内活化分子数目越多,有效碰撞的次数越多,反应速率越
大,B错误;当增大反应物的浓度时,反应物的活化分子比例不变,C错误。
√
√
②
1.压强对反应速率的影响
对于有气体参加的反应,在密闭容器中保持温度不变时,增大压强,气体
体积减小,相当于增大反应物的浓度,反应速率①______;减小压强,气
体体积增大,相当于减小反应物的浓度,反应速率②______。
增大
减小
2.温度对反应速率的影响
(1)实验探究
原理
实验操作 ______________________________________________________________________________________________
实验现象
实验结论 其他条件相同时,升高温度,反应速率③______;降低温度,
反应速率④______
增大
减小
(2)理论解释:随着温度的升高,反应物的活化分子数目⑤______,分
子运动⑥______,活化分子有效碰撞的次数⑦______,反应速率⑧______。
增多
加快
增多
增大
续表
3.催化剂对反应速率的影响
(1)实验探究
原理
实验操作 ________________________________________________________________________________________________________________________________________________
实验现象 A和B试管立即产生大量气泡;C试管产生气泡很慢
实验结论 使用催化剂,化学反应速率增大
高
活化能
正反应
逆反应
大
实验表明,催化剂对化学反应速率有显著影响。催
化剂是通过降低化学反应所需的 ________来增大
反应速率的。如图2,有催化剂参与的反应,活化能
活化能
大
大
小
(3)酶的催化作用
①酶的催化原理:酶的催化作用是酶与反应物先形
成中间化合物,然后中间化合物分解成产物并释放
酶,如图:
②酶的催化作用的特点:高效的催化活性、高度的选择性、特殊的温度效应。
4.其他因素对反应速率的影响
除了改变反应物的浓度、压强、温度和使用催化剂能改变化学反应速率外,
许多方法也能改变反应速率。如增大反应物间的接触面积,反应速率会随
之增大。此外,光、电磁波、超声波等因素也会对反应速率产生影响。
√
√
A.该反应为放热反应
B.催化剂Ⅱ比催化剂Ⅰ活性更好
C.催化剂可改变反应的活化能和焓变
D.正反应的活化能小于逆反应的活化能
√
解析:选C。由题图可知,反应物总能量高于生成物总能量,该反应为放
热反应,A项正确;由题图可知,使用催化剂Ⅱ时反应的活化能更低,因
此催化剂Ⅱ比催化剂Ⅰ活性更好,B项正确;催化剂可改变反应的活化能,
但不能改变焓变,C项错误;由题图可知,正反应的活化能小于逆反应的
活化能,D项正确。
编号 改变的条件
① 升高温度 ______
② 降低温度 ______
③ 增大氧气的浓度 ______
④ ______
⑤ 压缩容器容积 ______
⑥ ______
⑦ ______
增大
减小
增大
增大
增大
减小
不变
解析:升高温度,反应速率增大,反之速率减小;增大反应物的浓度,反
应速率增大;使用适当催化剂,反应速率增大;压缩容器容积,反应物和
生成物的浓度增大,反应速率增大;恒压下通入无关气体,容器容积增大,
反应物和生成物的浓度减小,反应速率减小;恒容下通入无关气体,反应
物和生成物的浓度不变,反应速率不变。
课堂检测 巩固落实
1.(2025·湛江高二月考)下列关于影响化学反应速率的条件说法正确的是
( )
A.增大压强一定能增大化学反应速率
B.使用催化剂,使反应的活化能升高,化学反应速率增大
C.减小反应物的质量可以减少活化分子数目,从而减小化学反应速率
D.升高温度,活化分子所占比例增大,有效碰撞次数增多,化学反应速率
增大
√
解析:选D。没有气体参与的反应,增大压强,化学反应速率不变,故A错
误;使用催化剂,使反应的活化能降低,化学反应速率增大,故B错误;减
小反应物的浓度,可以减少单位体积内活化分子数目,从而减小化学反应
速率,故C错误;升高温度,部分普通分子获得能量转化为活化分子,活化
分子所占比例增大,有效碰撞次数增多,化学反应速率增大,故D正确。
√
√
实验
编号
1 298 4 2 2 8
2 298 5 2 2 1 6
3 303 5 2 1 2
√
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案见下表:
实验
序号
水 淀粉溶液
① 10.0 0.0 4.0 4.0 2.0
② 9.0 1.0 4.0 4.0 2.0
③ 8.0 4.0 4.0 2.0
2.0
第一单元 化学反应速率
第2课时 影响化学反应速率的因素
1.知道化学反应是有历程的,认识基元反应的活化能对化学反应速率的影响。
2.通过实验探究,了解温度、浓度、压强和催化剂对化学反应速率的影响。
3.能运用温度、浓度、压强和催化剂对化学反应速率的影响规律解释生产、
生活、实验室中的实际问题,能讨论化学反应条件的选择和优化。
1.影响化学反应速率的内因:①__________________。
2.实验探究浓度对反应速率的影响
反应物自身的性质
原理
实验
操作 ________________________________________________________________________________________________________________________________________________________________________
实验
现象 均出现浑浊,先后顺序为A、B、C
实验
结论
规律 其他条件相同时,增大反应物的浓度,反应速率②______;减小反
应物的浓度,反应速率③______
增大
减小
续表
[特别提醒] 浓度对化学反应速率的影响注意点
(1)对于固体或纯液体,其浓度可视为常数,其质量改变时不影响化学
反应速率。增大其接触面积,才能增大反应速率。
(2)对于离子反应,只有实际参加反应的各离子浓度发生变化,才会引
起化学反应速率的改变。
3.理论解释
(1)碰撞理论——化学反应的微观条件
①活化分子:化学反应中,能量较高、有可能发生④__________的分子。
②活化能:⑤__________的平均能量与⑥__________的平均能量之差。
有效碰撞
活化分子
所有分子
③用碰撞理论理解化学反应的过程
④有效碰撞与化学反应速率的关系
有效碰撞的次数越多,化学反应速率越⑦____。
大
增多
增多
增大
减小
4.基元反应
(1)概念
许多化学反应的过程较为复杂,反应物往往不是一步转化为生成物的。化
学家用最简单的化学反应模型来说明反应发生的过程。反应物分子经过
______碰撞就转化为产物分子的反应,称为基元反应。
一次
(2)基元反应的活化能与反应速率的关系
每个基元反应都有对应的活化能,反应的活化能越大,活化分子所占比例
越 ____,有效碰撞的比例也就越 ____,化学反应速率越 ____。
小
小
小
×
(2)活化分子间的碰撞一定能发生化学反应( )
×
(3)所有的化学反应都是经历几步基元反应完成的( )
×
(4)增加固体反应物的质量,化学反应速率增大( )
×
(5)增大反应物的浓度,虽然活化分子所占比例未变,但单位体积内分
子数目增多,使单位体积内活化分子数目增多,化学反应速率增大( )
√
1.下列说法正确的是( )
A.活化分子具有的能量是活化能
B.活化分子数目越多,反应速率越大
C.当增大反应物的浓度时,反应物的活化分子比例增大
D.单位时间内有效碰撞次数越多,反应速率越大
解析:选D。活化分子的平均能量与所有分子的平均能量之差称为活化能,
A错误;单位体积内活化分子数目越多,有效碰撞的次数越多,反应速率越
大,B错误;当增大反应物的浓度时,反应物的活化分子比例不变,C错误。
√
√
②
1.压强对反应速率的影响
对于有气体参加的反应,在密闭容器中保持温度不变时,增大压强,气体
体积减小,相当于增大反应物的浓度,反应速率①______;减小压强,气
体体积增大,相当于减小反应物的浓度,反应速率②______。
增大
减小
2.温度对反应速率的影响
(1)实验探究
原理
实验操作 ______________________________________________________________________________________________
实验现象
实验结论 其他条件相同时,升高温度,反应速率③______;降低温度,
反应速率④______
增大
减小
(2)理论解释:随着温度的升高,反应物的活化分子数目⑤______,分
子运动⑥______,活化分子有效碰撞的次数⑦______,反应速率⑧______。
增多
加快
增多
增大
续表
3.催化剂对反应速率的影响
(1)实验探究
原理
实验操作 ________________________________________________________________________________________________________________________________________________
实验现象 A和B试管立即产生大量气泡;C试管产生气泡很慢
实验结论 使用催化剂,化学反应速率增大
高
活化能
正反应
逆反应
大
实验表明,催化剂对化学反应速率有显著影响。催
化剂是通过降低化学反应所需的 ________来增大
反应速率的。如图2,有催化剂参与的反应,活化能
活化能
大
大
小
(3)酶的催化作用
①酶的催化原理:酶的催化作用是酶与反应物先形
成中间化合物,然后中间化合物分解成产物并释放
酶,如图:
②酶的催化作用的特点:高效的催化活性、高度的选择性、特殊的温度效应。
4.其他因素对反应速率的影响
除了改变反应物的浓度、压强、温度和使用催化剂能改变化学反应速率外,
许多方法也能改变反应速率。如增大反应物间的接触面积,反应速率会随
之增大。此外,光、电磁波、超声波等因素也会对反应速率产生影响。
√
√
A.该反应为放热反应
B.催化剂Ⅱ比催化剂Ⅰ活性更好
C.催化剂可改变反应的活化能和焓变
D.正反应的活化能小于逆反应的活化能
√
解析:选C。由题图可知,反应物总能量高于生成物总能量,该反应为放
热反应,A项正确;由题图可知,使用催化剂Ⅱ时反应的活化能更低,因
此催化剂Ⅱ比催化剂Ⅰ活性更好,B项正确;催化剂可改变反应的活化能,
但不能改变焓变,C项错误;由题图可知,正反应的活化能小于逆反应的
活化能,D项正确。
编号 改变的条件
① 升高温度 ______
② 降低温度 ______
③ 增大氧气的浓度 ______
④ ______
⑤ 压缩容器容积 ______
⑥ ______
⑦ ______
增大
减小
增大
增大
增大
减小
不变
解析:升高温度,反应速率增大,反之速率减小;增大反应物的浓度,反
应速率增大;使用适当催化剂,反应速率增大;压缩容器容积,反应物和
生成物的浓度增大,反应速率增大;恒压下通入无关气体,容器容积增大,
反应物和生成物的浓度减小,反应速率减小;恒容下通入无关气体,反应
物和生成物的浓度不变,反应速率不变。
课堂检测 巩固落实
1.(2025·湛江高二月考)下列关于影响化学反应速率的条件说法正确的是
( )
A.增大压强一定能增大化学反应速率
B.使用催化剂,使反应的活化能升高,化学反应速率增大
C.减小反应物的质量可以减少活化分子数目,从而减小化学反应速率
D.升高温度,活化分子所占比例增大,有效碰撞次数增多,化学反应速率
增大
√
解析:选D。没有气体参与的反应,增大压强,化学反应速率不变,故A错
误;使用催化剂,使反应的活化能降低,化学反应速率增大,故B错误;减
小反应物的浓度,可以减少单位体积内活化分子数目,从而减小化学反应
速率,故C错误;升高温度,部分普通分子获得能量转化为活化分子,活化
分子所占比例增大,有效碰撞次数增多,化学反应速率增大,故D正确。
√
√
实验
编号
1 298 4 2 2 8
2 298 5 2 2 1 6
3 303 5 2 1 2
√
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案见下表:
实验
序号
水 淀粉溶液
① 10.0 0.0 4.0 4.0 2.0
② 9.0 1.0 4.0 4.0 2.0
③ 8.0 4.0 4.0 2.0
2.0
