苏教版高中化学选择性必修1专题2化学反应速率与化学平衡第三单元化学平衡的移动第2课时温度变化对化学平衡的影响勒夏特列原理课件(共43张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修1专题2化学反应速率与化学平衡第三单元化学平衡的移动第2课时温度变化对化学平衡的影响勒夏特列原理课件(共43张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 8.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-21 18:42:37 | ||
图片预览










文档简介
(共43张PPT)
第三单元 化学平衡的移动
第2课时 温度变化对化学平衡的影响 勒夏特列原理
1.通过实验探究,理解温度变化对化学平衡移动的影响,进一步构建“化学
变化是有条件的”这一科学观念。
2.理解勒夏特列原理,能依据此原理分析化学平衡移动的方向,体会理论
对实践的指导作用。
1.实验探究
实验
原理
实验
步骤 _______________________________________________ _______________________________________________ _______________________________________________
实验
现象 溶液变为蓝色 溶液不变色 溶液变为粉红色
结论 其他条件不变时,升高温度,化学平衡向①________方向(即
②____热反应方向)移动;降低温度,化学平衡向③________方向
(即④____热反应方向)移动
正反应
吸
逆反应
放
续表
增大
逆向
减小
正向
3.催化剂对化学平衡的影响
(1)影响规律
当其他条件不变时,催化剂不能改变达到化学平衡状态的反
应混合物的组成,但是,使用催化剂能改变反应达到平衡所需的时间。
(1)温度可以影响任意可逆反应的化学平衡状态 ( )
√
(2)催化剂能增大反应速率,提高单位时间内的产量,也能提高反应物
的平衡转化率( )
×
(3)升高温度,反应速率增大,但反应物的转化率可能降低( )
√
(4)对于可逆反应,改变外界条件使平衡向正反应方向移动,化学平衡
常数一定增大( )
×
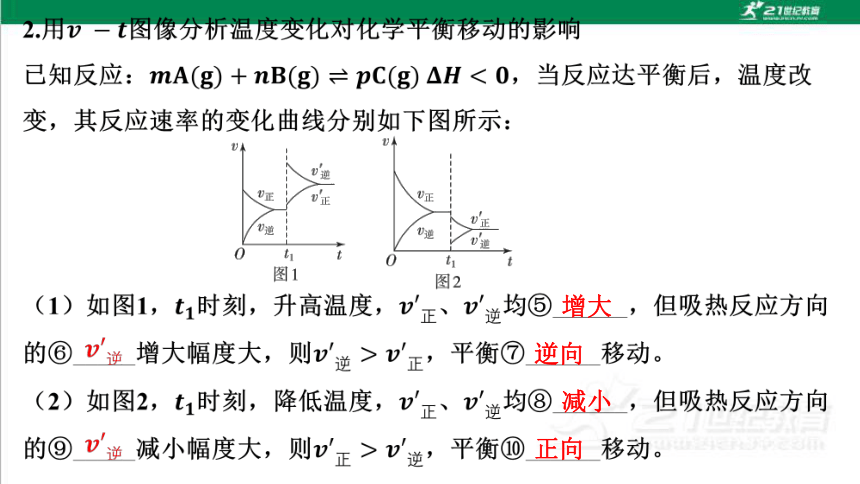
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.正、逆反应速率都减小,平衡向正反应方向移动
D.正、逆反应速率都增大,平衡向逆反应方向移动
解析:选D。升高温度,正、逆反应速率都增大;又因该反应的正反应为
放热反应,故升高温度,平衡向逆反应方向移动。
√
√
√
1.内容
改变影响化学平衡的一个因素(如浓度、压强或温度),平衡将向着能够
减弱这种改变的方向移动,这就是著名的“勒夏特列原理”,也称为化学平衡
移动原理。
×
(2)勒夏特列原理适用于所有的动态平衡( )
√
(3)其他条件不变,若增大某反应物的浓度,则平衡向减小该物质浓度
的方向移动,最终该物质的浓度减小( )
×
(4)加入催化剂有利于合成氨的反应,可用勒夏特列原理解释( )
×
1.下列事实能用勒夏特列原理解释的是( )
√
2.学习“化学平衡移动原理”后,以你的理解,下列叙述正确的是 ( )
√
3.下列事实能用勒夏特列原理解释的是( )
√
分析化学平衡的一般思路
条件 提高氨的产率
压强 ①__________
温度 ②__________
催化剂 ③________
浓度 ④______反应物浓度,⑤______生成物浓度
增大压强
降低温度
无影响
增大
降低
2.实际工业合成氨的适宜条件
(1)工业生产中,必须从反应速率和反应限度两个角度选择合成氨的适
宜条件。
①尽量增大反应物的转化率,充分利用原料。
②选择较快的化学反应速率,提高单位时间内的产量。
③考虑设备的要求和技术条件等。
3.合成氨的工艺流程
4.化学反应的调控
(1)含义:通过改变反应条件使一个可能发生的反应
按照某一方向进行。
(2)考虑因素
①考虑设备条件、安全操作、经济成本等。
②分析影响化学反应速率和化学平衡的因素,寻找适宜的生产条件。
③考虑是否符合环境保护及社会效益等方面的规定和要求。
1.下列关于工业合成氨的叙述错误的是( )
√
A.低温和高压 B.低温和低压 C.高温和高压 D.高温和低压
√
√
课堂检测 巩固落实
1.下列实验事实能用勒夏特列原理解释的是( )
√
2.在合成氨反应中使用催化剂和施加高压,下列叙述正确的是( )
A.都能提高反应速率,都对化学平衡无影响
B.都对化学平衡有影响,但都不影响达到平衡状态所用的时间
C.都能缩短达到平衡状态所用的时间,只有施加高压对化学平衡有影响
D.使用催化剂能缩短反应达到平衡状态所用的时间,而施加高压无此效果
√
√
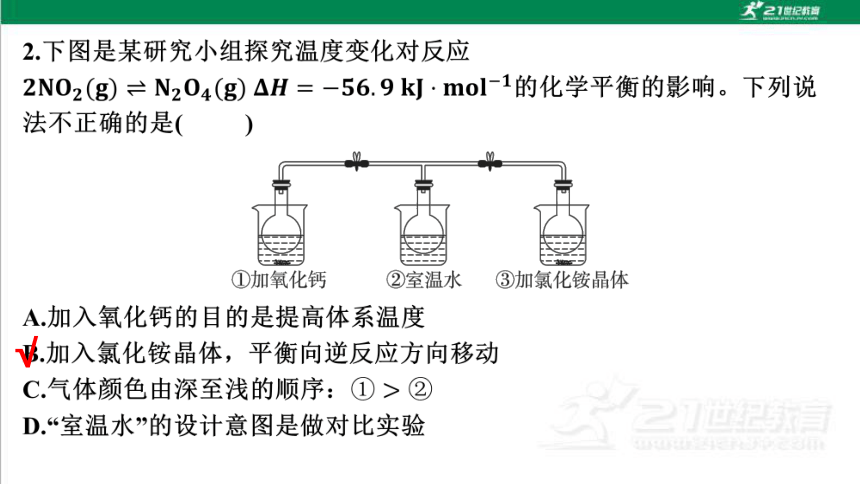
A.装置①烧瓶中气体颜色变浅
B.装置②的作用是对比①③气体颜色
深浅,判断平衡移动方向
C.装置③中平衡逆向移动
D.装置③中硝酸铵的溶解为放热过程
√
第三单元 化学平衡的移动
第2课时 温度变化对化学平衡的影响 勒夏特列原理
1.通过实验探究,理解温度变化对化学平衡移动的影响,进一步构建“化学
变化是有条件的”这一科学观念。
2.理解勒夏特列原理,能依据此原理分析化学平衡移动的方向,体会理论
对实践的指导作用。
1.实验探究
实验
原理
实验
步骤 _______________________________________________ _______________________________________________ _______________________________________________
实验
现象 溶液变为蓝色 溶液不变色 溶液变为粉红色
结论 其他条件不变时,升高温度,化学平衡向①________方向(即
②____热反应方向)移动;降低温度,化学平衡向③________方向
(即④____热反应方向)移动
正反应
吸
逆反应
放
续表
增大
逆向
减小
正向
3.催化剂对化学平衡的影响
(1)影响规律
当其他条件不变时,催化剂不能改变达到化学平衡状态的反
应混合物的组成,但是,使用催化剂能改变反应达到平衡所需的时间。
(1)温度可以影响任意可逆反应的化学平衡状态 ( )
√
(2)催化剂能增大反应速率,提高单位时间内的产量,也能提高反应物
的平衡转化率( )
×
(3)升高温度,反应速率增大,但反应物的转化率可能降低( )
√
(4)对于可逆反应,改变外界条件使平衡向正反应方向移动,化学平衡
常数一定增大( )
×
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.正、逆反应速率都减小,平衡向正反应方向移动
D.正、逆反应速率都增大,平衡向逆反应方向移动
解析:选D。升高温度,正、逆反应速率都增大;又因该反应的正反应为
放热反应,故升高温度,平衡向逆反应方向移动。
√
√
√
1.内容
改变影响化学平衡的一个因素(如浓度、压强或温度),平衡将向着能够
减弱这种改变的方向移动,这就是著名的“勒夏特列原理”,也称为化学平衡
移动原理。
×
(2)勒夏特列原理适用于所有的动态平衡( )
√
(3)其他条件不变,若增大某反应物的浓度,则平衡向减小该物质浓度
的方向移动,最终该物质的浓度减小( )
×
(4)加入催化剂有利于合成氨的反应,可用勒夏特列原理解释( )
×
1.下列事实能用勒夏特列原理解释的是( )
√
2.学习“化学平衡移动原理”后,以你的理解,下列叙述正确的是 ( )
√
3.下列事实能用勒夏特列原理解释的是( )
√
分析化学平衡的一般思路
条件 提高氨的产率
压强 ①__________
温度 ②__________
催化剂 ③________
浓度 ④______反应物浓度,⑤______生成物浓度
增大压强
降低温度
无影响
增大
降低
2.实际工业合成氨的适宜条件
(1)工业生产中,必须从反应速率和反应限度两个角度选择合成氨的适
宜条件。
①尽量增大反应物的转化率,充分利用原料。
②选择较快的化学反应速率,提高单位时间内的产量。
③考虑设备的要求和技术条件等。
3.合成氨的工艺流程
4.化学反应的调控
(1)含义:通过改变反应条件使一个可能发生的反应
按照某一方向进行。
(2)考虑因素
①考虑设备条件、安全操作、经济成本等。
②分析影响化学反应速率和化学平衡的因素,寻找适宜的生产条件。
③考虑是否符合环境保护及社会效益等方面的规定和要求。
1.下列关于工业合成氨的叙述错误的是( )
√
A.低温和高压 B.低温和低压 C.高温和高压 D.高温和低压
√
√
课堂检测 巩固落实
1.下列实验事实能用勒夏特列原理解释的是( )
√
2.在合成氨反应中使用催化剂和施加高压,下列叙述正确的是( )
A.都能提高反应速率,都对化学平衡无影响
B.都对化学平衡有影响,但都不影响达到平衡状态所用的时间
C.都能缩短达到平衡状态所用的时间,只有施加高压对化学平衡有影响
D.使用催化剂能缩短反应达到平衡状态所用的时间,而施加高压无此效果
√
√
A.装置①烧瓶中气体颜色变浅
B.装置②的作用是对比①③气体颜色
深浅,判断平衡移动方向
C.装置③中平衡逆向移动
D.装置③中硝酸铵的溶解为放热过程
√
