苏教版高中化学选择性必修1专题3水溶液中的离子反应第三单元盐类的水解第1课时盐类水解的原理课件(共34张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修1专题3水溶液中的离子反应第三单元盐类的水解第1课时盐类水解的原理课件(共34张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 6.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-21 18:43:01 | ||
图片预览








文档简介
(共34张PPT)
第三单元 盐类的水解
第1课时 盐类水解的原理
1.通过实验探究盐溶液呈现不同酸碱性的原因,认识盐类水解的原理,正
确书写盐类水解方程式。
2.根据盐的组成判断溶液的酸碱性,建立思维模型并能运用该模型解释水
解的相关问题。
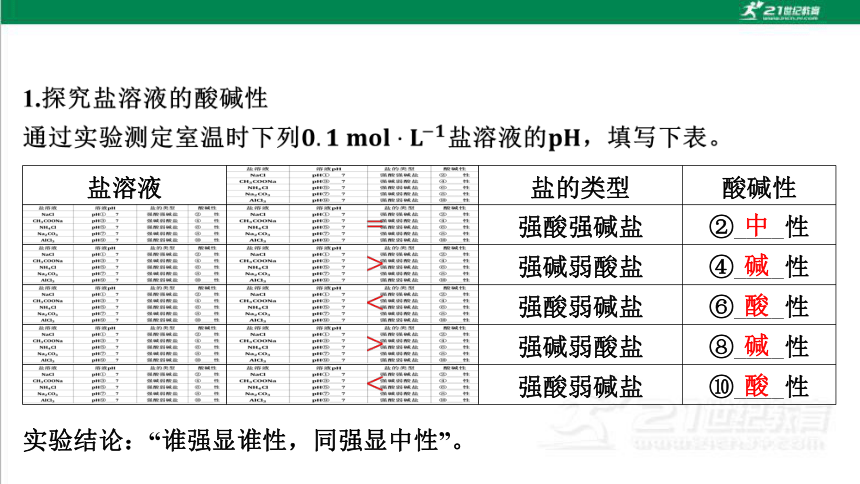
盐溶液 盐的类型 酸碱性
强酸强碱盐 ②____性
强碱弱酸盐 ④____性
强酸弱碱盐 ⑥____性
强碱弱酸盐 ⑧____性
强酸弱碱盐 ⑩____性
实验结论:“谁强显谁性,同强显中性”。
中
碱
酸
碱
酸
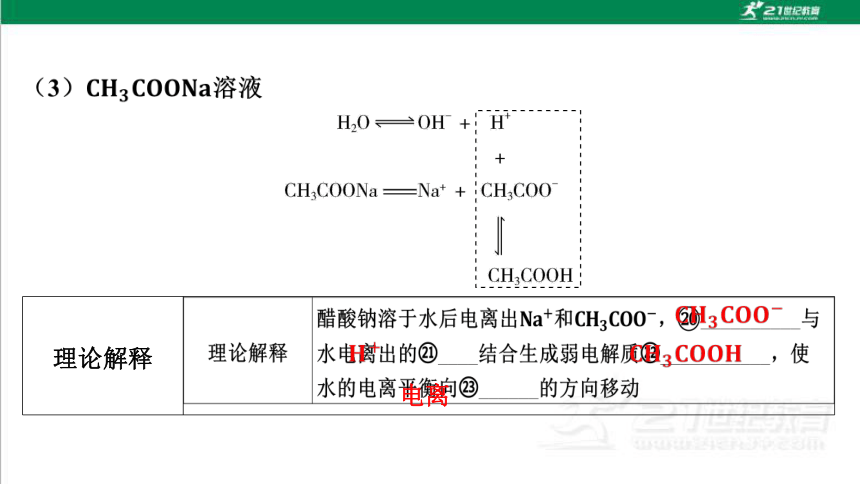
2.盐溶液酸碱性不同的原因
中
理论解释
平衡时溶液的
酸碱性
总离子方程式 _____________________________
电离
酸
理论解释
电离
平衡时溶液
的酸碱性
总离子
方程式 ___________________________________
碱
续表
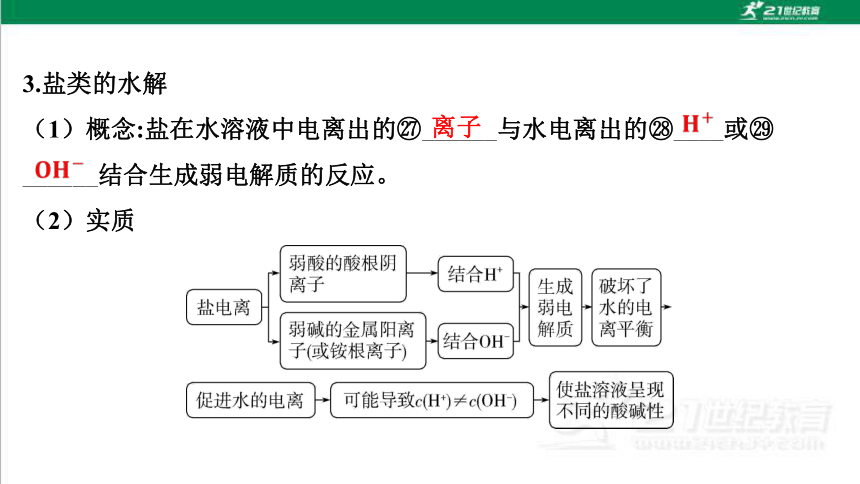
3.盐类的水解
(1)概念:盐在水溶液中电离出的 ______与水电离出的 ____或
______结合生成弱电解质的反应。
(2)实质
离子
(3)特点
吸热
4.盐类水解的规律
(1)“有弱才水解,无弱不水解”——盐中有弱酸的酸根阴离子或弱碱的
金属阳离子(或铵根离子)才水解,若没有,则是强酸强碱盐,不发生水
解反应。
(2)“谁弱谁水解,都弱都水解”——发生水解的是 _________________
_________________________________;弱酸弱碱盐因阴、阳离子都能发
生水解且水解互相促进,所以水解程度相对较大,少数可以完全水解。
弱碱的金属阳离子
(或铵根离子)或弱酸的酸根阴离子
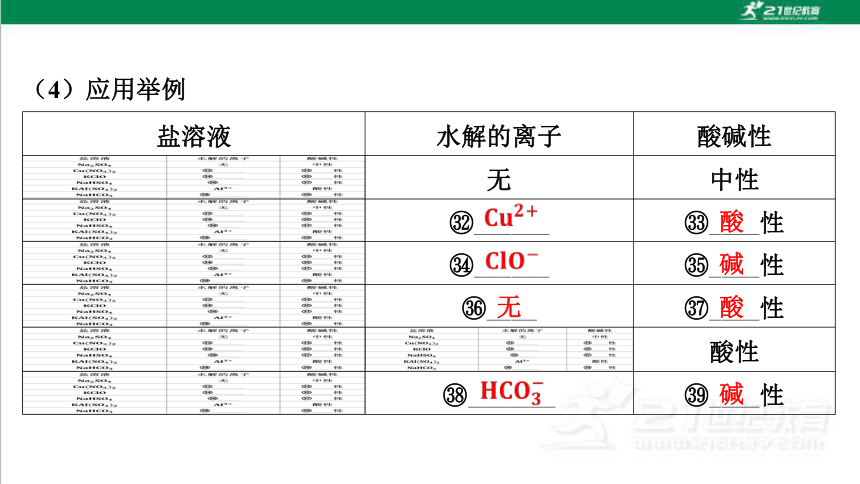
(4)应用举例
盐溶液 水解的离子 酸碱性
无 中性
______ ____性
______ ____性
____ ____性
酸性
_______ ____性
酸
碱
无
酸
碱
×
√
(3)酸式盐溶液可能呈酸性,也可能呈碱性( )
√
√
√
√
√
√
1.盐类水解离子方程式的书写要点
2.常见6种盐类水解离子方程式的书写
一元强碱
弱酸盐
一元强酸
弱碱盐
多元弱酸
强碱盐
(正盐)
多元弱酸
的酸式盐
多元弱碱
强酸盐
弱酸弱碱
盐
续表
1.(2025·郑州高二月考)下列离子方程式中,属于水解反应且书写正确的
是( )
√
2.(2025·湛江高二月考)下列方程式中是水解方程式的是( )
√
课堂检测 巩固落实
1.下列说法正确的是( )
√
2.(2025·贵港高二月考)下列关于盐溶液呈酸碱性的说法错误的是
( )
√
3.(2025·沧州高二月考)在一定条件下发生下列反应,其中属于盐类水解
反应的是( )
√
√
2
(2)能够促进水的电离的有________(填序号)。
②③④
解析:酸和碱都抑制水的电离,能水解的盐会促进水的电离,因此能够促
进水的电离的有②③④。
(3)所含离子种类最多的是____(填序号)。
②
①③④②⑤
第三单元 盐类的水解
第1课时 盐类水解的原理
1.通过实验探究盐溶液呈现不同酸碱性的原因,认识盐类水解的原理,正
确书写盐类水解方程式。
2.根据盐的组成判断溶液的酸碱性,建立思维模型并能运用该模型解释水
解的相关问题。
盐溶液 盐的类型 酸碱性
强酸强碱盐 ②____性
强碱弱酸盐 ④____性
强酸弱碱盐 ⑥____性
强碱弱酸盐 ⑧____性
强酸弱碱盐 ⑩____性
实验结论:“谁强显谁性,同强显中性”。
中
碱
酸
碱
酸
2.盐溶液酸碱性不同的原因
中
理论解释
平衡时溶液的
酸碱性
总离子方程式 _____________________________
电离
酸
理论解释
电离
平衡时溶液
的酸碱性
总离子
方程式 ___________________________________
碱
续表
3.盐类的水解
(1)概念:盐在水溶液中电离出的 ______与水电离出的 ____或
______结合生成弱电解质的反应。
(2)实质
离子
(3)特点
吸热
4.盐类水解的规律
(1)“有弱才水解,无弱不水解”——盐中有弱酸的酸根阴离子或弱碱的
金属阳离子(或铵根离子)才水解,若没有,则是强酸强碱盐,不发生水
解反应。
(2)“谁弱谁水解,都弱都水解”——发生水解的是 _________________
_________________________________;弱酸弱碱盐因阴、阳离子都能发
生水解且水解互相促进,所以水解程度相对较大,少数可以完全水解。
弱碱的金属阳离子
(或铵根离子)或弱酸的酸根阴离子
(4)应用举例
盐溶液 水解的离子 酸碱性
无 中性
______ ____性
______ ____性
____ ____性
酸性
_______ ____性
酸
碱
无
酸
碱
×
√
(3)酸式盐溶液可能呈酸性,也可能呈碱性( )
√
√
√
√
√
√
1.盐类水解离子方程式的书写要点
2.常见6种盐类水解离子方程式的书写
一元强碱
弱酸盐
一元强酸
弱碱盐
多元弱酸
强碱盐
(正盐)
多元弱酸
的酸式盐
多元弱碱
强酸盐
弱酸弱碱
盐
续表
1.(2025·郑州高二月考)下列离子方程式中,属于水解反应且书写正确的
是( )
√
2.(2025·湛江高二月考)下列方程式中是水解方程式的是( )
√
课堂检测 巩固落实
1.下列说法正确的是( )
√
2.(2025·贵港高二月考)下列关于盐溶液呈酸碱性的说法错误的是
( )
√
3.(2025·沧州高二月考)在一定条件下发生下列反应,其中属于盐类水解
反应的是( )
√
√
2
(2)能够促进水的电离的有________(填序号)。
②③④
解析:酸和碱都抑制水的电离,能水解的盐会促进水的电离,因此能够促
进水的电离的有②③④。
(3)所含离子种类最多的是____(填序号)。
②
①③④②⑤
