山东省滕州市善国中学2015-2016学年高二下期6月月考化学试卷(解析版)
文档属性
| 名称 | 山东省滕州市善国中学2015-2016学年高二下期6月月考化学试卷(解析版) |

|
|
| 格式 | zip | ||
| 文件大小 | 263.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-14 20:55:31 | ||
图片预览




文档简介
山东省滕州市善国中学2015-2016学年高二下期6月月考化学试卷(解析版)
1.把铁粉投入氯化铜和氯化铁的混合溶液中,充分反应后,下列说法中正确的是
A.若无铜析出,则溶液中有Cu2+、Fe2+,可能有Fe3+
B.若有铜析出,则溶液中含有Fe2+,没有Cu2+和Fe3+
C.若铁有剩余,则溶液中含有Fe2+,没有Cu2+
和Fe3+
D.若铁无剩余,则溶液中含有Fe2+,无Fe3+
,可能含有Cu2+
【答案】AC
【解析】Fe投入FeCl3、CuCl2溶液中,由于Fe3+氧化性比Cu2+
强.故只有当Fe+2Fe3+====3Fe2+反应彻底后,反应Fe+Cu2+====Cu+Fe2+才发生。
2.有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中c(Cl-)与c()?之比为
(
)
A.1∶1
B.2∶3
C.3∶2
D.2∶1
【答案】B
【解析】
试题分析:本题一开始出现的沉淀是氢氧化铝和氢氧化镁,而后面溶解的原因是加入的过量的氢氧化钠把氢氧化铝溶解了。溶解需要的氢氧化钠为0.25V,则前面沉淀氢氧化铝的量是0.75V,沉淀氢氧化镁的量是0.25V,则氯离子与硫酸根离子的比值为:
0.25V:(0.75V/2)=2:3。
考点:物质的量的计算
点评:本题涉及到了氢氧化铝两性氢氧化物的性质,在解题过程可以利用一定的技巧,比如氢氧化镁所需氢氧化钠为0.25V,则氯离子的量也可以视为0.25V,因为镁离子与氢氧根离子结合是1:2,而镁离子与氯离子结合也是1:2。
3.物质的量相同的甲烷(CH4)和氨气(NH3),一定相同的是(
)
A.质量
B.体积
C.质子数
D.原子数
【答案】C
【解析】
试题分析:A、甲烷的相对分子质量为16,氨气的相对分子质量为17,物质的量相同时,二者质量不同,故A错误;B、因没有明确气体存在的条件,物质的量相等时,二者体积不一定相等,故B错误;C、1个甲烷分子含有10个质子,1个氨气分子含有10个质子,相同物质的量的甲烷和氨气的质子数相等,故C正确;D、1个甲烷含有5个原子,1个氨气含有4个原子,,相同物质的量的甲烷和氨气的含有的原子数不同,故D错误;故选C。
考点:考查了物质的量的有关计算的相关知识。
4.在元素周期表中,金属元素与非金属元素分界线附近,能找到(
)
A.制半导体材料的元素
B.制农药的元素
C.制催化剂的元素
D.制耐高温合金的元素
【答案】A
【解析】
试题分析:在元素周期表中,金属元素与非金属元素分界线附近都元素往往既难失去电子,又难得到电子,因此常用来制作半导体。B在非金属元素中寻找,C和D在过渡元素中寻找,答案选A.
考点:元素周期表的应用
5.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子分别通过交换膜向负极和正极移动,
保持溶液中电荷平衡
【答案】C
【解析】
试题分析:A、锌铜原电池装置,铜作正极,发生还原反应,A项错误;B、电池工作一段时间后,甲池的c(SO)不变,B项错误;C、电池工作一段时间后,乙池溶液氢离子替换铜离子,所以质量减小,C项错误;D、阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡,D项正确;答案选C。
考点:考查锌铜原电池
6.下列分子中所有原子都满足最外层8电子结构的是(
)
A
.
PCl5
B
.
HClO
C
.SCl2
D.BF3
【答案】C
【解析】只要分子中元素化合价的绝对值和该元素最外层电子数之和满足8,即能满足最外层8电子结构,因此选项C正确。A中的P,B中的H,D中B,都不能满足最外层8电子结构,答案选C。
7.在一定温度下,用铂电极电解饱和硫酸钠溶液,对电解质溶液的判断正确的是( )
A.不会有晶体析出
B.浓度变大
C.浓度变小
D.pH不变
【答案】D
【解析】用惰性电极电解饱和硫酸钠溶液,相当于是电解水,即溶剂要减少,所以溶液中有晶体析出,但溶液仍然是饱和溶液,浓度不变,pH不变。答案D。
8.常温下,pH=1的盐酸与pH=12的NaOH溶液恰好完全反应,二者的体积比为
A.1:1
B.10:1
C.
100:1
D.1:10
【答案】D
【解析】
试题分析:pH为1的盐酸中c(H+)=0.1mol/L,pH为12的NaOH溶液中c(OH-)=1×10-2mol/L,二者恰好完全反应,应满足n(H+)=n(OH-),设盐酸体积为为xL,NaOH溶液体积为yL,则0.1x=1×10-2y,解得:x:y=1:10.答案选D
考点:pH计算
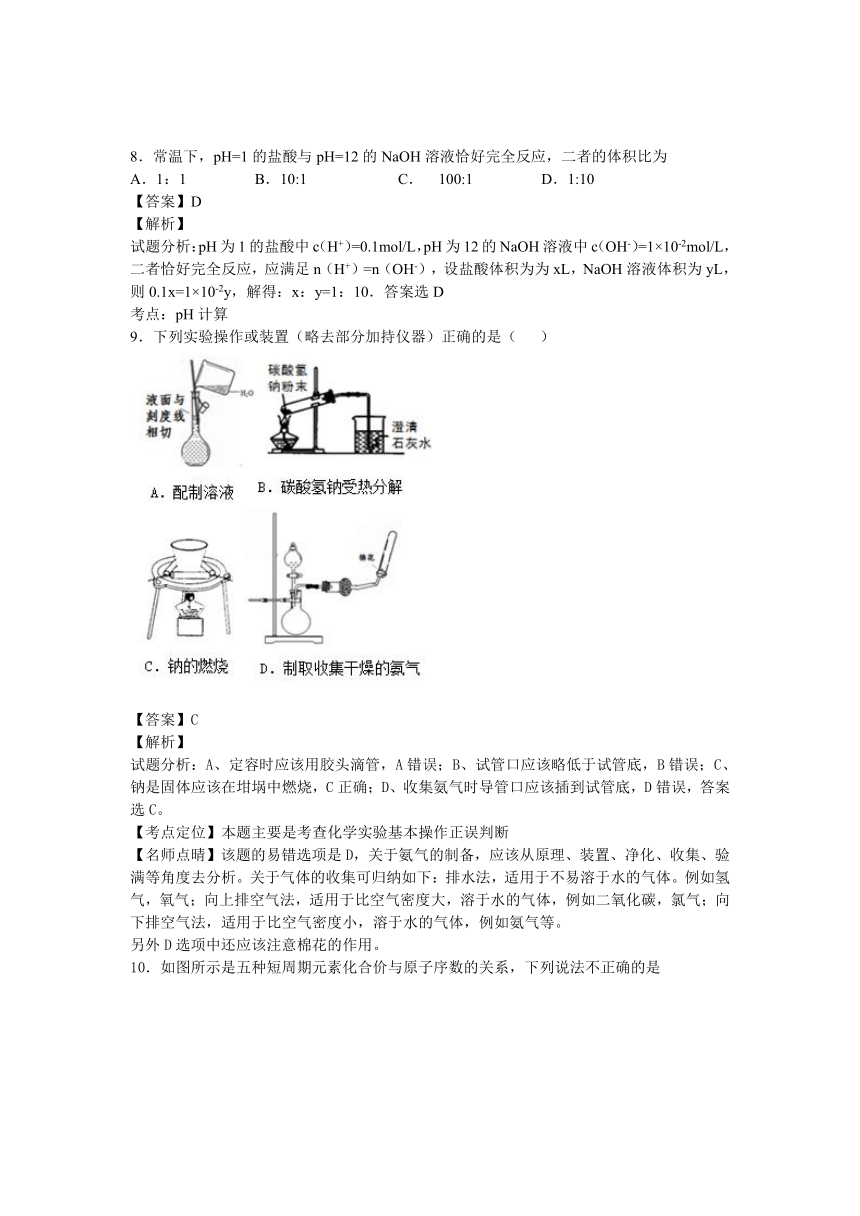
9.下列实验操作或装置(略去部分加持仪器)正确的是(
)
【答案】C
【解析】
试题分析:A、定容时应该用胶头滴管,A错误;B、试管口应该略低于试管底,B错误;C、钠是固体应该在坩埚中燃烧,C正确;D、收集氨气时导管口应该插到试管底,D错误,答案选C。
【考点定位】本题主要是考查化学实验基本操作正误判断
【名师点晴】该题的易错选项是D,关于氨气的制备,应该从原理、装置、净化、收集、验满等角度去分析。关于气体的收集可归纳如下:排水法,适用于不易溶于水的气体。例如氢气,氧气;向上排空气法,适用于比空气密度大,溶于水的气体,例如二氧化碳,氯气;向下排空气法,适用于比空气密度小,溶于水的气体,例如氨气等。
另外D选项中还应该注意棉花的作用。
10.如图所示是五种短周期元素化合价与原子序数的关系,下列说法不正确的是
A.原子半径:R>W>Z>Y>X
B.R的气态氢化物比W的气态氢化物稳定
C.X与Y可形成既含离子键又含共价键的化合物
D.Y的最高价氧化物对应水化物与Z的最高价氧化物
对应水化物能发生反应
【答案】A
【解析】
试题分析:由题意可知,X、Y、Z、W、R分别为O、Na、Al、S、Cl,原子半径的顺序应为Y>Z>W>R>X;C项,X与Y可形成Na2O和Na2O2,其中Na2O2既含离子键又含共价键;D项,Al(OH)3具有两性,可与NaOH溶液反应。
考点:以图表的形式给出信息,考查原子结构、元素周期律与元素周期表的相关知识
11.用惰性电极电解CuSO4溶液一段时间,停止后,向所得溶液中加入0.2molCu(OH)2,恰好使溶液恢复至电解前,关于电解过程说法不正确的是
A.生成的铜的物质的量是0.2mol
B.随着电解进行溶液的pH减小
C.转移电子的物质的量为0.4mol
D.阳极反应是2H2O
-4e-=4H+
+O2↑
【答案】C
【解析】
试题分析:用惰性电极电解CuSO4溶液一段时间,停止后,向所得溶液中加入0.2molCu(OH)2,恰好使溶液恢复至电解前,这说明电极产物是硫酸、铜、氧气和氢气。0.2mol氢氧化铜可以看作是0.2mol氧化铜和0.2mol水,因此生成的铜、氢气和氧气均是0.2mol,其中铜和氢气在阴极产生,氧气在阳极产生,转移电子的物质的量是0.2mol×4=0.8mol,答案选C。
考点:考查电解原理的应用
12.下列方程式正确的是
A、铁和稀硝酸反应:Fe
+
2H+
=
H
2↑+
Fe
2+
B、向氯化铵的溶液中加入足量浓NaOH溶液并加热:NH4++OH-△NH3↑+H2O
C、Ba(OH)2溶液与H2SO4溶液混合产生沉淀:Ba2++
SO42-=BaSO4↓
D、往NaOH溶液通入过量SO2:
SO2+2OH-==
SO3
2-
+H2O
【答案】B
【解析】A
错误,铁和稀硝酸反应产生NO,不产生氢气。
B
正确。
C
错误,氢离子和氢氧根离子也同时反应生成水。
D
错误,往NaOH溶液通入过量SO2会生成亚硫酸氢根离子。
13.W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.简单阴离子还原性X大于Y
D.Z元素单质在化学反应中只表现氧化性
【答案】A
【解析】
试题分析:W的气态氢化物可与其最高价含氧酸反应生成离子化合物,则W是N元素,X是O元素,Y是S元素,Z是Cl元素。A.元素的非金属性:Z>X>Y,元素的非金属性越强,其相应的氢化物的稳定性就越强,所以X、Y、Z中最简单氢化物稳定性最弱的是Y,正确;B.Z元素最高价氧化物对应水化物的酸性一定强于Y的,但若不是最高价含氧酸,则酸性不一定比Y的强,如HClOY,所以简单阴离子还原性X小于Y,错误;D.Z元素单质处于该元素的之间价态,在化学反应中既表现氧化性,又表现还原性,错误。
考点:考查元素的推断、元素周期表、元素周期律的应用的知识。
14.NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L四氯化碳的分子数约为NA个
B.盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol
C.16gO2和O3的混合气体中所含的原子数为NA个
D.1.8g的D2O中含有的电子数为NA个
【答案】BC
【解析】略
15.丙烯醛的结构是CH2=CH-CHO,下列关于它的性质的叙述中,错误的是
A、能使溴水和高锰酸钾溶液褪色
B、能被新制的氢氧化铜悬浊液氧化
C、在一定条件下,与氢气充分反应生成丙醇
D、能发生银镜反应,体现氧化性
【答案】D
【解析】判断有机物的性质,关键是找出有机物中含有的官能团。根据有机物的结构简式可知,分子中含有的官能团有碳碳双键和醛基,所以选项ABC都是正确的。能方式银镜反应,但体现的是醛基的还原性,D不正确,答案选D。
16.W、Q、A、B、X、Y、Z为原子序数依次增大的短周期元素,已知W与X在同一主族;Q的阴离子和A的阳离子具有相同的电子层结构,且两元素的单质反应,生成一种淡黄色的固体F;A、B、Z三种元素的原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水;X元素的最外层电子数比次外层电子数少4;Y元素的L层电子数等于K、M两个电子层上的电子数之和。
(1)W元素在周期表中的位置是
;
淡黄色固体F中含有的化学键是
。
(2)A与Y两元素可形成化合物,用电子式表示此化合物的形成过程:
。
(3)写出A、B两元素的最高价氧化物的水化物发生反应的离子方程式:
。
(4)A、B、Y、Z四种元素的简单离子的离子半径由大到小的顺序为:
。(用离子符号表示)
(5)X、Y、Z三种元素的氢化物的稳定性由强到弱的顺序为:
。(用化学式表示)
【答案】(每空2分,共12分)
(1)第二周期、第IVA族(答不全不得分)
;
离子键、非极性共价键(答不全不得分)
(2)
(3)Al(OH)3+
OH-
=
AlO2-+2H2O
(4)S2—>Cl—>Na+>Al3+
(5)HCl>H2S>SiH4
【解析】
试题分析:根据Q的阴离子和A的阳离子具有相同的电子层结构,且两元素的单质反应,生成一种淡黄色的固体F,F为Na2O2,Q为O,A为Na。根据A、B、Z三种元素的原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,B为Al,Z为Cl。根据X元素的最外层电子数比次外层电子数少4,X为Si。根据W与X在同一主族,W为C。根据Y元素的L层电子数等于K、M两个电子层上的电子数之和,Y为S。
(1)W为C,故在周期表中的位置是第二周期、第IVA族。
淡黄色固体F为Na2O2,含有的化学键是离子键、非极性共价键。
(2)A与Y两元素形成化合物为Na2S,电子式表示此化合物的形成过程为。
(3)A、B两元素的最高价氧化物的水化物分别为NaOH,Al(OH)3,反应的离子方程式为Al(OH)3+
OH-
=
AlO2-+2H2O。
(4)A、B、Y、Z四种元素的简单离子的离子分别为Na+、Al3+、S2—、Cl—,电子层数越多,半径越大;具有相同电子排布的离子,核电核数越大半径越小。故离子半径由大到小的顺序为S2—>Cl—>Na+>Al3+。
(5)X、Y、Z三种元素的氢化物分别为SiH4、H2S、HCl,元素的非金属性越强,对应其氢化物的稳定性越强,故氢化物的稳定性由强到弱的顺序为HCl>H2S>SiH4
。
考点:原子结构与元素周期率的关系
电子式
化学方程式的书写
点评:本题考查原子的符号,电子式,化学方程式的书写,难度不大。
17.(16分)工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
已知:
Cu2O
+
2H+
=
Cu
+
Cu2+
+
H2O
沉淀物
Cu(OH)2
Al(OH)3
Fe(OH)3
Fe(OH)2
开始沉淀pH
5.4
4.0
1.1
5.8
沉淀完全pH
6.7
5.2
3.2
8.8
(1)反应I中如果Cu2O与
Fe2O3之间恰好完全反应,则发生反应的化学方程式为:__________________
(2)用NaClO调pH=x是此工艺流程中的最佳选择。
①选择NaClO的理由是:____________________________________________________
②生成沉淀B的同时生成一种具有漂白作用的物质,写出该反应的离子方程式为:
____________________
(3)测定pH=y的仪器是___________________
(4)如果某次测定pH=y的操作失误,将适量NaOH溶液滴加到0.02mol·L-1CuSO4溶液中,致使溶液中Cu2+浓度降至原来的百分之一,则溶液的pH为
____。(已知常温下,Cu(OH)2的溶度积常数Ksp=2×10-20)
(5)电解初期阳极的电极反应式为________________________________
【答案】(1)Cu2O
+
Fe2O3
+
4H2SO4=
2CuSO4
+
2FeSO4
+
4H2O
(2)①NaClO由于发生反应ClO-+
H+HClO,ClO-消耗了H+,ClO-又具有氧化性,可将Fe2+氧化成Fe3+。所以最好用NaClO调节pH。
②5ClO-+
2Fe2+
+
5H2O
=
2Fe(OH)3
+
Cl-+
4HClO
(或
2Fe2+
+7ClO-+
2H++
5H2O
=
2Fe(OH)3
+
Cl-+
6HClO)
(3)pH计;
(4)6
;
(5)2Cl--
2e-
=
Cl2↑.
【解析】
试题分析:Cu2O与Fe2O3在酸性条件下发生氧化还原反应,方程式是Cu2O+Fe2O3+4H2SO4=2CuSO4
+2FeSO4
+4H2O;(2)①选择NaClO的理由是该盐能够发生反应消耗H+,调节溶液的pH,同时ClO-又具有氧化性,可将Fe2+氧化成Fe3+。所以最好用NaClO调节pH。②生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为:5ClO-+
2Fe2+
+
5H2O
=
2Fe(OH)3
+
Cl-+
4HClO;(3)测定溶液的pH的仪器是pH计;
(4)c(Cu2+)=2×10-4mol/L
,
c(Cu2+)·c2(OH-)=Ksp=2×10-20;
c2(OH-)=Ksp÷c(Cu2+)
=
2×10-20÷2×10-4=1×10-16;所以c(OH-)=1×10-8.因此c(H+)=Kw÷c(OH-)=1×10-6,所以pH=6.
(5)因为在该溶液中含有Cl-.放电能力:Cl->
OH-。因此在放电初期,阳极电极反应式是:2Cl--
2e-
=
Cl2↑.
考点:考查仪器的使用、反应条件的选择、化学方程式、离子方程式及电极反应式的书写、溶液pH计算。
18.(I)pH的测定是中学化学中重要的定量实验。
(1)下列关于pH测定的说法正确的是
。
a.用pH试纸测得某盐酸的pH=2.
3
b.将pH试纸直接插入待测溶液,取出后再与标准比色卡对比
c.用pH试纸测新制氯水的pH
d.能使pH试纸显红色的溶液显酸性
(2)某同学先用蒸馏水润湿pH试纸,再用该试纸分别测定c(OH-)相等的NaOH溶液和氨水的pH,误差较大的是
。
(II)常温下,甲、乙、丙三位同学用实验确定某酸HA是弱电解质的方案分别是:
甲:用pH试纸测定0.1
moI/L
HA溶液的pH,即可证明HA是弱电解质。
乙:①分别取pH=l的HA溶液和稀盐酸各10.00
mL,再加水稀释为100
mL。
②各取相同体积的两种稀释液(适量),同时分别加入纯度和形状大小均相同的锌粒(足量),观察现象,即可证明HA是弱电解质。
丙:将适量的HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,分析表中数据可以说明HA是弱电解质。
编号
NaOH/mol·L-1
HA/mol·L-1
混合溶液的pH
①
0.1
0.1
pH=9
②
c
0.2
pH=7
③
0.1
0.2
pH<7
(1)甲的方案中,说明HA是弱电解质的理由是测得溶液的pH_______1(填“>”、“<”或“=”)。
(2)在乙的方案的第①步中,需要用到的定量仪器是
。
(3)乙的方案中,说明HA是弱电解质的主要现象是_________(填字母)。
A.装稀盐酸的试管中放出H2的速率快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中产生气体的速率一样快
(4)丙的方案中,编号②中的c_______(填“>”、“<”或“=”)0.l。
(5)丙的方案中,编号③的数据表明,混合溶液中HA的电离程度比NaA的水解程度:________(填“强”、“弱”或“无法确定”)。
【答案】(本题共7
分,每空1分))(I)(1)d
(2)NaOH溶液
(II)(1)
>
(2)酸式滴定管
(3)
B
(4)>
=
(5)强
【解析】
试题分析:(I)(1)a.用pH试纸测得的溶液pH为整数值,故错误;b.应用玻璃棒蘸溶液点在pH试纸中央,待变色后再与标准比色卡对比,读出溶液pH,故错误;c.氯水有漂白性,用pH试纸无法测新制氯水的pH,故错误;d.酸性溶液能使pH试纸显红色,故正确,答案为d;(2)氨水中的NH3·H2O在加水稀释时会促进电离,而NaOH溶液直接稀释,故用蒸馏水润湿pH试纸,再用该试纸分别测定c(OH-)相等的NaOH溶液和氨水的pH,误差较大的是NaOH溶液;(II)(1)配制0.1mol/L的HA酸溶液100mL,弱电解质的电离是可逆的,不能完全电离,用pH试纸测出该溶液的pH值,如果是pH>1即为弱酸,pH=1即为强酸,先把一小块pH试纸放在表面皿或玻璃片上,再用玻璃棒蘸取溶液点在试纸的中部,待变色后,与标准比色卡对比确定溶液的pH;(2)精确取pH=1的HA溶液和稀盐酸个10.00mL,用酸式滴定管;(3)pH相等的一元酸,弱酸的浓度大于强酸,等体积等PH的醋酸和盐酸稀释相同倍数时,醋酸中氢离子浓度大于盐酸,分别和锌反应时,弱酸生成氢气的反应速率大于强酸,故B正确;(4)若酸为强酸,等体积等浓度混合时pH=7;而HA为弱酸,等体积等浓度混合溶液的pH大于7,则为保证pH=7,应使酸浓度大于0.1mol/L;由电荷守恒可知c(Na+)+c(H+)=c(A-)+c(OH-),c(H+)=c(OH-),则c(A-)=c(Na+);(5)由③组实验结果可知,等体积混合后,得到同浓度HA与NaA的混合液,pH<7,说明酸的电离程度大于盐的水解程度。
考点:考查酸碱混合溶液pH的计算及离子浓度大小的比较。
19.某兴趣小组同学在实验室用加热1-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如图所示装置,其中夹持仪器、加热仪器及冷却水管没有画出。
请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。
竖直冷凝管接通冷凝水,进水口是_____(填“I”或“Ⅱ”);竖直冷凝管的主要作用是________。
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等。熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物,已知B、C装置中为常见物质的水溶液。
B装置检验的物质是_________,写出C装置中主要的化学方程式:_______________。
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
物质
熔点/℃
沸点/℃
1-丁醇
-89.5
117.3
1-溴丁烷
-112.4
101.6
丁醚
-95.3
142.4
1-丁烯
-185.3
-6.5
请你补充下列实验步骤,直到分离出1-溴丁烷。
①待烧瓶冷却后,拔去竖直的冷凝管;
②插上带橡皮塞的温度计;
③关闭_______,打开_______;
④接通冷凝管的冷凝水,使冷水从______处流入;
⑤迅速升高温度至_______℃,收集所得馏分。
(4)若实验中所取1-丁醇、NaBr分别为7.4
g、13.0
g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6
g1-溴丁烷,则1-溴丁烷的产率是_____。(保留2位有效数字)
【答案】(1)Ⅱ
冷凝回流
(2)溴化氢
CH3CH2CH=CH2+Br2→BrCH2CHBrCH2CH3
(3)③关闭a,打开b
④d处
⑤101.6℃
(4)70%
【解析】
试题分析:(1)冷凝管进水口与液体的充满方式有关,应是下口进水,即II口。竖直冷凝管的主要作用是回流有机物,使其充分反应。
(2)溴化氢极易溶于水,而1-丁烯难溶于水,故先检验HBr;C用于检验1-丁烯,溶液溶质可以是Br2,也可以是KMnO4,但Br2的加成反应更容易写出反应方程式。
(3)蒸馏出来1-溴丁烷,需要将a活塞关闭,将b活塞打开;冷凝水还是由下口d处进入;得到产品时蒸汽的温度应控制为1-溴丁烷的沸点(101.6℃)。
(4)1-丁醇、NaBr分别为7.4
g、13.0
g,即0.1mol、0.13mol,最多得到1-溴丁烷0.1mol,即13.7g
则1-溴丁烷的产率是
=70%。
考点:化学实验的基本操作和设计、产率的计算。
20.四氯化锡用作媒染剂和有机合成上的氯化催化剂,甲、乙为实验室制备四氯化锡的反应装置示意图,有关信息数据如下:
有关信息数据:①实验室制备四氯化锡的操作是将金属锡熔融,然后泼入冷水,制成锡花,将干燥的锡花加入反应器中,再向反应器中缓缓通入干燥氯气;②无水四氯化锡是无色易流动的液体,熔点-33℃,沸点114.1℃,③无水四氯化锡暴露于空气中与空气中的水分反应生成白色烟雾,有强烈的刺激性。请回答下列问题:
Ⅰ、图甲是实验室制备干燥氯气的实验装置(夹持装置已略)
(1)A的仪器名称为__________,该装置制备氯气选用的药品为漂粉精固体[主要成分Ca(ClO)2]和浓盐酸,B中发生反应的化学方程式为__________。
(2)装置C中饱和食盐水的作用是__________,同时装置C亦是安全瓶,能检测实验进行时是否发生堵塞,请写出发生堵塞时C中的现象:__________。
(3)试剂X可能为__________(填序号)
A无水氯化钙 B浓硫酸 C.碱石灰 D五氧化二磷
(4)用锡花代替锡粒的目的是__________。
Ⅱ.图乙是蒸馏SnCl4的装置
(1)图中,收集到的SnCl4中可能存在的副产物的化学式为__________。
(2)该装置尚有两处不当之处,它们分别是__________,__________;
(3)若实验中用去锡粉5,95g,反应后,Ⅱ中锥形瓶里收集到12.0gSnCl4。则SnCl4的产率为__________。(结果保留3位有效数字)
【答案】
Ⅰ.(1)分液漏斗;Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O
(2)除去Cl2中的HCl;漏斗中液面上升,形成水柱
(3)AD
(4)增大与氯气的接触面积,加快反应速率
Ⅱ.(1)Sn(OH)4(或SnO2)
(2)温度计水银球位置不对;Ⅱ和Ⅲ之间缺少干燥装置
(3)92.0%
【解析】
试题分析:Ⅰ.(1)由仪器结构特征,可知仪器a为分液漏斗;Ca(ClO)2和浓盐酸反应生成氯化钙、氯气与水,反应方程式为:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,故答案为:分液漏斗;Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
(2)制备的氯气中含有HCl,饱和食盐水除去Cl2中的HCl;若D中发生堵塞,装置内气压增大,c中长颈漏斗中液面上升,形成水柱,故答案为:除去Cl2中的HCl; 长颈漏斗中液面上升,形成水柱;
(3)四氯化锡极易水解,通入的氯气应干燥,U形管中试剂X干燥氯气,不能为碱性干燥剂,可以吸收氯气,不能为液体干燥剂,否则气体不能通过,可以选择氯化钙、五氧化二磷,故答案为:AD;
(4)用锡花代替锡粒的目的是:增大与氯气的接触面积,加快反应速率,故答案为:增大与氯气的接触面积,加快反应速率;
Ⅱ.(1)根据信息,四氯化锡与水容易水解生成Sn(OH)4,收集到的SnCl4中可能存在的副产物可能是Sn(OH)4,故答案为:Sn(OH)4;
(2)
温度计水银球位置不对,应再蒸馏烧瓶支管口处;四氯化锡遇水强烈水解,而装置Ⅲ中的水蒸气易进入Ⅱ中,使其发生水解,二者之间缺少干燥装置;故答案为:温度计水银球位置不对;Ⅱ和Ⅲ之间缺少干燥装置;
(3)
若用去锡粉的质量为5.95g,物质的量为0.05mol,理论上生成SnCl4的质量为13.05g,产率为×100%=92.0%,故答案为:92.0%。
【考点定位】考查制备实验方案的设计
【名师点晴】本题考查物质制备实验,涉及对实验装置的理解与评价、实验操作、信息获取与迁移运用等,难度中等,理解制备原理是解题的关键,是对基础知识的综合利用,需要学生具备扎实的基础与分析问题、解决问题的能力。解得本题的关键在于能够充分利用题示信息。
21.(8分)向50mL稀硫酸和稀盐酸的混合溶液中,加入3.42g氢氧化钡粉末,充分反应后过滤,得到干燥的沉淀物2.33g,所得溶液中氢氧根离子的浓度为0.1mol/L,试求原混合液中SO42-和Cl-的物质的量浓度(假定在混合液中加入氢氧化钡粉末后体积未改变)。
【答案】0.2mol/L
0.3mol/L
【解析】
试题分析:得到干燥的沉淀物为BaSO4,根据BaSO4的量可以求出H2SO4的物质的量,进而求出SO42 的浓度,然后用Ba(OH)2的总量减去剩余的Ba(OH)2和与H2SO4的Ba(OH)2,可得与HCl反应的Ba(OH)2的量,从而求出Cl 的浓度。
【考点定位】本题考查根据化学方程式的计算。
22.(12分)【化学——有机化学基础】
饱受争议的PX项目是以苯的同系物F为原料的化工项目。F中苯环上的取代基是对位关系。用质谱法测得F的相对分子质量为106,A的相对分子质量为92,A与F属于同系物。下图是以A、F为原料制得J的合成路线图。
(1)写出F的结构简式:______________。
(2)C所含官能团的名称是____________。
(3)C→D的反应类型属于_____________;F→G的反应类型属于____________。
(4)写出满足以下三个条件的I的同分异构体的结构简式:______________。
i属于芳香族化合物
ii不与金属钠发生化学反应iii核磁共振氢谱有4组峰,且峰面积比为3:3:2:2。
(5)写出E和I反应最终生成J的化学方程式:____________________________________。
【答案】(12分)
(1)CH3——CH3(2分)
(2)(醇)羟基(2分)
(3)氧化反应(2分);取代反应(2分)
(4)CH3——OH3(2分
(5)(2分)
【解析】
试题分析:F为苯的同系物,相对分子质量为106,根据苯的同系物的通式可得n=8,因为F中苯环上的取代基是对位关系,所以F为CH3——CH3;A与F属于同系物,A的相对分子质量为92,则A为:—CH3;A液溴在光照条件下发生—CH3上的取代反应,生成的B为—CH2Br,B与NaOH溶液发生水解反应生成的C为:—CH2OH,C在Cu催化下与O2反应生成的D为:—CHO,D继续氧化得到的E为—COOH,F与液溴在Fe催化下发生苯环上的取代反应,生成的G为:,根据题目所给信息G在10%NaOH|Cu粉等条件下生成的H为,H在H+、H2O条件下转化为I:,E、I通过酯化反应可得J。
(1)根据上述推断可知F的结构简式:CH3——CH3
(2)C的结构简式为:—CH2OH,含有的官能团为:(醇)羟基。
(3)C→D羟基被氧化为醛基,所以反应类型属于氧化反应;F→G发生苯环上的取代,所以反应类型属于取代反应。
(4)i属于芳香族化合物,含有苯环;ii不与金属钠发生化学反应,不能羟基和羧基;iii核磁共振氢谱有4组峰,且峰面积比为3:3:2:2,所以该同分异构体为CH3——OH3
(5)E、I通过酯化反应制取J,所以化学方程式为:
。
考点:本题考查有机合成的分析与推断、同分异构体、反应类型的判断、化学方程式的书写。
23.A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体。它们之间的转化如图所示(某些反应条件和部分反应产物已略去)。
(1)写出下列物质的化学式:D
X
。
(2)在反应①~⑦中,不属于氧化还原反应的是
(填编号)。
(3)反应⑥的离子方程式为:
。
(4)往G溶液中加入NaOH溶液观察到的现象是
。
(5)反应⑦的化学方程式为
;该反应中每消耗0.3mol的A,可转移电子
mol。
(6)除去D溶液中混有的少量G的方法是:
。
【答案】(1)FeCl3
)
HCl);(2)③⑥
(3)Fe3++3SCN-=Fe(SCN)3)(4)生成白色沉淀,迅速变为灰绿色,最终变为红褐色。
(5)3Fe+4H2O(g)
Fe3O4+4H2
0.8
(6)向混合液中通入足量氯气(或加入足量H2O2)
【解析】
试题分析:A为固体,B为黄绿色气体,说明B为Cl2
,D与F反应得到血红色溶液,结合转化关系可知,固体A为Fe,D为FeCl3
,F为KSCN,由D与G之间的相互转化,可知G为FeCl2
,Fe与无色气体C反应得到E,E与X反应得到D、G、H,且X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体,可推知C为O2
,E为Fe3O4
,X为HCl,H为H2O。(1)由上述分析可知,D为FeCl3,X为HCl;(2)在反应①~⑦中,①为铁和氯气发生反应产生FeCl3,反应属于氧化还原反应;②为铁和氧气产生Fe3O4的反应,发生的氧化还原反应;③为四氧化三铁和盐酸发生反应产生FeCl2、FeCl3和水的复分解反应,不是氧化还原反应;④为氯化铁和铁发生反应产生FeCl2,反应属于氧化还原反应;⑤为氯化亚铁和氯气发生反应产生FeCl3,反应属于氧化还原反应;⑥是氯化铁和硫氰酸盐发生的复分解反应,不是氧化还原反应,反应⑦是铁与水在高温下的置换反应,是氧化还原反应,所以属于氧化还原反应的有①②④⑤⑦,不是氧化还原反应的是③⑥共2个;(3)反应④的离子方程式是:Fe3++3SCN-=Fe(SCN)3;(4)G是FeCl2,往G溶液中加入NaOH溶液,发生反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,Fe(OH)2不稳定,容易被空气中的氧气氧化产生Fe(OH)3,反应的方程式是:4Fe(OH)2+O2+2H2O=4Fe(OH)3,会观察到首先产生白色沉淀,后白色沉淀迅速变为灰绿色,最终变为红褐色。(5)反应⑦是铁在水蒸气中发生的反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)
Fe3O4+4H2;根据方程式可知:每有3molFe发生反应转移电子的物质的量是8mol,则有0.3molFe反应,转移电子的物质的量是0.8mol;(6)若要除去FeCl3
溶液中含有FeCl2
,可以利用FeCl2的还原性,向混合溶液中通入足量的氯气,发生反应:2FeCl2+Cl2=2FeCl3,就得到纯净的FeCl3
溶液。
【考点定位】考查元素及化合物的推断、化学方程式和离子方程式的书写、物质的净化方法、反应类型的判断的知识。
【名师点睛】本题考查了元素及化合物的性质。B为黄绿色气体,可知B是Cl2,D与F混合溶液为血红色,结合A为固体,与Cl2反应产生D,则说明A是铁;X常温下是无色气体,其水溶液是一种无氧强酸溶液,可知X的HCl,水溶液是盐酸,C为无色气体,与铁在点燃情况下反应的产生物质与盐酸反应产生的物质G与Cl2生成FeCl3,FeCl3与Fe反应产生FeCl2,其它可以根据物质的转化关系进行逐一推断得到。根据质量守恒定律可得反应的方程式,若反应为离子反应还应该符合电荷守恒;若为氧化还原反应,则应该符合电子守恒。
1.把铁粉投入氯化铜和氯化铁的混合溶液中,充分反应后,下列说法中正确的是
A.若无铜析出,则溶液中有Cu2+、Fe2+,可能有Fe3+
B.若有铜析出,则溶液中含有Fe2+,没有Cu2+和Fe3+
C.若铁有剩余,则溶液中含有Fe2+,没有Cu2+
和Fe3+
D.若铁无剩余,则溶液中含有Fe2+,无Fe3+
,可能含有Cu2+
【答案】AC
【解析】Fe投入FeCl3、CuCl2溶液中,由于Fe3+氧化性比Cu2+
强.故只有当Fe+2Fe3+====3Fe2+反应彻底后,反应Fe+Cu2+====Cu+Fe2+才发生。
2.有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中c(Cl-)与c()?之比为
(
)
A.1∶1
B.2∶3
C.3∶2
D.2∶1
【答案】B
【解析】
试题分析:本题一开始出现的沉淀是氢氧化铝和氢氧化镁,而后面溶解的原因是加入的过量的氢氧化钠把氢氧化铝溶解了。溶解需要的氢氧化钠为0.25V,则前面沉淀氢氧化铝的量是0.75V,沉淀氢氧化镁的量是0.25V,则氯离子与硫酸根离子的比值为:
0.25V:(0.75V/2)=2:3。
考点:物质的量的计算
点评:本题涉及到了氢氧化铝两性氢氧化物的性质,在解题过程可以利用一定的技巧,比如氢氧化镁所需氢氧化钠为0.25V,则氯离子的量也可以视为0.25V,因为镁离子与氢氧根离子结合是1:2,而镁离子与氯离子结合也是1:2。
3.物质的量相同的甲烷(CH4)和氨气(NH3),一定相同的是(
)
A.质量
B.体积
C.质子数
D.原子数
【答案】C
【解析】
试题分析:A、甲烷的相对分子质量为16,氨气的相对分子质量为17,物质的量相同时,二者质量不同,故A错误;B、因没有明确气体存在的条件,物质的量相等时,二者体积不一定相等,故B错误;C、1个甲烷分子含有10个质子,1个氨气分子含有10个质子,相同物质的量的甲烷和氨气的质子数相等,故C正确;D、1个甲烷含有5个原子,1个氨气含有4个原子,,相同物质的量的甲烷和氨气的含有的原子数不同,故D错误;故选C。
考点:考查了物质的量的有关计算的相关知识。
4.在元素周期表中,金属元素与非金属元素分界线附近,能找到(
)
A.制半导体材料的元素
B.制农药的元素
C.制催化剂的元素
D.制耐高温合金的元素
【答案】A
【解析】
试题分析:在元素周期表中,金属元素与非金属元素分界线附近都元素往往既难失去电子,又难得到电子,因此常用来制作半导体。B在非金属元素中寻找,C和D在过渡元素中寻找,答案选A.
考点:元素周期表的应用
5.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子分别通过交换膜向负极和正极移动,
保持溶液中电荷平衡
【答案】C
【解析】
试题分析:A、锌铜原电池装置,铜作正极,发生还原反应,A项错误;B、电池工作一段时间后,甲池的c(SO)不变,B项错误;C、电池工作一段时间后,乙池溶液氢离子替换铜离子,所以质量减小,C项错误;D、阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡,D项正确;答案选C。
考点:考查锌铜原电池
6.下列分子中所有原子都满足最外层8电子结构的是(
)
A
.
PCl5
B
.
HClO
C
.SCl2
D.BF3
【答案】C
【解析】只要分子中元素化合价的绝对值和该元素最外层电子数之和满足8,即能满足最外层8电子结构,因此选项C正确。A中的P,B中的H,D中B,都不能满足最外层8电子结构,答案选C。
7.在一定温度下,用铂电极电解饱和硫酸钠溶液,对电解质溶液的判断正确的是( )
A.不会有晶体析出
B.浓度变大
C.浓度变小
D.pH不变
【答案】D
【解析】用惰性电极电解饱和硫酸钠溶液,相当于是电解水,即溶剂要减少,所以溶液中有晶体析出,但溶液仍然是饱和溶液,浓度不变,pH不变。答案D。
8.常温下,pH=1的盐酸与pH=12的NaOH溶液恰好完全反应,二者的体积比为
A.1:1
B.10:1
C.
100:1
D.1:10
【答案】D
【解析】
试题分析:pH为1的盐酸中c(H+)=0.1mol/L,pH为12的NaOH溶液中c(OH-)=1×10-2mol/L,二者恰好完全反应,应满足n(H+)=n(OH-),设盐酸体积为为xL,NaOH溶液体积为yL,则0.1x=1×10-2y,解得:x:y=1:10.答案选D
考点:pH计算
9.下列实验操作或装置(略去部分加持仪器)正确的是(
)
【答案】C
【解析】
试题分析:A、定容时应该用胶头滴管,A错误;B、试管口应该略低于试管底,B错误;C、钠是固体应该在坩埚中燃烧,C正确;D、收集氨气时导管口应该插到试管底,D错误,答案选C。
【考点定位】本题主要是考查化学实验基本操作正误判断
【名师点晴】该题的易错选项是D,关于氨气的制备,应该从原理、装置、净化、收集、验满等角度去分析。关于气体的收集可归纳如下:排水法,适用于不易溶于水的气体。例如氢气,氧气;向上排空气法,适用于比空气密度大,溶于水的气体,例如二氧化碳,氯气;向下排空气法,适用于比空气密度小,溶于水的气体,例如氨气等。
另外D选项中还应该注意棉花的作用。
10.如图所示是五种短周期元素化合价与原子序数的关系,下列说法不正确的是
A.原子半径:R>W>Z>Y>X
B.R的气态氢化物比W的气态氢化物稳定
C.X与Y可形成既含离子键又含共价键的化合物
D.Y的最高价氧化物对应水化物与Z的最高价氧化物
对应水化物能发生反应
【答案】A
【解析】
试题分析:由题意可知,X、Y、Z、W、R分别为O、Na、Al、S、Cl,原子半径的顺序应为Y>Z>W>R>X;C项,X与Y可形成Na2O和Na2O2,其中Na2O2既含离子键又含共价键;D项,Al(OH)3具有两性,可与NaOH溶液反应。
考点:以图表的形式给出信息,考查原子结构、元素周期律与元素周期表的相关知识
11.用惰性电极电解CuSO4溶液一段时间,停止后,向所得溶液中加入0.2molCu(OH)2,恰好使溶液恢复至电解前,关于电解过程说法不正确的是
A.生成的铜的物质的量是0.2mol
B.随着电解进行溶液的pH减小
C.转移电子的物质的量为0.4mol
D.阳极反应是2H2O
-4e-=4H+
+O2↑
【答案】C
【解析】
试题分析:用惰性电极电解CuSO4溶液一段时间,停止后,向所得溶液中加入0.2molCu(OH)2,恰好使溶液恢复至电解前,这说明电极产物是硫酸、铜、氧气和氢气。0.2mol氢氧化铜可以看作是0.2mol氧化铜和0.2mol水,因此生成的铜、氢气和氧气均是0.2mol,其中铜和氢气在阴极产生,氧气在阳极产生,转移电子的物质的量是0.2mol×4=0.8mol,答案选C。
考点:考查电解原理的应用
12.下列方程式正确的是
A、铁和稀硝酸反应:Fe
+
2H+
=
H
2↑+
Fe
2+
B、向氯化铵的溶液中加入足量浓NaOH溶液并加热:NH4++OH-△NH3↑+H2O
C、Ba(OH)2溶液与H2SO4溶液混合产生沉淀:Ba2++
SO42-=BaSO4↓
D、往NaOH溶液通入过量SO2:
SO2+2OH-==
SO3
2-
+H2O
【答案】B
【解析】A
错误,铁和稀硝酸反应产生NO,不产生氢气。
B
正确。
C
错误,氢离子和氢氧根离子也同时反应生成水。
D
错误,往NaOH溶液通入过量SO2会生成亚硫酸氢根离子。
13.W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.简单阴离子还原性X大于Y
D.Z元素单质在化学反应中只表现氧化性
【答案】A
【解析】
试题分析:W的气态氢化物可与其最高价含氧酸反应生成离子化合物,则W是N元素,X是O元素,Y是S元素,Z是Cl元素。A.元素的非金属性:Z>X>Y,元素的非金属性越强,其相应的氢化物的稳定性就越强,所以X、Y、Z中最简单氢化物稳定性最弱的是Y,正确;B.Z元素最高价氧化物对应水化物的酸性一定强于Y的,但若不是最高价含氧酸,则酸性不一定比Y的强,如HClO
考点:考查元素的推断、元素周期表、元素周期律的应用的知识。
14.NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L四氯化碳的分子数约为NA个
B.盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol
C.16gO2和O3的混合气体中所含的原子数为NA个
D.1.8g的D2O中含有的电子数为NA个
【答案】BC
【解析】略
15.丙烯醛的结构是CH2=CH-CHO,下列关于它的性质的叙述中,错误的是
A、能使溴水和高锰酸钾溶液褪色
B、能被新制的氢氧化铜悬浊液氧化
C、在一定条件下,与氢气充分反应生成丙醇
D、能发生银镜反应,体现氧化性
【答案】D
【解析】判断有机物的性质,关键是找出有机物中含有的官能团。根据有机物的结构简式可知,分子中含有的官能团有碳碳双键和醛基,所以选项ABC都是正确的。能方式银镜反应,但体现的是醛基的还原性,D不正确,答案选D。
16.W、Q、A、B、X、Y、Z为原子序数依次增大的短周期元素,已知W与X在同一主族;Q的阴离子和A的阳离子具有相同的电子层结构,且两元素的单质反应,生成一种淡黄色的固体F;A、B、Z三种元素的原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水;X元素的最外层电子数比次外层电子数少4;Y元素的L层电子数等于K、M两个电子层上的电子数之和。
(1)W元素在周期表中的位置是
;
淡黄色固体F中含有的化学键是
。
(2)A与Y两元素可形成化合物,用电子式表示此化合物的形成过程:
。
(3)写出A、B两元素的最高价氧化物的水化物发生反应的离子方程式:
。
(4)A、B、Y、Z四种元素的简单离子的离子半径由大到小的顺序为:
。(用离子符号表示)
(5)X、Y、Z三种元素的氢化物的稳定性由强到弱的顺序为:
。(用化学式表示)
【答案】(每空2分,共12分)
(1)第二周期、第IVA族(答不全不得分)
;
离子键、非极性共价键(答不全不得分)
(2)
(3)Al(OH)3+
OH-
=
AlO2-+2H2O
(4)S2—>Cl—>Na+>Al3+
(5)HCl>H2S>SiH4
【解析】
试题分析:根据Q的阴离子和A的阳离子具有相同的电子层结构,且两元素的单质反应,生成一种淡黄色的固体F,F为Na2O2,Q为O,A为Na。根据A、B、Z三种元素的原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,B为Al,Z为Cl。根据X元素的最外层电子数比次外层电子数少4,X为Si。根据W与X在同一主族,W为C。根据Y元素的L层电子数等于K、M两个电子层上的电子数之和,Y为S。
(1)W为C,故在周期表中的位置是第二周期、第IVA族。
淡黄色固体F为Na2O2,含有的化学键是离子键、非极性共价键。
(2)A与Y两元素形成化合物为Na2S,电子式表示此化合物的形成过程为。
(3)A、B两元素的最高价氧化物的水化物分别为NaOH,Al(OH)3,反应的离子方程式为Al(OH)3+
OH-
=
AlO2-+2H2O。
(4)A、B、Y、Z四种元素的简单离子的离子分别为Na+、Al3+、S2—、Cl—,电子层数越多,半径越大;具有相同电子排布的离子,核电核数越大半径越小。故离子半径由大到小的顺序为S2—>Cl—>Na+>Al3+。
(5)X、Y、Z三种元素的氢化物分别为SiH4、H2S、HCl,元素的非金属性越强,对应其氢化物的稳定性越强,故氢化物的稳定性由强到弱的顺序为HCl>H2S>SiH4
。
考点:原子结构与元素周期率的关系
电子式
化学方程式的书写
点评:本题考查原子的符号,电子式,化学方程式的书写,难度不大。
17.(16分)工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
已知:
Cu2O
+
2H+
=
Cu
+
Cu2+
+
H2O
沉淀物
Cu(OH)2
Al(OH)3
Fe(OH)3
Fe(OH)2
开始沉淀pH
5.4
4.0
1.1
5.8
沉淀完全pH
6.7
5.2
3.2
8.8
(1)反应I中如果Cu2O与
Fe2O3之间恰好完全反应,则发生反应的化学方程式为:__________________
(2)用NaClO调pH=x是此工艺流程中的最佳选择。
①选择NaClO的理由是:____________________________________________________
②生成沉淀B的同时生成一种具有漂白作用的物质,写出该反应的离子方程式为:
____________________
(3)测定pH=y的仪器是___________________
(4)如果某次测定pH=y的操作失误,将适量NaOH溶液滴加到0.02mol·L-1CuSO4溶液中,致使溶液中Cu2+浓度降至原来的百分之一,则溶液的pH为
____。(已知常温下,Cu(OH)2的溶度积常数Ksp=2×10-20)
(5)电解初期阳极的电极反应式为________________________________
【答案】(1)Cu2O
+
Fe2O3
+
4H2SO4=
2CuSO4
+
2FeSO4
+
4H2O
(2)①NaClO由于发生反应ClO-+
H+HClO,ClO-消耗了H+,ClO-又具有氧化性,可将Fe2+氧化成Fe3+。所以最好用NaClO调节pH。
②5ClO-+
2Fe2+
+
5H2O
=
2Fe(OH)3
+
Cl-+
4HClO
(或
2Fe2+
+7ClO-+
2H++
5H2O
=
2Fe(OH)3
+
Cl-+
6HClO)
(3)pH计;
(4)6
;
(5)2Cl--
2e-
=
Cl2↑.
【解析】
试题分析:Cu2O与Fe2O3在酸性条件下发生氧化还原反应,方程式是Cu2O+Fe2O3+4H2SO4=2CuSO4
+2FeSO4
+4H2O;(2)①选择NaClO的理由是该盐能够发生反应消耗H+,调节溶液的pH,同时ClO-又具有氧化性,可将Fe2+氧化成Fe3+。所以最好用NaClO调节pH。②生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为:5ClO-+
2Fe2+
+
5H2O
=
2Fe(OH)3
+
Cl-+
4HClO;(3)测定溶液的pH的仪器是pH计;
(4)c(Cu2+)=2×10-4mol/L
,
c(Cu2+)·c2(OH-)=Ksp=2×10-20;
c2(OH-)=Ksp÷c(Cu2+)
=
2×10-20÷2×10-4=1×10-16;所以c(OH-)=1×10-8.因此c(H+)=Kw÷c(OH-)=1×10-6,所以pH=6.
(5)因为在该溶液中含有Cl-.放电能力:Cl->
OH-。因此在放电初期,阳极电极反应式是:2Cl--
2e-
=
Cl2↑.
考点:考查仪器的使用、反应条件的选择、化学方程式、离子方程式及电极反应式的书写、溶液pH计算。
18.(I)pH的测定是中学化学中重要的定量实验。
(1)下列关于pH测定的说法正确的是
。
a.用pH试纸测得某盐酸的pH=2.
3
b.将pH试纸直接插入待测溶液,取出后再与标准比色卡对比
c.用pH试纸测新制氯水的pH
d.能使pH试纸显红色的溶液显酸性
(2)某同学先用蒸馏水润湿pH试纸,再用该试纸分别测定c(OH-)相等的NaOH溶液和氨水的pH,误差较大的是
。
(II)常温下,甲、乙、丙三位同学用实验确定某酸HA是弱电解质的方案分别是:
甲:用pH试纸测定0.1
moI/L
HA溶液的pH,即可证明HA是弱电解质。
乙:①分别取pH=l的HA溶液和稀盐酸各10.00
mL,再加水稀释为100
mL。
②各取相同体积的两种稀释液(适量),同时分别加入纯度和形状大小均相同的锌粒(足量),观察现象,即可证明HA是弱电解质。
丙:将适量的HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,分析表中数据可以说明HA是弱电解质。
编号
NaOH/mol·L-1
HA/mol·L-1
混合溶液的pH
①
0.1
0.1
pH=9
②
c
0.2
pH=7
③
0.1
0.2
pH<7
(1)甲的方案中,说明HA是弱电解质的理由是测得溶液的pH_______1(填“>”、“<”或“=”)。
(2)在乙的方案的第①步中,需要用到的定量仪器是
。
(3)乙的方案中,说明HA是弱电解质的主要现象是_________(填字母)。
A.装稀盐酸的试管中放出H2的速率快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中产生气体的速率一样快
(4)丙的方案中,编号②中的c_______(填“>”、“<”或“=”)0.l。
(5)丙的方案中,编号③的数据表明,混合溶液中HA的电离程度比NaA的水解程度:________(填“强”、“弱”或“无法确定”)。
【答案】(本题共7
分,每空1分))(I)(1)d
(2)NaOH溶液
(II)(1)
>
(2)酸式滴定管
(3)
B
(4)>
=
(5)强
【解析】
试题分析:(I)(1)a.用pH试纸测得的溶液pH为整数值,故错误;b.应用玻璃棒蘸溶液点在pH试纸中央,待变色后再与标准比色卡对比,读出溶液pH,故错误;c.氯水有漂白性,用pH试纸无法测新制氯水的pH,故错误;d.酸性溶液能使pH试纸显红色,故正确,答案为d;(2)氨水中的NH3·H2O在加水稀释时会促进电离,而NaOH溶液直接稀释,故用蒸馏水润湿pH试纸,再用该试纸分别测定c(OH-)相等的NaOH溶液和氨水的pH,误差较大的是NaOH溶液;(II)(1)配制0.1mol/L的HA酸溶液100mL,弱电解质的电离是可逆的,不能完全电离,用pH试纸测出该溶液的pH值,如果是pH>1即为弱酸,pH=1即为强酸,先把一小块pH试纸放在表面皿或玻璃片上,再用玻璃棒蘸取溶液点在试纸的中部,待变色后,与标准比色卡对比确定溶液的pH;(2)精确取pH=1的HA溶液和稀盐酸个10.00mL,用酸式滴定管;(3)pH相等的一元酸,弱酸的浓度大于强酸,等体积等PH的醋酸和盐酸稀释相同倍数时,醋酸中氢离子浓度大于盐酸,分别和锌反应时,弱酸生成氢气的反应速率大于强酸,故B正确;(4)若酸为强酸,等体积等浓度混合时pH=7;而HA为弱酸,等体积等浓度混合溶液的pH大于7,则为保证pH=7,应使酸浓度大于0.1mol/L;由电荷守恒可知c(Na+)+c(H+)=c(A-)+c(OH-),c(H+)=c(OH-),则c(A-)=c(Na+);(5)由③组实验结果可知,等体积混合后,得到同浓度HA与NaA的混合液,pH<7,说明酸的电离程度大于盐的水解程度。
考点:考查酸碱混合溶液pH的计算及离子浓度大小的比较。
19.某兴趣小组同学在实验室用加热1-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如图所示装置,其中夹持仪器、加热仪器及冷却水管没有画出。
请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。
竖直冷凝管接通冷凝水,进水口是_____(填“I”或“Ⅱ”);竖直冷凝管的主要作用是________。
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等。熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物,已知B、C装置中为常见物质的水溶液。
B装置检验的物质是_________,写出C装置中主要的化学方程式:_______________。
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
物质
熔点/℃
沸点/℃
1-丁醇
-89.5
117.3
1-溴丁烷
-112.4
101.6
丁醚
-95.3
142.4
1-丁烯
-185.3
-6.5
请你补充下列实验步骤,直到分离出1-溴丁烷。
①待烧瓶冷却后,拔去竖直的冷凝管;
②插上带橡皮塞的温度计;
③关闭_______,打开_______;
④接通冷凝管的冷凝水,使冷水从______处流入;
⑤迅速升高温度至_______℃,收集所得馏分。
(4)若实验中所取1-丁醇、NaBr分别为7.4
g、13.0
g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6
g1-溴丁烷,则1-溴丁烷的产率是_____。(保留2位有效数字)
【答案】(1)Ⅱ
冷凝回流
(2)溴化氢
CH3CH2CH=CH2+Br2→BrCH2CHBrCH2CH3
(3)③关闭a,打开b
④d处
⑤101.6℃
(4)70%
【解析】
试题分析:(1)冷凝管进水口与液体的充满方式有关,应是下口进水,即II口。竖直冷凝管的主要作用是回流有机物,使其充分反应。
(2)溴化氢极易溶于水,而1-丁烯难溶于水,故先检验HBr;C用于检验1-丁烯,溶液溶质可以是Br2,也可以是KMnO4,但Br2的加成反应更容易写出反应方程式。
(3)蒸馏出来1-溴丁烷,需要将a活塞关闭,将b活塞打开;冷凝水还是由下口d处进入;得到产品时蒸汽的温度应控制为1-溴丁烷的沸点(101.6℃)。
(4)1-丁醇、NaBr分别为7.4
g、13.0
g,即0.1mol、0.13mol,最多得到1-溴丁烷0.1mol,即13.7g
则1-溴丁烷的产率是
=70%。
考点:化学实验的基本操作和设计、产率的计算。
20.四氯化锡用作媒染剂和有机合成上的氯化催化剂,甲、乙为实验室制备四氯化锡的反应装置示意图,有关信息数据如下:
有关信息数据:①实验室制备四氯化锡的操作是将金属锡熔融,然后泼入冷水,制成锡花,将干燥的锡花加入反应器中,再向反应器中缓缓通入干燥氯气;②无水四氯化锡是无色易流动的液体,熔点-33℃,沸点114.1℃,③无水四氯化锡暴露于空气中与空气中的水分反应生成白色烟雾,有强烈的刺激性。请回答下列问题:
Ⅰ、图甲是实验室制备干燥氯气的实验装置(夹持装置已略)
(1)A的仪器名称为__________,该装置制备氯气选用的药品为漂粉精固体[主要成分Ca(ClO)2]和浓盐酸,B中发生反应的化学方程式为__________。
(2)装置C中饱和食盐水的作用是__________,同时装置C亦是安全瓶,能检测实验进行时是否发生堵塞,请写出发生堵塞时C中的现象:__________。
(3)试剂X可能为__________(填序号)
A无水氯化钙 B浓硫酸 C.碱石灰 D五氧化二磷
(4)用锡花代替锡粒的目的是__________。
Ⅱ.图乙是蒸馏SnCl4的装置
(1)图中,收集到的SnCl4中可能存在的副产物的化学式为__________。
(2)该装置尚有两处不当之处,它们分别是__________,__________;
(3)若实验中用去锡粉5,95g,反应后,Ⅱ中锥形瓶里收集到12.0gSnCl4。则SnCl4的产率为__________。(结果保留3位有效数字)
【答案】
Ⅰ.(1)分液漏斗;Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O
(2)除去Cl2中的HCl;漏斗中液面上升,形成水柱
(3)AD
(4)增大与氯气的接触面积,加快反应速率
Ⅱ.(1)Sn(OH)4(或SnO2)
(2)温度计水银球位置不对;Ⅱ和Ⅲ之间缺少干燥装置
(3)92.0%
【解析】
试题分析:Ⅰ.(1)由仪器结构特征,可知仪器a为分液漏斗;Ca(ClO)2和浓盐酸反应生成氯化钙、氯气与水,反应方程式为:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,故答案为:分液漏斗;Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
(2)制备的氯气中含有HCl,饱和食盐水除去Cl2中的HCl;若D中发生堵塞,装置内气压增大,c中长颈漏斗中液面上升,形成水柱,故答案为:除去Cl2中的HCl; 长颈漏斗中液面上升,形成水柱;
(3)四氯化锡极易水解,通入的氯气应干燥,U形管中试剂X干燥氯气,不能为碱性干燥剂,可以吸收氯气,不能为液体干燥剂,否则气体不能通过,可以选择氯化钙、五氧化二磷,故答案为:AD;
(4)用锡花代替锡粒的目的是:增大与氯气的接触面积,加快反应速率,故答案为:增大与氯气的接触面积,加快反应速率;
Ⅱ.(1)根据信息,四氯化锡与水容易水解生成Sn(OH)4,收集到的SnCl4中可能存在的副产物可能是Sn(OH)4,故答案为:Sn(OH)4;
(2)
温度计水银球位置不对,应再蒸馏烧瓶支管口处;四氯化锡遇水强烈水解,而装置Ⅲ中的水蒸气易进入Ⅱ中,使其发生水解,二者之间缺少干燥装置;故答案为:温度计水银球位置不对;Ⅱ和Ⅲ之间缺少干燥装置;
(3)
若用去锡粉的质量为5.95g,物质的量为0.05mol,理论上生成SnCl4的质量为13.05g,产率为×100%=92.0%,故答案为:92.0%。
【考点定位】考查制备实验方案的设计
【名师点晴】本题考查物质制备实验,涉及对实验装置的理解与评价、实验操作、信息获取与迁移运用等,难度中等,理解制备原理是解题的关键,是对基础知识的综合利用,需要学生具备扎实的基础与分析问题、解决问题的能力。解得本题的关键在于能够充分利用题示信息。
21.(8分)向50mL稀硫酸和稀盐酸的混合溶液中,加入3.42g氢氧化钡粉末,充分反应后过滤,得到干燥的沉淀物2.33g,所得溶液中氢氧根离子的浓度为0.1mol/L,试求原混合液中SO42-和Cl-的物质的量浓度(假定在混合液中加入氢氧化钡粉末后体积未改变)。
【答案】0.2mol/L
0.3mol/L
【解析】
试题分析:得到干燥的沉淀物为BaSO4,根据BaSO4的量可以求出H2SO4的物质的量,进而求出SO42 的浓度,然后用Ba(OH)2的总量减去剩余的Ba(OH)2和与H2SO4的Ba(OH)2,可得与HCl反应的Ba(OH)2的量,从而求出Cl 的浓度。
【考点定位】本题考查根据化学方程式的计算。
22.(12分)【化学——有机化学基础】
饱受争议的PX项目是以苯的同系物F为原料的化工项目。F中苯环上的取代基是对位关系。用质谱法测得F的相对分子质量为106,A的相对分子质量为92,A与F属于同系物。下图是以A、F为原料制得J的合成路线图。
(1)写出F的结构简式:______________。
(2)C所含官能团的名称是____________。
(3)C→D的反应类型属于_____________;F→G的反应类型属于____________。
(4)写出满足以下三个条件的I的同分异构体的结构简式:______________。
i属于芳香族化合物
ii不与金属钠发生化学反应iii核磁共振氢谱有4组峰,且峰面积比为3:3:2:2。
(5)写出E和I反应最终生成J的化学方程式:____________________________________。
【答案】(12分)
(1)CH3——CH3(2分)
(2)(醇)羟基(2分)
(3)氧化反应(2分);取代反应(2分)
(4)CH3——OH3(2分
(5)(2分)
【解析】
试题分析:F为苯的同系物,相对分子质量为106,根据苯的同系物的通式可得n=8,因为F中苯环上的取代基是对位关系,所以F为CH3——CH3;A与F属于同系物,A的相对分子质量为92,则A为:—CH3;A液溴在光照条件下发生—CH3上的取代反应,生成的B为—CH2Br,B与NaOH溶液发生水解反应生成的C为:—CH2OH,C在Cu催化下与O2反应生成的D为:—CHO,D继续氧化得到的E为—COOH,F与液溴在Fe催化下发生苯环上的取代反应,生成的G为:,根据题目所给信息G在10%NaOH|Cu粉等条件下生成的H为,H在H+、H2O条件下转化为I:,E、I通过酯化反应可得J。
(1)根据上述推断可知F的结构简式:CH3——CH3
(2)C的结构简式为:—CH2OH,含有的官能团为:(醇)羟基。
(3)C→D羟基被氧化为醛基,所以反应类型属于氧化反应;F→G发生苯环上的取代,所以反应类型属于取代反应。
(4)i属于芳香族化合物,含有苯环;ii不与金属钠发生化学反应,不能羟基和羧基;iii核磁共振氢谱有4组峰,且峰面积比为3:3:2:2,所以该同分异构体为CH3——OH3
(5)E、I通过酯化反应制取J,所以化学方程式为:
。
考点:本题考查有机合成的分析与推断、同分异构体、反应类型的判断、化学方程式的书写。
23.A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体。它们之间的转化如图所示(某些反应条件和部分反应产物已略去)。
(1)写出下列物质的化学式:D
X
。
(2)在反应①~⑦中,不属于氧化还原反应的是
(填编号)。
(3)反应⑥的离子方程式为:
。
(4)往G溶液中加入NaOH溶液观察到的现象是
。
(5)反应⑦的化学方程式为
;该反应中每消耗0.3mol的A,可转移电子
mol。
(6)除去D溶液中混有的少量G的方法是:
。
【答案】(1)FeCl3
)
HCl);(2)③⑥
(3)Fe3++3SCN-=Fe(SCN)3)(4)生成白色沉淀,迅速变为灰绿色,最终变为红褐色。
(5)3Fe+4H2O(g)
Fe3O4+4H2
0.8
(6)向混合液中通入足量氯气(或加入足量H2O2)
【解析】
试题分析:A为固体,B为黄绿色气体,说明B为Cl2
,D与F反应得到血红色溶液,结合转化关系可知,固体A为Fe,D为FeCl3
,F为KSCN,由D与G之间的相互转化,可知G为FeCl2
,Fe与无色气体C反应得到E,E与X反应得到D、G、H,且X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体,可推知C为O2
,E为Fe3O4
,X为HCl,H为H2O。(1)由上述分析可知,D为FeCl3,X为HCl;(2)在反应①~⑦中,①为铁和氯气发生反应产生FeCl3,反应属于氧化还原反应;②为铁和氧气产生Fe3O4的反应,发生的氧化还原反应;③为四氧化三铁和盐酸发生反应产生FeCl2、FeCl3和水的复分解反应,不是氧化还原反应;④为氯化铁和铁发生反应产生FeCl2,反应属于氧化还原反应;⑤为氯化亚铁和氯气发生反应产生FeCl3,反应属于氧化还原反应;⑥是氯化铁和硫氰酸盐发生的复分解反应,不是氧化还原反应,反应⑦是铁与水在高温下的置换反应,是氧化还原反应,所以属于氧化还原反应的有①②④⑤⑦,不是氧化还原反应的是③⑥共2个;(3)反应④的离子方程式是:Fe3++3SCN-=Fe(SCN)3;(4)G是FeCl2,往G溶液中加入NaOH溶液,发生反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,Fe(OH)2不稳定,容易被空气中的氧气氧化产生Fe(OH)3,反应的方程式是:4Fe(OH)2+O2+2H2O=4Fe(OH)3,会观察到首先产生白色沉淀,后白色沉淀迅速变为灰绿色,最终变为红褐色。(5)反应⑦是铁在水蒸气中发生的反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)
Fe3O4+4H2;根据方程式可知:每有3molFe发生反应转移电子的物质的量是8mol,则有0.3molFe反应,转移电子的物质的量是0.8mol;(6)若要除去FeCl3
溶液中含有FeCl2
,可以利用FeCl2的还原性,向混合溶液中通入足量的氯气,发生反应:2FeCl2+Cl2=2FeCl3,就得到纯净的FeCl3
溶液。
【考点定位】考查元素及化合物的推断、化学方程式和离子方程式的书写、物质的净化方法、反应类型的判断的知识。
【名师点睛】本题考查了元素及化合物的性质。B为黄绿色气体,可知B是Cl2,D与F混合溶液为血红色,结合A为固体,与Cl2反应产生D,则说明A是铁;X常温下是无色气体,其水溶液是一种无氧强酸溶液,可知X的HCl,水溶液是盐酸,C为无色气体,与铁在点燃情况下反应的产生物质与盐酸反应产生的物质G与Cl2生成FeCl3,FeCl3与Fe反应产生FeCl2,其它可以根据物质的转化关系进行逐一推断得到。根据质量守恒定律可得反应的方程式,若反应为离子反应还应该符合电荷守恒;若为氧化还原反应,则应该符合电子守恒。
同课章节目录
