江西省上饶市2024-2025学年高一下学期期末教学质量检测化学试卷(含答案)
文档属性
| 名称 | 江西省上饶市2024-2025学年高一下学期期末教学质量检测化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 853.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-22 16:00:37 | ||
图片预览


文档简介
江西省上饶市2024-2025学年高一下学期期末教学质量测试 化学试卷
一、单选题
1.化学在生产生活和科技发展中发挥着重要作用,下列说法错误的是
A.聚氯乙烯可用于制作多种绝缘材料,聚氯乙烯是纯净物
B.铝合金和钛合金也是制造机器人的重要原材料,钛合金强度高耐腐蚀,铝合金轻质成本低,都是极为重要的金属材料
C.“东方超环”(人造太阳)用到的氘、氚两种原子互为同位素
D.2025年4月24号“神舟二十号”载人飞船拔地而起,航天器使用的纳米陶瓷材料是新型无机非金属材料
2.化学与职业息息相关,下列化学职业有关说法不正确的是
选项 职业 工作内容
A 化工工程师 依据科学原理,统筹各方资源,设计化工生产的工艺流程,并监控生产过程及时解决生产中遇到的技术问题
B 水质检测员 对水样的成分进行分析如:酸碱度、重金属、有机污染、微生物等,确保水质达标
C 电池研发人员 电池构成材料的研制、电池性能的改进和应用的拓展
D 考古研究人员 利用的放射性对博物馆中荆王府墓葬出土的文物进行年代测定和研究
A.A B.B C.C D.D
3.二硫化碳是制作人造棉的重要原料,我国主要利用天然气生产,其反应为。下列说法错误的是
A.和均是硫元素的同素异形体 B.的分子结构模型为
C.二硫化碳的电子式为 D.的结构示意图为
4.为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,中含有的原子的数目为
B.与足量氧气充分反应,生成的数目为
C.1mol羟基含的电子数为
D.常温常压下,和的混合气体中含有的碳原子数为
5.五育并举,劳动先行。下列项目与所述的化学知识没有关联的是
选项 劳动项目 化学知识
A 社区活动:用84消毒液对图书馆桌椅消毒 含氯消毒剂具有氧化性
B 家务劳动:将新切的土豆丝浸没在水中防止变色 土豆中的还原性物质遇空气被氧化
C 学工活动:用溶液制印刷电路板 Fe的活动性比铜强
D 实践活动:用硝酸清洗银镜反应后的试管 硝酸具有较强的氧化性
A.A B.B C.C D.D
6.下列说法正确的是
A.油脂的皂化反应生成高级脂肪酸和丙三醇
B.取4mL淀粉溶液,加入少量20%的硫酸溶液,加热几分钟,待溶液冷却后,再加入少量的银氨溶液,水浴加热,有光亮的银镜生成
C.糖类、油脂、蛋白质是人体重要的营养物质,均属于结构复杂的高分子化合物
D.芝麻香油能使溴水和酸性溶液褪色,其原理不同
7.硅元素是地球的基石与科技的宠儿,下列说法不正确的是
A.硅酸钠水溶液俗称“水玻璃”,可以用作黏合剂和防火剂
B.硅是地壳中含量第二丰富的元素,高纯硅可用于制造太阳能电池
C.是两性氧化物,能与NaOH溶液反应,也能与氢氟酸反应
D.可用于生产光导纤维
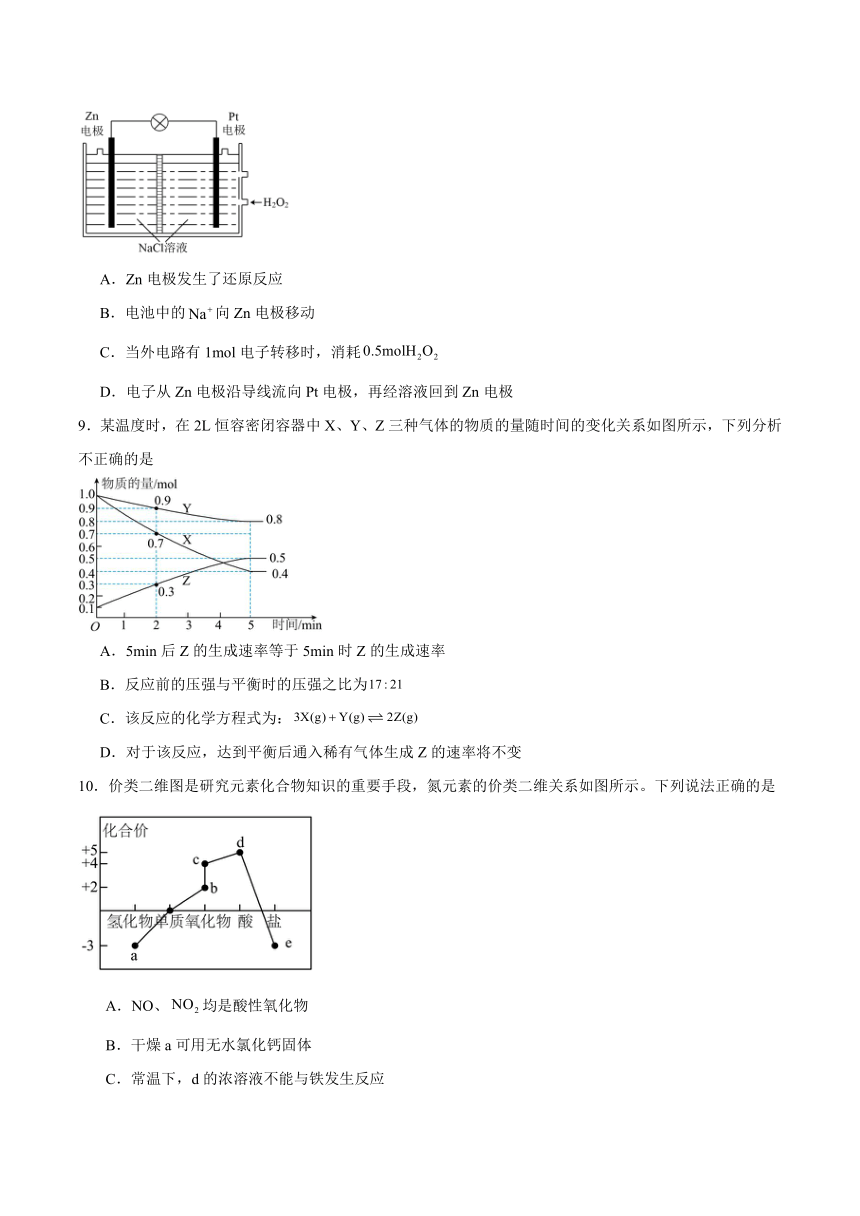
8.给某潜水器提供动力的电池如图所示。下列有关说法正确的是
A.Zn电极发生了还原反应
B.电池中的向Zn电极移动
C.当外电路有1mol电子转移时,消耗
D.电子从Zn电极沿导线流向Pt电极,再经溶液回到Zn电极
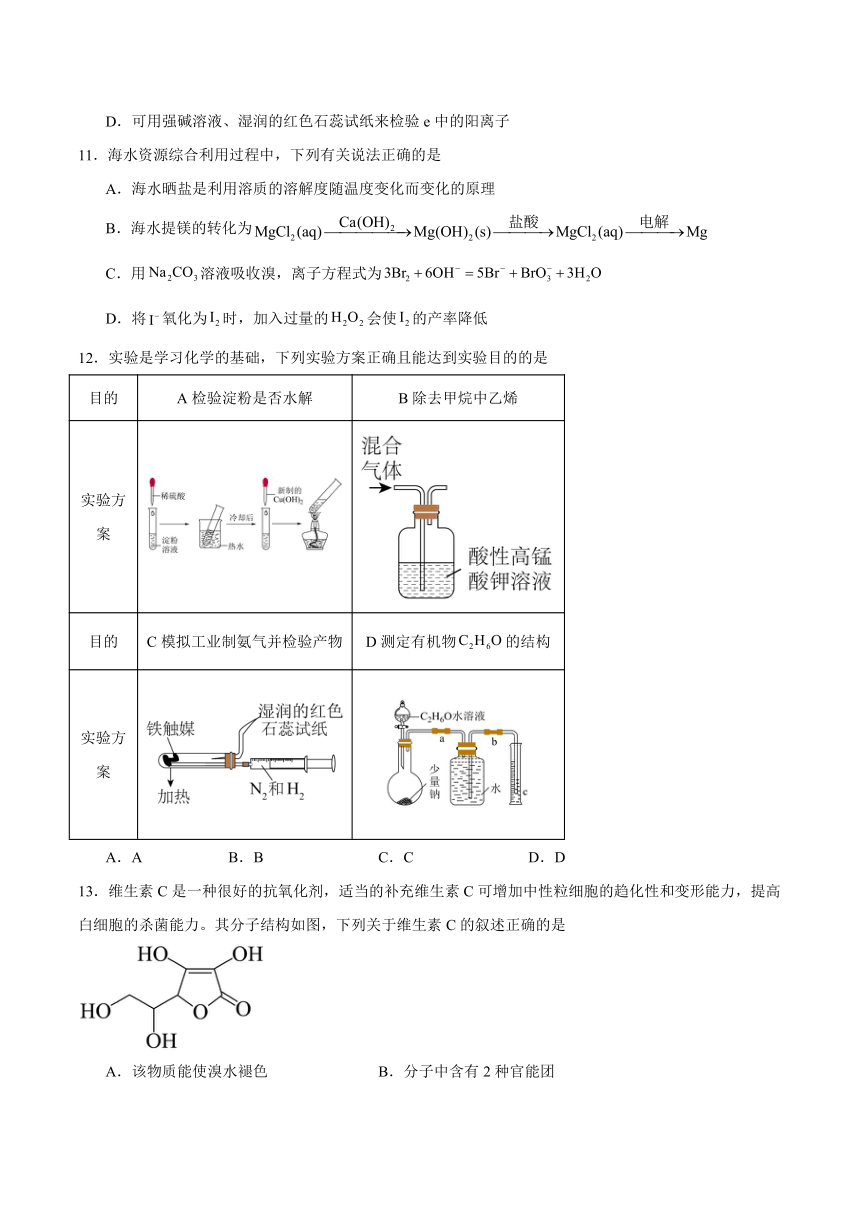
9.某温度时,在2L恒容密闭容器中X、Y、Z三种气体的物质的量随时间的变化关系如图所示,下列分析不正确的是
A.5min后Z的生成速率等于5min时Z的生成速率
B.反应前的压强与平衡时的压强之比为
C.该反应的化学方程式为:
D.对于该反应,达到平衡后通入稀有气体生成Z的速率将不变
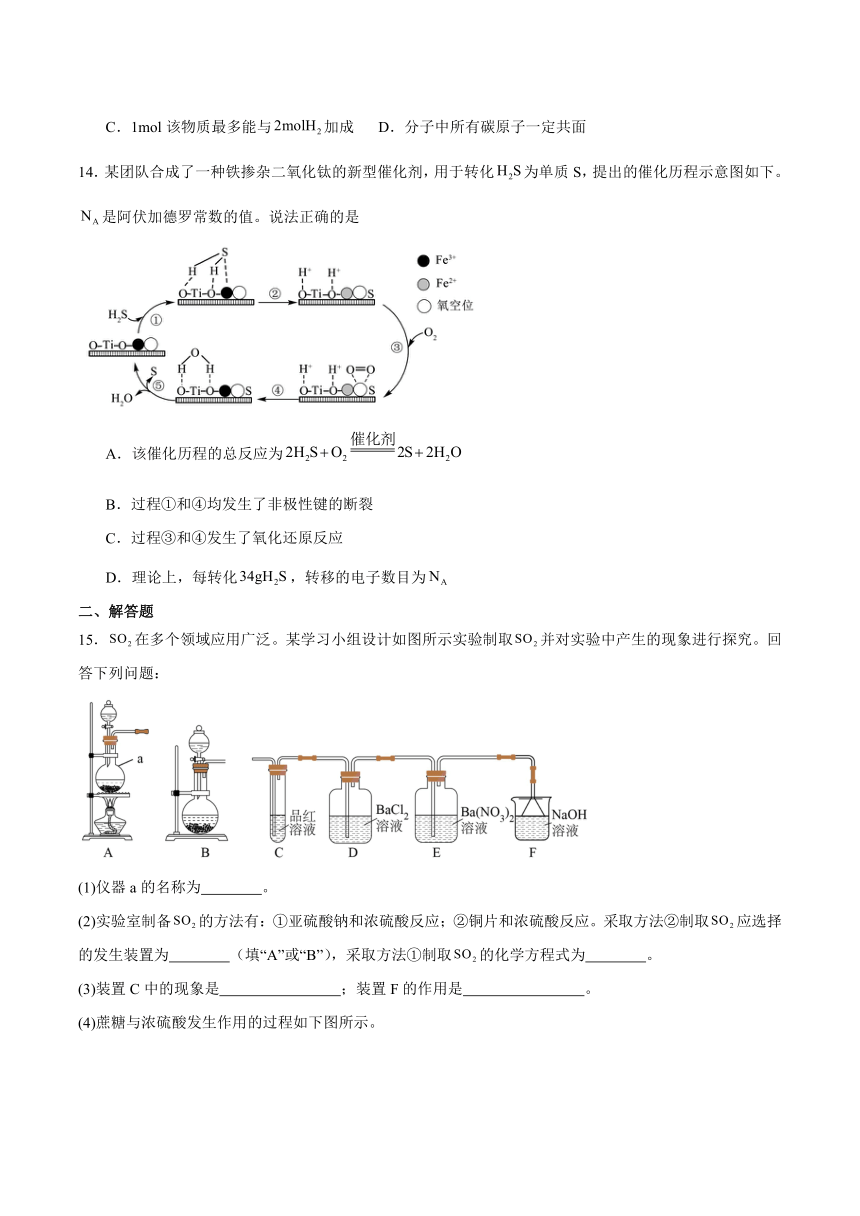
10.价类二维图是研究元素化合物知识的重要手段,氮元素的价类二维关系如图所示。下列说法正确的是
A.NO、均是酸性氧化物
B.干燥a可用无水氯化钙固体
C.常温下,d的浓溶液不能与铁发生反应
D.可用强碱溶液、湿润的红色石蕊试纸来检验e中的阳离子
11.海水资源综合利用过程中,下列有关说法正确的是
A.海水晒盐是利用溶质的溶解度随温度变化而变化的原理
B.海水提镁的转化为
C.用溶液吸收溴,离子方程式为
D.将氧化为时,加入过量的会使的产率降低
12.实验是学习化学的基础,下列实验方案正确且能达到实验目的的是
目的 A检验淀粉是否水解 B除去甲烷中乙烯
实验方案
目的 C模拟工业制氨气并检验产物 D测定有机物的结构
实验方案
A.A B.B C.C D.D
13.维生素C是一种很好的抗氧化剂,适当的补充维生素C可增加中性粒细胞的趋化性和变形能力,提高白细胞的杀菌能力。其分子结构如图,下列关于维生素C的叙述正确的是
A.该物质能使溴水褪色 B.分子中含有2种官能团
C.1mol该物质最多能与加成 D.分子中所有碳原子一定共面
14.某团队合成了一种铁掺杂二氧化钛的新型催化剂,用于转化为单质S,提出的催化历程示意图如下。是阿伏加德罗常数的值。说法正确的是
A.该催化历程的总反应为
B.过程①和④均发生了非极性键的断裂
C.过程③和④发生了氧化还原反应
D.理论上,每转化,转移的电子数目为
二、解答题
15.在多个领域应用广泛。某学习小组设计如图所示实验制取并对实验中产生的现象进行探究。回答下列问题:
(1)仪器a的名称为 。
(2)实验室制备的方法有:①亚硫酸钠和浓硫酸反应;②铜片和浓硫酸反应。采取方法②制取应选择的发生装置为 (填“A”或“B”),采取方法①制取的化学方程式为 。
(3)装置C中的现象是 ;装置F的作用是 。
(4)蔗糖与浓硫酸发生作用的过程如下图所示。
ⅰ.过程①中白色固体迅速变黑,体现了浓硫酸的 性。
ⅱ.过程2中黑色固体迅速膨胀,形成多孔海绵状固体。黑色固体与浓硫酸反应生成气体的化学方程式是 。
16.y我国将力争2030年前实现碳达峰、2060年前实现碳中和。二氧化碳加氢生成燃料是近年研究的热点,有利于减少温室气体二氧化碳的排放,有助于实现碳中和。
(1)已知反应过程的能量变化如图所示:
由图可知该反应为 (填写放热或吸热)反应,(Ea代表正反应的活化能),若保持恒温,加入某有效催化剂,可以使反应加快,此过程使得的转化率 (填写变大、变小或不变)。
(2)恒温条件下,向容积为5L的恒容容器中充入和,发生上述反应。
①下列事实能说明体系达到平衡状态的是 (双选)。
a.
b.
c.反应体系的温度不变时,说明反应体系达到了平衡状态
d.容器内气体密度不变时,说明反应体系达到了平衡状态
e.转化率达到该条件下最大值
②若4min末测得的体积分数为25%,则用表示0~4min内该反应的平均反应速率为 ,的转化率为 。(保留2位小数)
(3)二氧化碳催化加氢制得的甲醇()是优质的清洁燃料,可制作碱性燃料电池,工作原理如图所示:
①B电极为燃料电池的 (填“正”或“负”)极,离子向 (填“A”或“B”)极移动,A电极的电极反应式为 。
②该燃料电池每消耗标准状况下时,外电路中通过电子的数目为 。
17.铁及其化合物,有着不同的重要用途。请完成下面的问题:
某化学兴趣小组以菱铁矿(含铁28%,主要成分为,含有、等少量杂质)为原料制备氯化铁晶体()的实验过程如下:
已知:①不溶于硫酸和水;
(1)操作Ⅰ名称是 。
(2)在氧化过程中,发生反应的离子方程式为 。如何检验氧化后的溶液中是否有: 。
(3)①加入过量NaOH溶液的目的是 ,②与发生反应的离子方程式为 。
(4)请补充完整由过滤后得到的固体制备的实验方案:向过滤后所得固体加 ,使固体完全溶解,然后在氯化氢气流环境下 、 过滤,用浓盐酸洗涤固体2-3次,低温干燥,得到。
(5)小组成员取用100g矿石进行实验,最终获得,该小组的产率是 。(用百分数表示,保留整数)
18.以粮食为原料制取乙醇并利用其制备乙酸乙酯(C)和高分子材料(G)的流程如图:
已知:ⅰ.D的产量可以用来衡量一个国家石油化工水平。ⅱ.饱和水溶液pH为5.6。
(1)某兴趣小组尝试利用该原理酿制米酒。
①《齐民要术》中记载“浸曲三日,如鱼眼汤沸,酘米。其米绝令精细”。此中“曲”为酒曲,含有酶,在反应中起 作用。
②为了更好地了解米的发酵过程,小组同学每隔24小时测定米酒的酒精度和pH,连续10天,收集相关数据绘制了实验数据图。针对米酒的pH变化趋势,甲同学分析原因是酿酒过程中产生了。乙同学认为不合理,其依据一是 ;依据二是乙醇中含官能团 (填名称),在一定条件下会被氧化成B且酸性比碳酸强。
(2)“酒越陈越香”是因为生成酯类物质。
①反应Ⅰ的化学方程式是 。
②反应Ⅲ的发生装置如图所示,有关说法正确的是 。
a.试剂X为饱和NaOH溶液。
b.实验时,先加浓硫酸,再加无水乙醇和冰醋酸。
c.一段时间后,观察到X溶液的液面上有一层无色有特殊香味的油状液体。
d.实验结束时,采用蒸发的方法将乙酸乙酯从混合物中分离出来。
(3)①在反应Ⅰ→Ⅲ中,属于取代反应的是 ,化学方程式是 。
②F→G为加聚反应,化学方程式是 。
(4)D也可由戊烷裂化裂解制得。写出一氯代物只有一种的戊烷同分异构体的结构简式 。
题号 1 2 3 4 5 6 7 8 9 10
答案 A D B D C D C C B D
题号 11 12 13 14
答案 D C A A
15.(1)圆底烧瓶
(2) A Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
(3) 品红溶液褪色 吸收多余SO2,防止污染环境
(4) 脱水 C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
16.(1) 放热 不变
(2) be 0.1mol/(L) 66.67%
(3) 正 A CH3OH-6e-+8OH-=CO+6H2O 4NA
17.(1)过滤
(2) H2O2+2Fe2++2H+=2Fe3++2H2O 氧化后的溶液,滴加KSCN溶液,若溶液变红色,则说明有
(3) 将Al3+转化为,分离Fe3+与Al3+
(4) 稀盐酸 蒸发浓缩 冷却结晶
(5)80%
18.(1) 催化 饱和CO2水溶液pH为5.6,与图中的最低pH为4.1不相符 羟基
(2) 2CH3CH2OH+O22CH3CHO+2H2O c
(3) Ⅲ CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O
(4)C(CH3)4
一、单选题
1.化学在生产生活和科技发展中发挥着重要作用,下列说法错误的是
A.聚氯乙烯可用于制作多种绝缘材料,聚氯乙烯是纯净物
B.铝合金和钛合金也是制造机器人的重要原材料,钛合金强度高耐腐蚀,铝合金轻质成本低,都是极为重要的金属材料
C.“东方超环”(人造太阳)用到的氘、氚两种原子互为同位素
D.2025年4月24号“神舟二十号”载人飞船拔地而起,航天器使用的纳米陶瓷材料是新型无机非金属材料
2.化学与职业息息相关,下列化学职业有关说法不正确的是
选项 职业 工作内容
A 化工工程师 依据科学原理,统筹各方资源,设计化工生产的工艺流程,并监控生产过程及时解决生产中遇到的技术问题
B 水质检测员 对水样的成分进行分析如:酸碱度、重金属、有机污染、微生物等,确保水质达标
C 电池研发人员 电池构成材料的研制、电池性能的改进和应用的拓展
D 考古研究人员 利用的放射性对博物馆中荆王府墓葬出土的文物进行年代测定和研究
A.A B.B C.C D.D
3.二硫化碳是制作人造棉的重要原料,我国主要利用天然气生产,其反应为。下列说法错误的是
A.和均是硫元素的同素异形体 B.的分子结构模型为
C.二硫化碳的电子式为 D.的结构示意图为
4.为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,中含有的原子的数目为
B.与足量氧气充分反应,生成的数目为
C.1mol羟基含的电子数为
D.常温常压下,和的混合气体中含有的碳原子数为
5.五育并举,劳动先行。下列项目与所述的化学知识没有关联的是
选项 劳动项目 化学知识
A 社区活动:用84消毒液对图书馆桌椅消毒 含氯消毒剂具有氧化性
B 家务劳动:将新切的土豆丝浸没在水中防止变色 土豆中的还原性物质遇空气被氧化
C 学工活动:用溶液制印刷电路板 Fe的活动性比铜强
D 实践活动:用硝酸清洗银镜反应后的试管 硝酸具有较强的氧化性
A.A B.B C.C D.D
6.下列说法正确的是
A.油脂的皂化反应生成高级脂肪酸和丙三醇
B.取4mL淀粉溶液,加入少量20%的硫酸溶液,加热几分钟,待溶液冷却后,再加入少量的银氨溶液,水浴加热,有光亮的银镜生成
C.糖类、油脂、蛋白质是人体重要的营养物质,均属于结构复杂的高分子化合物
D.芝麻香油能使溴水和酸性溶液褪色,其原理不同
7.硅元素是地球的基石与科技的宠儿,下列说法不正确的是
A.硅酸钠水溶液俗称“水玻璃”,可以用作黏合剂和防火剂
B.硅是地壳中含量第二丰富的元素,高纯硅可用于制造太阳能电池
C.是两性氧化物,能与NaOH溶液反应,也能与氢氟酸反应
D.可用于生产光导纤维
8.给某潜水器提供动力的电池如图所示。下列有关说法正确的是
A.Zn电极发生了还原反应
B.电池中的向Zn电极移动
C.当外电路有1mol电子转移时,消耗
D.电子从Zn电极沿导线流向Pt电极,再经溶液回到Zn电极
9.某温度时,在2L恒容密闭容器中X、Y、Z三种气体的物质的量随时间的变化关系如图所示,下列分析不正确的是
A.5min后Z的生成速率等于5min时Z的生成速率
B.反应前的压强与平衡时的压强之比为
C.该反应的化学方程式为:
D.对于该反应,达到平衡后通入稀有气体生成Z的速率将不变
10.价类二维图是研究元素化合物知识的重要手段,氮元素的价类二维关系如图所示。下列说法正确的是
A.NO、均是酸性氧化物
B.干燥a可用无水氯化钙固体
C.常温下,d的浓溶液不能与铁发生反应
D.可用强碱溶液、湿润的红色石蕊试纸来检验e中的阳离子
11.海水资源综合利用过程中,下列有关说法正确的是
A.海水晒盐是利用溶质的溶解度随温度变化而变化的原理
B.海水提镁的转化为
C.用溶液吸收溴,离子方程式为
D.将氧化为时,加入过量的会使的产率降低
12.实验是学习化学的基础,下列实验方案正确且能达到实验目的的是
目的 A检验淀粉是否水解 B除去甲烷中乙烯
实验方案
目的 C模拟工业制氨气并检验产物 D测定有机物的结构
实验方案
A.A B.B C.C D.D
13.维生素C是一种很好的抗氧化剂,适当的补充维生素C可增加中性粒细胞的趋化性和变形能力,提高白细胞的杀菌能力。其分子结构如图,下列关于维生素C的叙述正确的是
A.该物质能使溴水褪色 B.分子中含有2种官能团
C.1mol该物质最多能与加成 D.分子中所有碳原子一定共面
14.某团队合成了一种铁掺杂二氧化钛的新型催化剂,用于转化为单质S,提出的催化历程示意图如下。是阿伏加德罗常数的值。说法正确的是
A.该催化历程的总反应为
B.过程①和④均发生了非极性键的断裂
C.过程③和④发生了氧化还原反应
D.理论上,每转化,转移的电子数目为
二、解答题
15.在多个领域应用广泛。某学习小组设计如图所示实验制取并对实验中产生的现象进行探究。回答下列问题:
(1)仪器a的名称为 。
(2)实验室制备的方法有:①亚硫酸钠和浓硫酸反应;②铜片和浓硫酸反应。采取方法②制取应选择的发生装置为 (填“A”或“B”),采取方法①制取的化学方程式为 。
(3)装置C中的现象是 ;装置F的作用是 。
(4)蔗糖与浓硫酸发生作用的过程如下图所示。
ⅰ.过程①中白色固体迅速变黑,体现了浓硫酸的 性。
ⅱ.过程2中黑色固体迅速膨胀,形成多孔海绵状固体。黑色固体与浓硫酸反应生成气体的化学方程式是 。
16.y我国将力争2030年前实现碳达峰、2060年前实现碳中和。二氧化碳加氢生成燃料是近年研究的热点,有利于减少温室气体二氧化碳的排放,有助于实现碳中和。
(1)已知反应过程的能量变化如图所示:
由图可知该反应为 (填写放热或吸热)反应,(Ea代表正反应的活化能),若保持恒温,加入某有效催化剂,可以使反应加快,此过程使得的转化率 (填写变大、变小或不变)。
(2)恒温条件下,向容积为5L的恒容容器中充入和,发生上述反应。
①下列事实能说明体系达到平衡状态的是 (双选)。
a.
b.
c.反应体系的温度不变时,说明反应体系达到了平衡状态
d.容器内气体密度不变时,说明反应体系达到了平衡状态
e.转化率达到该条件下最大值
②若4min末测得的体积分数为25%,则用表示0~4min内该反应的平均反应速率为 ,的转化率为 。(保留2位小数)
(3)二氧化碳催化加氢制得的甲醇()是优质的清洁燃料,可制作碱性燃料电池,工作原理如图所示:
①B电极为燃料电池的 (填“正”或“负”)极,离子向 (填“A”或“B”)极移动,A电极的电极反应式为 。
②该燃料电池每消耗标准状况下时,外电路中通过电子的数目为 。
17.铁及其化合物,有着不同的重要用途。请完成下面的问题:
某化学兴趣小组以菱铁矿(含铁28%,主要成分为,含有、等少量杂质)为原料制备氯化铁晶体()的实验过程如下:
已知:①不溶于硫酸和水;
(1)操作Ⅰ名称是 。
(2)在氧化过程中,发生反应的离子方程式为 。如何检验氧化后的溶液中是否有: 。
(3)①加入过量NaOH溶液的目的是 ,②与发生反应的离子方程式为 。
(4)请补充完整由过滤后得到的固体制备的实验方案:向过滤后所得固体加 ,使固体完全溶解,然后在氯化氢气流环境下 、 过滤,用浓盐酸洗涤固体2-3次,低温干燥,得到。
(5)小组成员取用100g矿石进行实验,最终获得,该小组的产率是 。(用百分数表示,保留整数)
18.以粮食为原料制取乙醇并利用其制备乙酸乙酯(C)和高分子材料(G)的流程如图:
已知:ⅰ.D的产量可以用来衡量一个国家石油化工水平。ⅱ.饱和水溶液pH为5.6。
(1)某兴趣小组尝试利用该原理酿制米酒。
①《齐民要术》中记载“浸曲三日,如鱼眼汤沸,酘米。其米绝令精细”。此中“曲”为酒曲,含有酶,在反应中起 作用。
②为了更好地了解米的发酵过程,小组同学每隔24小时测定米酒的酒精度和pH,连续10天,收集相关数据绘制了实验数据图。针对米酒的pH变化趋势,甲同学分析原因是酿酒过程中产生了。乙同学认为不合理,其依据一是 ;依据二是乙醇中含官能团 (填名称),在一定条件下会被氧化成B且酸性比碳酸强。
(2)“酒越陈越香”是因为生成酯类物质。
①反应Ⅰ的化学方程式是 。
②反应Ⅲ的发生装置如图所示,有关说法正确的是 。
a.试剂X为饱和NaOH溶液。
b.实验时,先加浓硫酸,再加无水乙醇和冰醋酸。
c.一段时间后,观察到X溶液的液面上有一层无色有特殊香味的油状液体。
d.实验结束时,采用蒸发的方法将乙酸乙酯从混合物中分离出来。
(3)①在反应Ⅰ→Ⅲ中,属于取代反应的是 ,化学方程式是 。
②F→G为加聚反应,化学方程式是 。
(4)D也可由戊烷裂化裂解制得。写出一氯代物只有一种的戊烷同分异构体的结构简式 。
题号 1 2 3 4 5 6 7 8 9 10
答案 A D B D C D C C B D
题号 11 12 13 14
答案 D C A A
15.(1)圆底烧瓶
(2) A Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
(3) 品红溶液褪色 吸收多余SO2,防止污染环境
(4) 脱水 C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
16.(1) 放热 不变
(2) be 0.1mol/(L) 66.67%
(3) 正 A CH3OH-6e-+8OH-=CO+6H2O 4NA
17.(1)过滤
(2) H2O2+2Fe2++2H+=2Fe3++2H2O 氧化后的溶液,滴加KSCN溶液,若溶液变红色,则说明有
(3) 将Al3+转化为,分离Fe3+与Al3+
(4) 稀盐酸 蒸发浓缩 冷却结晶
(5)80%
18.(1) 催化 饱和CO2水溶液pH为5.6,与图中的最低pH为4.1不相符 羟基
(2) 2CH3CH2OH+O22CH3CHO+2H2O c
(3) Ⅲ CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O
(4)C(CH3)4
同课章节目录
