四川省资阳中学2024-2025学年高二下学期6月测试化学试卷(含答案)
文档属性
| 名称 | 四川省资阳中学2024-2025学年高二下学期6月测试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 893.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-22 16:13:25 | ||
图片预览


文档简介
四川省资阳中学2024-2025学年高二下学期6月测试化学试题
一、单选题
1.化学与生活密切相关。下列说法错误的是
A.乙二醇可用生产汽车发动机防冻液
B.苯甲酸及其钠盐是常用的食品防腐剂
C.福尔马林能使蛋白质变性,可用于浸制动物标本和食品,以防止变质
D.“复方氯乙烷气雾剂”可用于运动中急性损伤的镇痛
2.下列叙述不正确的是
A.晶体熔点:Rb>K>Na B.键角:
C.CCl4中的溶解度: I2>NH3 D.晶体硬度:金刚石>晶体硅
3.下列化学用语表达不正确的是
A.反-2-丁烯的结构简式:
B.CH3CH=C(CH3)Br名称:2-甲基-1-溴丙烯
C.基态磷原子价层电子轨道表示式:
D.NaCl的电子式:
4.下列说法正确的是
A.乙酸、草酸、硬脂酸和石炭酸均属于羧酸类有机物
B.豆油、汽油、牛油均属于油脂
C.植物油可用作碘水的萃取剂
D.生活中常用热纯碱溶液清洗器皿表面的油脂
5.为阿伏加德罗常数的值。下列说法错误的是
A.标准状况下,22.4L乙炔中键数为、键数为
B.与的混合物中含有的中子数为
C.1 molSiO2晶体中含有4个硅氧键
D.中氙的价层电子对数为
6.下列有机化学方程式或离子方程式书写正确的是:
A.乙酰胺在盐酸溶液中加热,发生水解反应的化学方程式为:CH3CONH2 + H2OCH3COOH+NH3↑
B.苯酚钠溶液中通入少量的:2 +CO2+H2O→2 +Na2CO3
C.乙醛与新制银氨溶液发生银镜反应,离子方程式为:CH3CHO+2[Ag(NH3)2]++2OH-CH3COO-+NH+2Ag↓+3NH3+H2O
D.甲苯与浓硝酸和浓硫酸混合液共热生成三硝基甲苯:+3HNO3+3H2O
7.一种工业洗涤剂中间体结构式如图所示,其中短周期元素X、Y、Z、Q、W原子的半径依次增大,X和W同主族但不相邻,Y和Q最外层电子数之和是Z原子L层电子数的二倍,下列说法正确的是
A.X、Z、W均可与Y形成两种或以上种类的化合物
B.简单离子半径:W>Z>Y
C.Y的氢化物的稳定性和沸点都高于Q的氢化物
D.X、Y、Z三种元素只能形成共价化合物
8.下列说法正确的是
A.晶体内分子间以共价键结合
B.石墨转化为金刚石只有共价键的断裂和形成
C.离子液体有良好的导电性,可被开发为原电池的电解质
D.明矾晶体制备时,溶剂蒸发速率越快,得到的晶体颗粒就越大
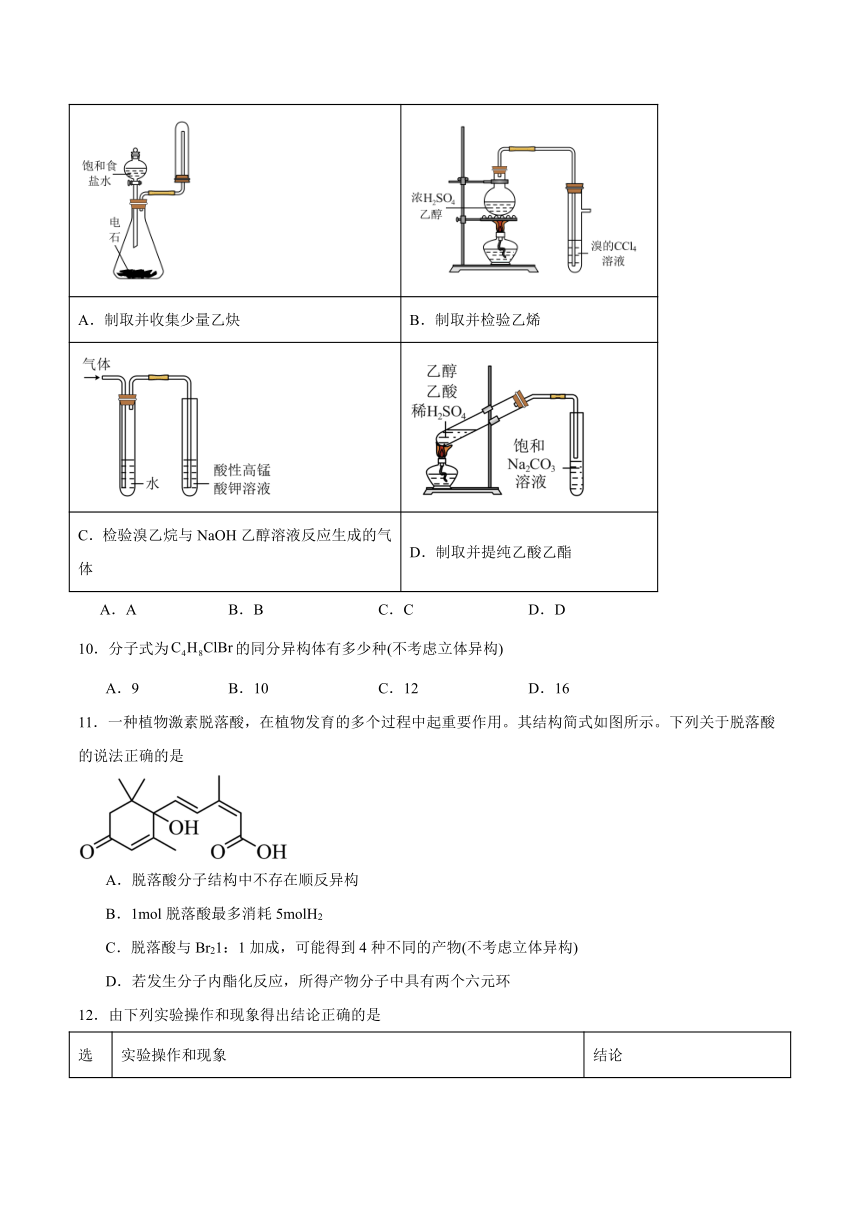
9.用下列实验装置完成对应的实验,能达到实验目的的是
A.制取并收集少量乙炔 B.制取并检验乙烯
C.检验溴乙烷与NaOH乙醇溶液反应生成的气体 D.制取并提纯乙酸乙酯
A.A B.B C.C D.D
10.分子式为的同分异构体有多少种(不考虑立体异构)
A.9 B.10 C.12 D.16
11.一种植物激素脱落酸,在植物发育的多个过程中起重要作用。其结构简式如图所示。下列关于脱落酸的说法正确的是
A.脱落酸分子结构中不存在顺反异构
B.1mol脱落酸最多消耗5molH2
C.脱落酸与Br21:1加成,可能得到4种不同的产物(不考虑立体异构)
D.若发生分子内酯化反应,所得产物分子中具有两个六元环
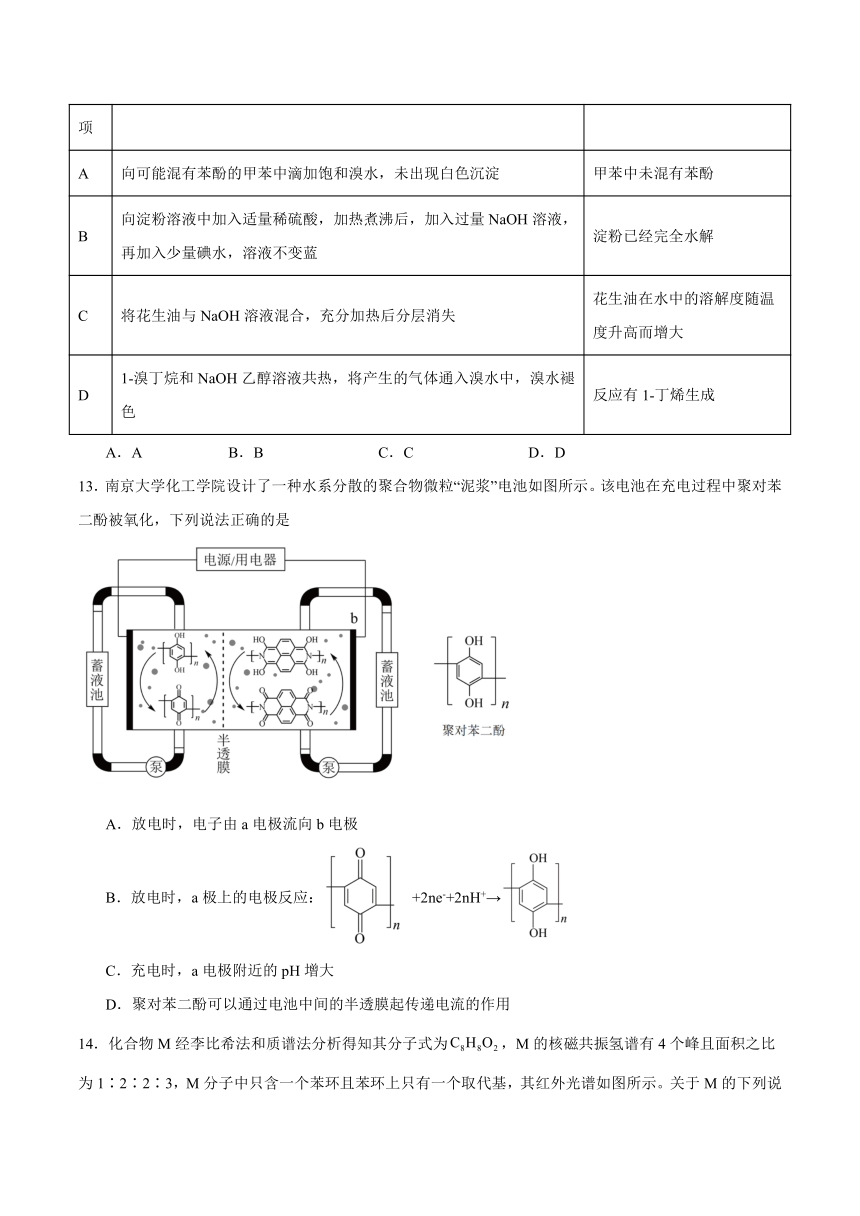
12.由下列实验操作和现象得出结论正确的是
选项 实验操作和现象 结论
A 向可能混有苯酚的甲苯中滴加饱和溴水,未出现白色沉淀 甲苯中未混有苯酚
B 向淀粉溶液中加入适量稀硫酸,加热煮沸后,加入过量NaOH溶液,再加入少量碘水,溶液不变蓝 淀粉已经完全水解
C 将花生油与NaOH溶液混合,充分加热后分层消失 花生油在水中的溶解度随温度升高而增大
D 1-溴丁烷和NaOH乙醇溶液共热,将产生的气体通入溴水中,溴水褪色 反应有1-丁烯生成
A.A B.B C.C D.D
13.南京大学化工学院设计了一种水系分散的聚合物微粒“泥浆”电池如图所示。该电池在充电过程中聚对苯二酚被氧化,下列说法正确的是
A.放电时,电子由a电极流向b电极
B.放电时,a极上的电极反应: +2ne-+2nH+→
C.充电时,a电极附近的pH增大
D.聚对苯二酚可以通过电池中间的半透膜起传递电流的作用
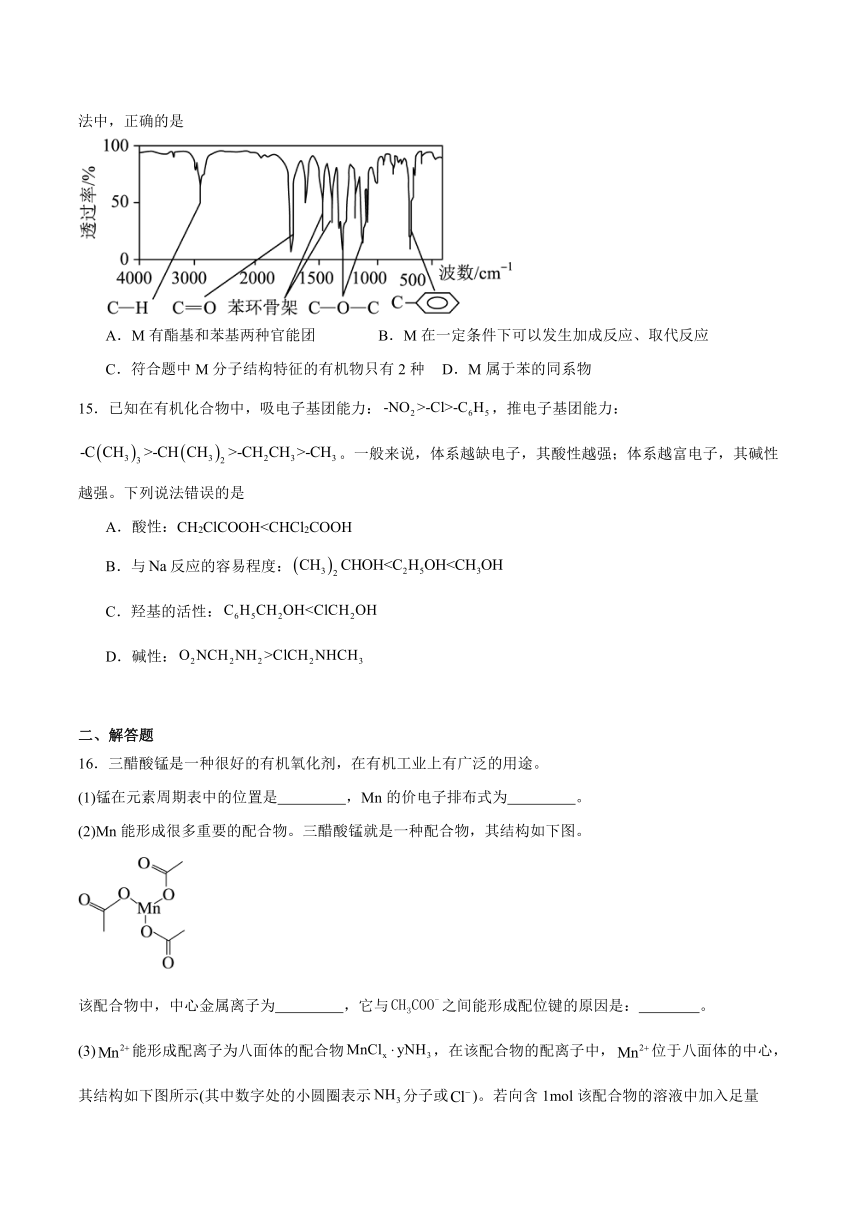
14.化合物M经李比希法和质谱法分析得知其分子式为,M的核磁共振氢谱有4个峰且面积之比为1∶2∶2∶3,M分子中只含一个苯环且苯环上只有一个取代基,其红外光谱如图所示。关于M的下列说法中,正确的是
A.M有酯基和苯基两种官能团 B.M在一定条件下可以发生加成反应、取代反应
C.符合题中M分子结构特征的有机物只有2种 D.M属于苯的同系物
15.已知在有机化合物中,吸电子基团能力:,推电子基团能力:。一般来说,体系越缺电子,其酸性越强;体系越富电子,其碱性越强。下列说法错误的是
A.酸性:CH2ClCOOHB.与反应的容易程度:
C.羟基的活性:
D.碱性:
二、解答题
16.三醋酸锰是一种很好的有机氧化剂,在有机工业上有广泛的用途。
(1)锰在元素周期表中的位置是 ,Mn的价电子排布式为 。
(2)Mn能形成很多重要的配合物。三醋酸锰就是一种配合物,其结构如下图。
该配合物中,中心金属离子为 ,它与之间能形成配位键的原因是: 。
(3)能形成配离子为八面体的配合物,在该配合物的配离子中,位于八面体的中心,其结构如下图所示(其中数字处的小圆圈表示分子或)。若向含1mol该配合物的溶液中加入足量溶液,可生成1mol AgCl沉淀,则该配合物的化学式为 。
(4)锰与硒形成的某种化合物具有优异的光电性能,其晶胞是一个边长为a pm的立方体,结构如图所示。
①该化合物的化学式为 。
②该晶体中与Se距离相等且最近的Mn有 个。
③若阿伏加德罗常数的值用表示,则该晶体的密度为 (列出计算式即可)。
17.三氯化六氨合钴是一种橙黄色、微溶于水的配合物,常用于合成其他含钴的配合物。利用含钴废料(含少量Fe、Al等杂质)制取的工艺流程如图:
已知:①浸出液中含有的金属离子主要有、、、。
②氧化性。
③该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
沉淀物
开始沉淀 2.7 \ 7.6 4.0
完全沉淀 3.7 1.1 9.2 5.2
(1)用盐酸酸浸时钴的浸出率与温度有关,若酸浸时温度较高会生成一定量的,其可能的原因是 。
(2)“浸出液”中加入时发生反应的离子方程式为 。
(3)“滤渣”的主要成分是 和 ,“调pH”的范围为 。
(4)“滤液”中主要含,经“操作I”可获得较纯净的晶体,“操作I”包括向溶液加入盐酸调节pH,然后再HCl氛围下 、 、减压过滤等过程。
(5)“氧化”时应先加入氨水生成配离子后再加。若生成晶体,则理论上消耗的质量为 g。
18.苯甲酸常用于抗真菌及消毒防腐剂,实验室常用高锰酸钾氧化甲苯制备苯甲酸,其反应原理和实验装置如下(图1中加热和仪器固定装置均已略去)。
已知:苯甲酸在不同温度下溶解度如下:
T/℃ 4 18 75
溶解度/g 0.18 0.27 2.20
实验步骤如下:
①在反应器c中加入甲苯、水、几粒沸石,边搅拌边加热;
②加热至沸腾后分批加入高锰酸钾,回流反应;
③将反应混合物趁热过滤,并用热水洗涤滤渣,合并滤液和洗涤液,用冰水浴冷却;
④加入盐酸酸化,直到苯甲酸充分析出,抽滤(装置如图2)、冷水洗涤、干燥、称量,得纯净的苯甲酸产品。
(1)反应器c的名称 。
(2)步骤②反应结束时,溶液呈紫红色,可向反应器c中加入适量的下列 (填字母)试剂处理,反应的离子方程式 。(使元素以形式存在)
A. B. C. D.
(3)抽滤操作与普通过滤相比,除了得到的沉淀较干燥外,还有一个优点是 。
(4)步骤④中盐酸酸化的目的 (用化学方程式表示)。冷水洗涤的目的 。
(5)苯甲酸的产率 。(保留小数点后1位)
(6)若要得到纯度更高的苯甲酸,可通过在水中 的方法提纯。
19.化合物E可用于治疗脑血管疾病,以甲苯为原料合成化合物E和J的流程如下(部分产物、反应条件已略去):
已知:
(1)G的结构简式是 ,E中含氧官能团的名称是 。
(2)写出甲苯生成A的化学方程式: ,该反应的反应类型为 。
(3)关于上述合成路线,下列说法不正确的是_______(填标号)。
A.H中各原子的电负性关系:
B.生成物E溶于水是因为羧基和氨基与水分子之间存在氢键
C.甲苯能使酸性高锰酸钾溶液褪色
D.中有σ键、π键的断裂和生成
(4)芳香化合物X是E的同分异构体,化合物X含有,其核磁共振氢谱峰面积比为,写出其中一种符合该要求的化合物X的结构简式: 。
(5)参照上述合成路线,设计以和1—丙醇为原料合成的路线。基于你设计的合成路线,回答下列问题:
①从1—丙醇出发,其第一步反应的有机产物的结构简式为 。
②最后一步化学方程式为 。
参考答案
1.C
2.A
3.B
4.D
5.A
6.C
7.A
8.C
9.C
10.C
11.C
12.D
13.B
14.B
15.D
16.(1) 第四周期第VIIB族 3d54s2
(2) 具有空轨道,而中的O具有孤电子对
(3)
(4) MnSe 4
17.(1)温度升高,促进水解平衡右移,生成一定量的
(2)
(3)
(4) 蒸发浓缩 冷却结晶
(5)3.4
18.(1)三颈烧瓶
(2) C
(3)加快过滤的速率
(4) +HCl→+KCl 除去苯甲酸晶体表面可溶性杂质,同时减少苯甲酸晶体的溶解损失
(5)62.3%
(6)重结晶
19.(1) 羧基
(2) 取代反应
(3)A
(4)或
(5) +CH3CH2CHO+H2O
一、单选题
1.化学与生活密切相关。下列说法错误的是
A.乙二醇可用生产汽车发动机防冻液
B.苯甲酸及其钠盐是常用的食品防腐剂
C.福尔马林能使蛋白质变性,可用于浸制动物标本和食品,以防止变质
D.“复方氯乙烷气雾剂”可用于运动中急性损伤的镇痛
2.下列叙述不正确的是
A.晶体熔点:Rb>K>Na B.键角:
C.CCl4中的溶解度: I2>NH3 D.晶体硬度:金刚石>晶体硅
3.下列化学用语表达不正确的是
A.反-2-丁烯的结构简式:
B.CH3CH=C(CH3)Br名称:2-甲基-1-溴丙烯
C.基态磷原子价层电子轨道表示式:
D.NaCl的电子式:
4.下列说法正确的是
A.乙酸、草酸、硬脂酸和石炭酸均属于羧酸类有机物
B.豆油、汽油、牛油均属于油脂
C.植物油可用作碘水的萃取剂
D.生活中常用热纯碱溶液清洗器皿表面的油脂
5.为阿伏加德罗常数的值。下列说法错误的是
A.标准状况下,22.4L乙炔中键数为、键数为
B.与的混合物中含有的中子数为
C.1 molSiO2晶体中含有4个硅氧键
D.中氙的价层电子对数为
6.下列有机化学方程式或离子方程式书写正确的是:
A.乙酰胺在盐酸溶液中加热,发生水解反应的化学方程式为:CH3CONH2 + H2OCH3COOH+NH3↑
B.苯酚钠溶液中通入少量的:2 +CO2+H2O→2 +Na2CO3
C.乙醛与新制银氨溶液发生银镜反应,离子方程式为:CH3CHO+2[Ag(NH3)2]++2OH-CH3COO-+NH+2Ag↓+3NH3+H2O
D.甲苯与浓硝酸和浓硫酸混合液共热生成三硝基甲苯:+3HNO3+3H2O
7.一种工业洗涤剂中间体结构式如图所示,其中短周期元素X、Y、Z、Q、W原子的半径依次增大,X和W同主族但不相邻,Y和Q最外层电子数之和是Z原子L层电子数的二倍,下列说法正确的是
A.X、Z、W均可与Y形成两种或以上种类的化合物
B.简单离子半径:W>Z>Y
C.Y的氢化物的稳定性和沸点都高于Q的氢化物
D.X、Y、Z三种元素只能形成共价化合物
8.下列说法正确的是
A.晶体内分子间以共价键结合
B.石墨转化为金刚石只有共价键的断裂和形成
C.离子液体有良好的导电性,可被开发为原电池的电解质
D.明矾晶体制备时,溶剂蒸发速率越快,得到的晶体颗粒就越大
9.用下列实验装置完成对应的实验,能达到实验目的的是
A.制取并收集少量乙炔 B.制取并检验乙烯
C.检验溴乙烷与NaOH乙醇溶液反应生成的气体 D.制取并提纯乙酸乙酯
A.A B.B C.C D.D
10.分子式为的同分异构体有多少种(不考虑立体异构)
A.9 B.10 C.12 D.16
11.一种植物激素脱落酸,在植物发育的多个过程中起重要作用。其结构简式如图所示。下列关于脱落酸的说法正确的是
A.脱落酸分子结构中不存在顺反异构
B.1mol脱落酸最多消耗5molH2
C.脱落酸与Br21:1加成,可能得到4种不同的产物(不考虑立体异构)
D.若发生分子内酯化反应,所得产物分子中具有两个六元环
12.由下列实验操作和现象得出结论正确的是
选项 实验操作和现象 结论
A 向可能混有苯酚的甲苯中滴加饱和溴水,未出现白色沉淀 甲苯中未混有苯酚
B 向淀粉溶液中加入适量稀硫酸,加热煮沸后,加入过量NaOH溶液,再加入少量碘水,溶液不变蓝 淀粉已经完全水解
C 将花生油与NaOH溶液混合,充分加热后分层消失 花生油在水中的溶解度随温度升高而增大
D 1-溴丁烷和NaOH乙醇溶液共热,将产生的气体通入溴水中,溴水褪色 反应有1-丁烯生成
A.A B.B C.C D.D
13.南京大学化工学院设计了一种水系分散的聚合物微粒“泥浆”电池如图所示。该电池在充电过程中聚对苯二酚被氧化,下列说法正确的是
A.放电时,电子由a电极流向b电极
B.放电时,a极上的电极反应: +2ne-+2nH+→
C.充电时,a电极附近的pH增大
D.聚对苯二酚可以通过电池中间的半透膜起传递电流的作用
14.化合物M经李比希法和质谱法分析得知其分子式为,M的核磁共振氢谱有4个峰且面积之比为1∶2∶2∶3,M分子中只含一个苯环且苯环上只有一个取代基,其红外光谱如图所示。关于M的下列说法中,正确的是
A.M有酯基和苯基两种官能团 B.M在一定条件下可以发生加成反应、取代反应
C.符合题中M分子结构特征的有机物只有2种 D.M属于苯的同系物
15.已知在有机化合物中,吸电子基团能力:,推电子基团能力:。一般来说,体系越缺电子,其酸性越强;体系越富电子,其碱性越强。下列说法错误的是
A.酸性:CH2ClCOOH
C.羟基的活性:
D.碱性:
二、解答题
16.三醋酸锰是一种很好的有机氧化剂,在有机工业上有广泛的用途。
(1)锰在元素周期表中的位置是 ,Mn的价电子排布式为 。
(2)Mn能形成很多重要的配合物。三醋酸锰就是一种配合物,其结构如下图。
该配合物中,中心金属离子为 ,它与之间能形成配位键的原因是: 。
(3)能形成配离子为八面体的配合物,在该配合物的配离子中,位于八面体的中心,其结构如下图所示(其中数字处的小圆圈表示分子或)。若向含1mol该配合物的溶液中加入足量溶液,可生成1mol AgCl沉淀,则该配合物的化学式为 。
(4)锰与硒形成的某种化合物具有优异的光电性能,其晶胞是一个边长为a pm的立方体,结构如图所示。
①该化合物的化学式为 。
②该晶体中与Se距离相等且最近的Mn有 个。
③若阿伏加德罗常数的值用表示,则该晶体的密度为 (列出计算式即可)。
17.三氯化六氨合钴是一种橙黄色、微溶于水的配合物,常用于合成其他含钴的配合物。利用含钴废料(含少量Fe、Al等杂质)制取的工艺流程如图:
已知:①浸出液中含有的金属离子主要有、、、。
②氧化性。
③该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
沉淀物
开始沉淀 2.7 \ 7.6 4.0
完全沉淀 3.7 1.1 9.2 5.2
(1)用盐酸酸浸时钴的浸出率与温度有关,若酸浸时温度较高会生成一定量的,其可能的原因是 。
(2)“浸出液”中加入时发生反应的离子方程式为 。
(3)“滤渣”的主要成分是 和 ,“调pH”的范围为 。
(4)“滤液”中主要含,经“操作I”可获得较纯净的晶体,“操作I”包括向溶液加入盐酸调节pH,然后再HCl氛围下 、 、减压过滤等过程。
(5)“氧化”时应先加入氨水生成配离子后再加。若生成晶体,则理论上消耗的质量为 g。
18.苯甲酸常用于抗真菌及消毒防腐剂,实验室常用高锰酸钾氧化甲苯制备苯甲酸,其反应原理和实验装置如下(图1中加热和仪器固定装置均已略去)。
已知:苯甲酸在不同温度下溶解度如下:
T/℃ 4 18 75
溶解度/g 0.18 0.27 2.20
实验步骤如下:
①在反应器c中加入甲苯、水、几粒沸石,边搅拌边加热;
②加热至沸腾后分批加入高锰酸钾,回流反应;
③将反应混合物趁热过滤,并用热水洗涤滤渣,合并滤液和洗涤液,用冰水浴冷却;
④加入盐酸酸化,直到苯甲酸充分析出,抽滤(装置如图2)、冷水洗涤、干燥、称量,得纯净的苯甲酸产品。
(1)反应器c的名称 。
(2)步骤②反应结束时,溶液呈紫红色,可向反应器c中加入适量的下列 (填字母)试剂处理,反应的离子方程式 。(使元素以形式存在)
A. B. C. D.
(3)抽滤操作与普通过滤相比,除了得到的沉淀较干燥外,还有一个优点是 。
(4)步骤④中盐酸酸化的目的 (用化学方程式表示)。冷水洗涤的目的 。
(5)苯甲酸的产率 。(保留小数点后1位)
(6)若要得到纯度更高的苯甲酸,可通过在水中 的方法提纯。
19.化合物E可用于治疗脑血管疾病,以甲苯为原料合成化合物E和J的流程如下(部分产物、反应条件已略去):
已知:
(1)G的结构简式是 ,E中含氧官能团的名称是 。
(2)写出甲苯生成A的化学方程式: ,该反应的反应类型为 。
(3)关于上述合成路线,下列说法不正确的是_______(填标号)。
A.H中各原子的电负性关系:
B.生成物E溶于水是因为羧基和氨基与水分子之间存在氢键
C.甲苯能使酸性高锰酸钾溶液褪色
D.中有σ键、π键的断裂和生成
(4)芳香化合物X是E的同分异构体,化合物X含有,其核磁共振氢谱峰面积比为,写出其中一种符合该要求的化合物X的结构简式: 。
(5)参照上述合成路线,设计以和1—丙醇为原料合成的路线。基于你设计的合成路线,回答下列问题:
①从1—丙醇出发,其第一步反应的有机产物的结构简式为 。
②最后一步化学方程式为 。
参考答案
1.C
2.A
3.B
4.D
5.A
6.C
7.A
8.C
9.C
10.C
11.C
12.D
13.B
14.B
15.D
16.(1) 第四周期第VIIB族 3d54s2
(2) 具有空轨道,而中的O具有孤电子对
(3)
(4) MnSe 4
17.(1)温度升高,促进水解平衡右移,生成一定量的
(2)
(3)
(4) 蒸发浓缩 冷却结晶
(5)3.4
18.(1)三颈烧瓶
(2) C
(3)加快过滤的速率
(4) +HCl→+KCl 除去苯甲酸晶体表面可溶性杂质,同时减少苯甲酸晶体的溶解损失
(5)62.3%
(6)重结晶
19.(1) 羧基
(2) 取代反应
(3)A
(4)或
(5) +CH3CH2CHO+H2O
同课章节目录
