四川省绵阳市2024-2025学年高二下学期期末教学质量测试化学试卷(含答案)
文档属性
| 名称 | 四川省绵阳市2024-2025学年高二下学期期末教学质量测试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 474.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-22 16:13:29 | ||
图片预览


文档简介
秘密 ★ 启用前 【考试时间2025年7月6日8:15-9:30】
高中2023级第二学年末教学质量测试
化 学
本试卷分为试题卷和答题卡两部分,其中试题卷由选择题和非选择题组成,共6页;答题卡共2页。满分100分,考试时间75分钟。
注意事项:
1. 答题前,考生务必将自己的学校、班级、姓名用0.5毫米黑色墨水签字笔填写清楚,同时用2B铅笔将考号准确填涂在“考号”栏目内。
2. 选择题使用2B铅笔填涂在答题卡对应题目标号的位置上,如需改动,用橡皮擦擦干净后再选涂其它答案;非选择题用0.5毫米黑色墨水签字笔书写在答题卡的对应框内,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。
3. 考试结束后将答题卡收回。
可能用到的相对原子质量:H 1 C 12 O 16 Si 28 Cl 35.5 Cr 52 Mn 55 Co 59
一、选择题(本题共15小题,每小题3分,共45分。每小题只有一个选项符合题意)
1. 我国屠呦呦等科学家从中药中提取出青蒿素,下列关于测定青蒿素结构的说法错误的是
A.X射线衍射技术可测定其分子结构 B.利用红外光谱法确定分子中含有酯基
C.通过元素定量分析可确定其分子式 D.通过化学反应证明分子中含有过氧基
2. 下列化学用语表示正确的是
A.SeO2的VSEPR模型: B.基态As核外电子排布式:[Ar]4s24p3
C.O3分子的球棍模型: D.HF分子中共价键示意图:
3. NA为阿伏伽德罗常数的值,下列说法正确的是
A.1mol正四面体烷 中含有σ键的数目是6NA
B.标准状况下,11.2 L甲醇中所含原子数目为3NA
C.1 mol C2H6与1 mol Cl2光照反应后的分子总数为2NA
D.40 g SiC晶体中所含有的Si-C键数目为2NA
4. 下列说法错误的是
A.离子晶体中Cl-的配位数:CsCl>NaCl
B.化学键中离子键成分的百分数:Na2O<Na2S
C.邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点
D.若Ni(CO)4 的沸点43℃,则C与Ni以共价键相连
5. 下列关于生物大分子的说法中错误的是
A.葡萄糖和核糖分子中均含羟基和醛基 B.蛋白质的二级结构与肽键的形成有关
C.核苷酸水解可能得到核苷和磷酸 D.油脂是高级脂肪酸的甘油酯,能水解
6. 下列说法中,错误的是
A. 核磁共振氢谱不能区分CH3CH2OH和CH3OCH3
B. 用溴水可以鉴别苯酚溶液、2,4 -己二烯和甲苯
C. 室温下,在水中的溶解度:甘油>苯酚>溴乙烷
D. 两种二肽互为同分异构体,二者的水解产物可能相同
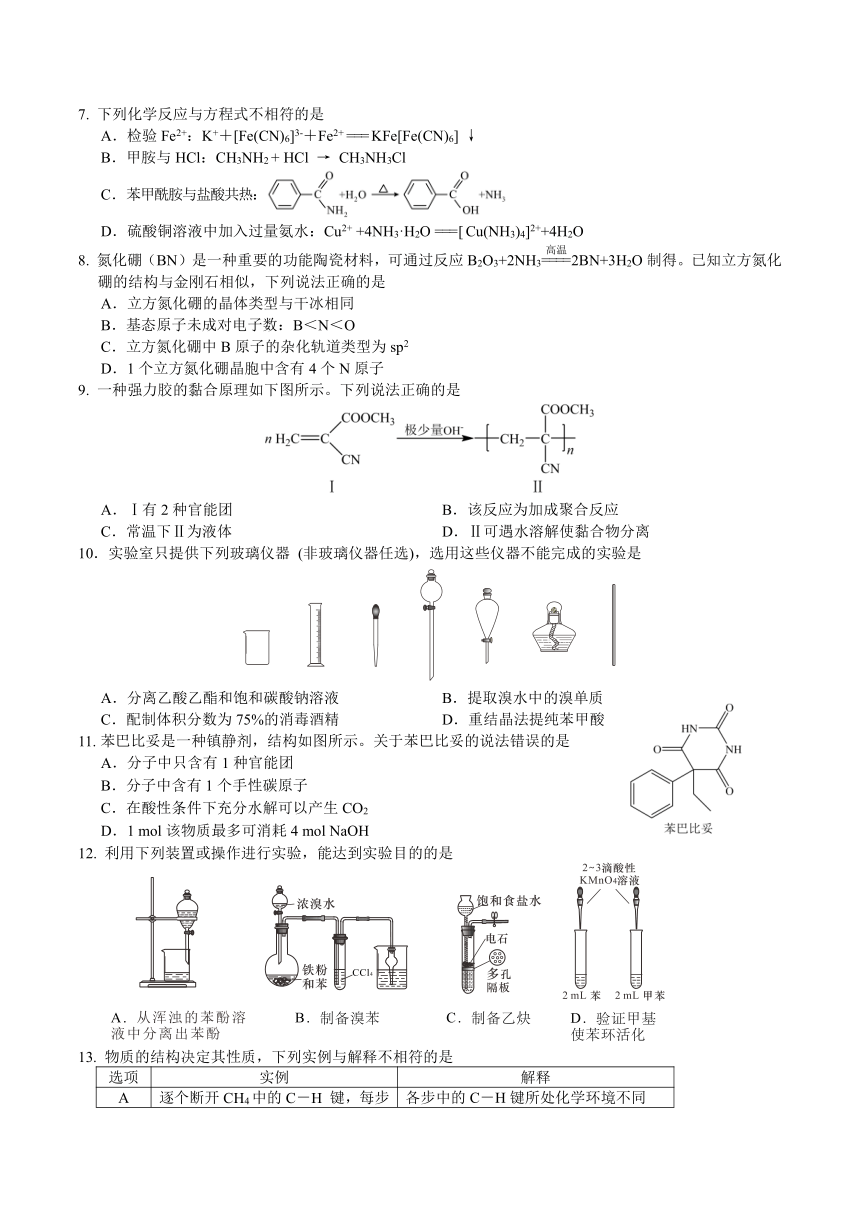
7. 下列化学反应与方程式不相符的是
A.检验Fe2+:K++[Fe(CN)6]3-+Fe2+ === KFe[Fe(CN)6] ↓
B.甲胺与HCl:CH3NH2 + HCl → CH3NH3Cl
C.苯甲酰胺与盐酸共热:
D.硫酸铜溶液中加入过量氨水:Cu2+ +4NH3·H2O === [ Cu(NH3)4]2++4H2O
8. 氮化硼(BN)是一种重要的功能陶瓷材料,可通过反应B2O3+2NH32BN+3H2O制得。已知立方氮化硼的结构与金刚石相似,下列说法正确的是
A.立方氮化硼的晶体类型与干冰相同
B.基态原子未成对电子数:B<N<O
C.立方氮化硼中B原子的杂化轨道类型为sp2
D.1个立方氮化硼晶胞中含有4个N原子
9. 一种强力胶的黏合原理如下图所示。下列说法正确的是
A.Ⅰ有2种官能团 B.该反应为加成聚合反应
C.常温下Ⅱ为液体 D.Ⅱ可遇水溶解使黏合物分离
10.实验室只提供下列玻璃仪器 (非玻璃仪器任选),选用这些仪器不能完成的实验是
A.分离乙酸乙酯和饱和碳酸钠溶液 B.提取溴水中的溴单质
C.配制体积分数为75%的消毒酒精 D.重结晶法提纯苯甲酸
11. 苯巴比妥是一种镇静剂,结构如图所示。关于苯巴比妥的说法错误的是
A.分子中只含有1种官能团
B.分子中含有1个手性碳原子
C.在酸性条件下充分水解可以产生CO2
D.1 mol该物质最多可消耗4 mol NaOH
12. 利用下列装置或操作进行实验,能达到实验目的的是
13. 物质的结构决定其性质,下列实例与解释不相符的是
选项 实例 解释
A 逐个断开CH4中的C-H 键,每步所需能量不同 各步中的C-H键所处化学环境不同
B 分子的极性:OF2<H2O H2O分子之间存在氢键,增强了H2O分子的极性
C 分子中的键角:PH3<NH3 N电负性更大,键合电子间斥力更大,键角大
D 酸性:CCl3COOH>CH3COOH 电负性Cl>C>H,CCl3COOH中O-H键极性更强
14.某离子液体结构如图所示。W、X、Y、Z原子序数依次增大,W、X和Y的原子序数之和为14,Z是第4周期元素,基态Z原子核外电子占有8个能级。下列说法正确的是
A.沸点:XW4>YW3 B.键长:X-W<Y-W
C.该离子液体易挥发 D.Z的单质常温下呈液态
15. 环六糊精(D-吡喃葡萄糖缩合物)具有空腔结构,腔内极性较小,腔外极性较大,可包合某些分子形成超分子。图1、图2和图3分别表示环六糊精结构、超分子示意图及相关应用。下列说法正确的是
A.环六糊精属于多糖
B.图2中甲氧基邻位暴露在反应环境中
C.环六糊精靠共价键与某些分子形成超分子
D.可用水做溶剂分离环六糊精和氯代苯甲醚
二、非选择题(本题共4小题,共55分)
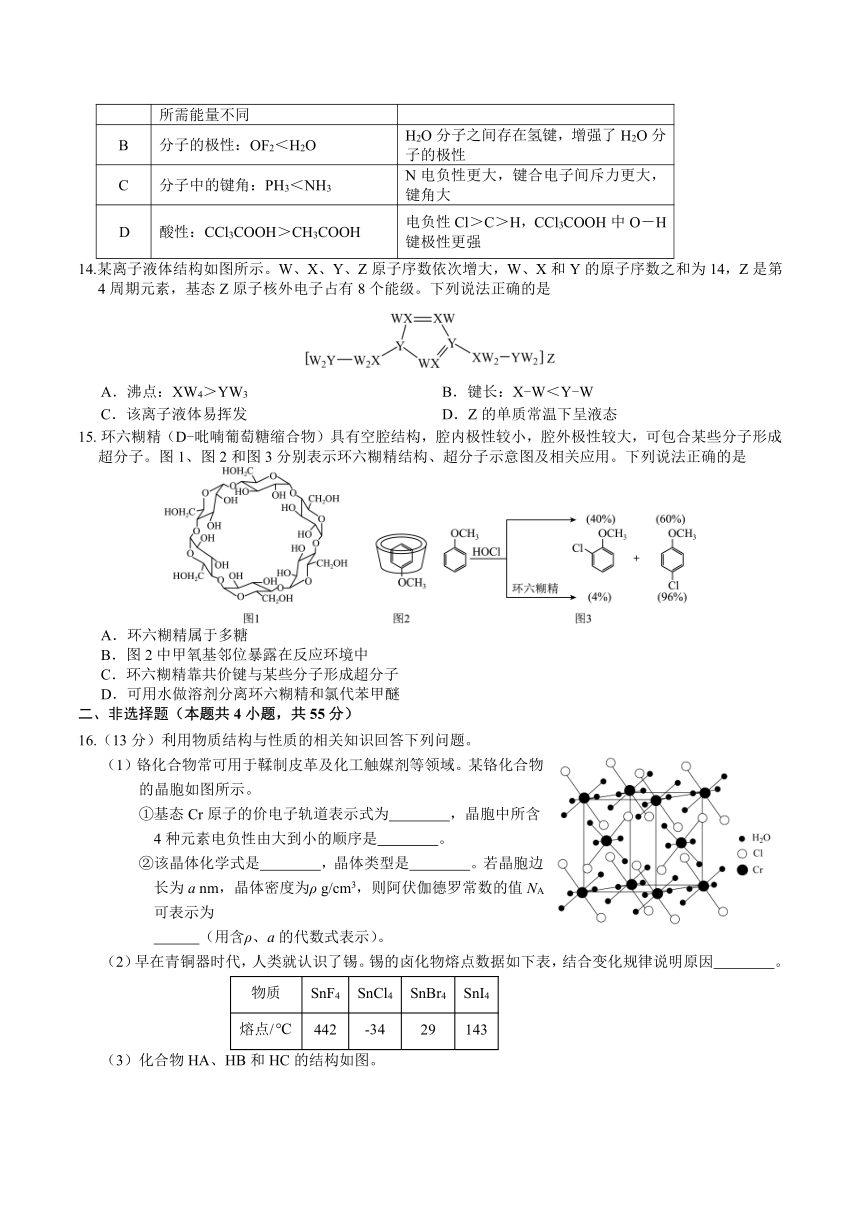
16.(13分)利用物质结构与性质的相关知识回答下列问题。
(1)铬化合物常可用于鞣制皮革及化工触媒剂等领域。某铬化合物的晶胞如图所示。
①基态Cr原子的价电子轨道表示式为 ,晶胞中所含4种元素电负性由大到小的顺序是 。
②该晶体化学式是 ,晶体类型是 。若晶胞边长为a nm,晶体密度为ρ g/cm3,则阿伏伽德罗常数的值NA可表示为
(用含ρ、a的代数式表示)。
(2)早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如下表,结合变化规律说明原因 。
物质 SnF4 SnCl4 SnBr4 SnI4
熔点/ 442 29 143
(3)化合物HA、HB和HC的结构如图。
HA、HB和HC中羟基与水均可形成氢键,请按形成的氢键由强到弱对三种化合物进行排序: ,理由是 。
17.(14分)苯氧乙酸是制备除草剂(2,4-二氯苯氧乙酸)的原料。
(1)制备苯氧乙酸的反应原理
①苯氧乙酸分子中所有原子 共平面(填“能”或“不能”),其分子中存在不同杂化形式的碳原子,其中杂化轨道数目较少的杂化形式为 。
②写出过程Ⅱ的反应方程式 。
(2)制备苯氧乙酸的实验过程
步骤1:如图装置所示,在三颈瓶中加入7.6 g氯乙酸和10 mL水,开动搅拌,慢慢滴加饱和Na2CO3溶液(约需16 mL ),至溶液pH为7~8,然后加入5.0 g苯酚,再慢慢滴加35%的NaOH溶液至反应混合液pH为12。
步骤2:将反应物在沸水浴中加热约0.5 h。反应过程中pH会下降,应补加NaOH溶液,保持pH为11~12,在沸水浴上再继续加热30 min,使反应完全。
步骤3:反应完毕后,将三口瓶移出水浴,趁热转入锥形瓶中,在搅拌下用浓盐酸酸化至pH为2~3。
步骤4:在冰水浴中冷却,析出固体,待结晶完全后,抽滤,洗涤,在60~65℃干燥,产量约6.0 g。
回答下列问题:
①仪器A的名称为 ,冷水应该从 口通入(填“b”或“c”)。
②装置中a的作用是 。步骤1中不能用NaOH溶液替代Na2CO3溶液理由是 。
③洗涤的具体操作是 。本实验产率最接近 (填标号)。
A.46% B.58% C.75% D.81%
18.(14分)三氯化钌(RuCl3)是一种重要的化工原料,广泛应用于催化、电镀等工业生产。从Co-Ru-Al2O3催化剂废料中分离制RuCl3和CoC2O4 xH2O的一种工艺流程如图。
请回答下列问题:
(1)Co位于元素周期表第 周期 族,CoC2O4 xH2O含有的化学键类型为 。
(2)“焙烧”后所得固体主要成分为CoO、Na2RuO4、NaNO2和 。
(3)“还原”过程会产生CH3CHO和Ru(OH)4沉淀,该反应的化学方程式为 。
(4)“酸溶”过程中,先加入盐酸溶解Ru(OH)4,然后加入盐酸羟胺(NH2OH·HCl)得到RuCl3和N2,则还原剂与氧化剂的物质的量之比为 。
(5)“沉钴”适宜温度为50℃,温度过高会使Co2+沉淀率下降,可能的原因是 。
(6)采用热重分析法测定草酸钴晶体样品所含结晶水数目,将样品加热到140℃时失掉1个结晶水,失重9.84%。CoC2O4 xH2O中x= 。
19.(14分)甲磺司特(G)是一种在临床上治疗支气管哮喘、特应性皮炎和过敏性鼻炎等疾病的药物。G的一种合成路线如下:
已知:
回答下列问题:
(1)A的官能团名称为 ,B的化学名称为 。
(2)D→E的反应类型为 。
(3)由E生成F的化学方程式为 。
(4)B生成C过程中,可用吡啶()代替K2CO3,说明理由 。
(5)同时满足下列条件的C的同分异构体共有 种。
a.核磁共振氢谱显示为4组峰,且峰面积比为;
b.红外光谱中存在C=O和硝基苯基()吸收峰。
(6)请结合题目所给信息,设计以和为原料,其他试剂任选,合成的合成路线 。
高中2023级第二学年末教学质量测试
化学参考答案和评分标准
说明:
1. 本答案供阅卷评分使用,试题的参考解答是用来说明评分标准的,考生如按其他方法或步骤解答,正确的同样给分;有错的,根据错误的性质,参照评分标准中相应的规定评分。
2. 化学专用名词中出现错别字、元素符号有错误,都要参照评分标准扣分。
3. 化学方程式、离子方程式未配平的,都不给分。
一、选择题(本题包括15小题,每小题3分,共45分。每小题只有一个选项符合题意)
1. C 2. A 3. C 4. B 5. B 6. A 7. C 8. D 9. B 10. D 11. B 12. A 13.B 14. D 15. D
二、非选择题(本题包括4小题,共58分)
16.(13分)
(1)①(1分) O>Cl>H>Cr(1分)
②CrCl2·4H2O(2分) 分子晶体(1分) NA=g/mol (2分)
(2)SnF4为离子晶体,熔点最高;后三个为分子晶体,熔点较低,随着相对分子质量增加,熔点逐渐升高。(2分)
(3)HC>HB>HA (2分) Se、S、O的电负性逐渐增大,使得HA、HB、HC中羟基的极性逐渐增大,其中羟基与H2O形成的氢键逐渐增强(2分)
17.(14分)
(1)①不能(1分) sp2(1分)
②(2分)
(2)①球形冷凝管(1分) b (1分)
②平衡气压,使试剂能顺利加入(2分) NaOH溶液碱性强,氯乙酸易水解(2分)
③向漏斗中加入冷水浸没晶体,待水自然流下,重复2-3次(2分) C(2分)
18.(14分)
(1)四或4(1分) VIII(1分) 离子键、共价键(2分)
(2)NaAlO2(2分)
(3)CH3CH2OH + Na2RuO4 + 2H2O == CH3CHO + Ru(OH)4↓+ 2NaOH(2分)
(4)1∶1(2分)
(5)温度过高,CoC2O4的溶解度增大(2分)
(6)2(2分)
19.(14分)
(1)硝基、碳氯键(2分) 对硝基苯酚(或4-硝基苯酚)(2分)
(2)还原反应(1分)
(3) + HCl +(2分)
(4)与产物HCl反应,促进B生成C的反应正向进行,提高产率(2分)
(5)6(2分)
(6)(3分)
高中2023级第二学年末教学质量测试
化 学
本试卷分为试题卷和答题卡两部分,其中试题卷由选择题和非选择题组成,共6页;答题卡共2页。满分100分,考试时间75分钟。
注意事项:
1. 答题前,考生务必将自己的学校、班级、姓名用0.5毫米黑色墨水签字笔填写清楚,同时用2B铅笔将考号准确填涂在“考号”栏目内。
2. 选择题使用2B铅笔填涂在答题卡对应题目标号的位置上,如需改动,用橡皮擦擦干净后再选涂其它答案;非选择题用0.5毫米黑色墨水签字笔书写在答题卡的对应框内,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。
3. 考试结束后将答题卡收回。
可能用到的相对原子质量:H 1 C 12 O 16 Si 28 Cl 35.5 Cr 52 Mn 55 Co 59
一、选择题(本题共15小题,每小题3分,共45分。每小题只有一个选项符合题意)
1. 我国屠呦呦等科学家从中药中提取出青蒿素,下列关于测定青蒿素结构的说法错误的是
A.X射线衍射技术可测定其分子结构 B.利用红外光谱法确定分子中含有酯基
C.通过元素定量分析可确定其分子式 D.通过化学反应证明分子中含有过氧基
2. 下列化学用语表示正确的是
A.SeO2的VSEPR模型: B.基态As核外电子排布式:[Ar]4s24p3
C.O3分子的球棍模型: D.HF分子中共价键示意图:
3. NA为阿伏伽德罗常数的值,下列说法正确的是
A.1mol正四面体烷 中含有σ键的数目是6NA
B.标准状况下,11.2 L甲醇中所含原子数目为3NA
C.1 mol C2H6与1 mol Cl2光照反应后的分子总数为2NA
D.40 g SiC晶体中所含有的Si-C键数目为2NA
4. 下列说法错误的是
A.离子晶体中Cl-的配位数:CsCl>NaCl
B.化学键中离子键成分的百分数:Na2O<Na2S
C.邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点
D.若Ni(CO)4 的沸点43℃,则C与Ni以共价键相连
5. 下列关于生物大分子的说法中错误的是
A.葡萄糖和核糖分子中均含羟基和醛基 B.蛋白质的二级结构与肽键的形成有关
C.核苷酸水解可能得到核苷和磷酸 D.油脂是高级脂肪酸的甘油酯,能水解
6. 下列说法中,错误的是
A. 核磁共振氢谱不能区分CH3CH2OH和CH3OCH3
B. 用溴水可以鉴别苯酚溶液、2,4 -己二烯和甲苯
C. 室温下,在水中的溶解度:甘油>苯酚>溴乙烷
D. 两种二肽互为同分异构体,二者的水解产物可能相同
7. 下列化学反应与方程式不相符的是
A.检验Fe2+:K++[Fe(CN)6]3-+Fe2+ === KFe[Fe(CN)6] ↓
B.甲胺与HCl:CH3NH2 + HCl → CH3NH3Cl
C.苯甲酰胺与盐酸共热:
D.硫酸铜溶液中加入过量氨水:Cu2+ +4NH3·H2O === [ Cu(NH3)4]2++4H2O
8. 氮化硼(BN)是一种重要的功能陶瓷材料,可通过反应B2O3+2NH32BN+3H2O制得。已知立方氮化硼的结构与金刚石相似,下列说法正确的是
A.立方氮化硼的晶体类型与干冰相同
B.基态原子未成对电子数:B<N<O
C.立方氮化硼中B原子的杂化轨道类型为sp2
D.1个立方氮化硼晶胞中含有4个N原子
9. 一种强力胶的黏合原理如下图所示。下列说法正确的是
A.Ⅰ有2种官能团 B.该反应为加成聚合反应
C.常温下Ⅱ为液体 D.Ⅱ可遇水溶解使黏合物分离
10.实验室只提供下列玻璃仪器 (非玻璃仪器任选),选用这些仪器不能完成的实验是
A.分离乙酸乙酯和饱和碳酸钠溶液 B.提取溴水中的溴单质
C.配制体积分数为75%的消毒酒精 D.重结晶法提纯苯甲酸
11. 苯巴比妥是一种镇静剂,结构如图所示。关于苯巴比妥的说法错误的是
A.分子中只含有1种官能团
B.分子中含有1个手性碳原子
C.在酸性条件下充分水解可以产生CO2
D.1 mol该物质最多可消耗4 mol NaOH
12. 利用下列装置或操作进行实验,能达到实验目的的是
13. 物质的结构决定其性质,下列实例与解释不相符的是
选项 实例 解释
A 逐个断开CH4中的C-H 键,每步所需能量不同 各步中的C-H键所处化学环境不同
B 分子的极性:OF2<H2O H2O分子之间存在氢键,增强了H2O分子的极性
C 分子中的键角:PH3<NH3 N电负性更大,键合电子间斥力更大,键角大
D 酸性:CCl3COOH>CH3COOH 电负性Cl>C>H,CCl3COOH中O-H键极性更强
14.某离子液体结构如图所示。W、X、Y、Z原子序数依次增大,W、X和Y的原子序数之和为14,Z是第4周期元素,基态Z原子核外电子占有8个能级。下列说法正确的是
A.沸点:XW4>YW3 B.键长:X-W<Y-W
C.该离子液体易挥发 D.Z的单质常温下呈液态
15. 环六糊精(D-吡喃葡萄糖缩合物)具有空腔结构,腔内极性较小,腔外极性较大,可包合某些分子形成超分子。图1、图2和图3分别表示环六糊精结构、超分子示意图及相关应用。下列说法正确的是
A.环六糊精属于多糖
B.图2中甲氧基邻位暴露在反应环境中
C.环六糊精靠共价键与某些分子形成超分子
D.可用水做溶剂分离环六糊精和氯代苯甲醚
二、非选择题(本题共4小题,共55分)
16.(13分)利用物质结构与性质的相关知识回答下列问题。
(1)铬化合物常可用于鞣制皮革及化工触媒剂等领域。某铬化合物的晶胞如图所示。
①基态Cr原子的价电子轨道表示式为 ,晶胞中所含4种元素电负性由大到小的顺序是 。
②该晶体化学式是 ,晶体类型是 。若晶胞边长为a nm,晶体密度为ρ g/cm3,则阿伏伽德罗常数的值NA可表示为
(用含ρ、a的代数式表示)。
(2)早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如下表,结合变化规律说明原因 。
物质 SnF4 SnCl4 SnBr4 SnI4
熔点/ 442 29 143
(3)化合物HA、HB和HC的结构如图。
HA、HB和HC中羟基与水均可形成氢键,请按形成的氢键由强到弱对三种化合物进行排序: ,理由是 。
17.(14分)苯氧乙酸是制备除草剂(2,4-二氯苯氧乙酸)的原料。
(1)制备苯氧乙酸的反应原理
①苯氧乙酸分子中所有原子 共平面(填“能”或“不能”),其分子中存在不同杂化形式的碳原子,其中杂化轨道数目较少的杂化形式为 。
②写出过程Ⅱ的反应方程式 。
(2)制备苯氧乙酸的实验过程
步骤1:如图装置所示,在三颈瓶中加入7.6 g氯乙酸和10 mL水,开动搅拌,慢慢滴加饱和Na2CO3溶液(约需16 mL ),至溶液pH为7~8,然后加入5.0 g苯酚,再慢慢滴加35%的NaOH溶液至反应混合液pH为12。
步骤2:将反应物在沸水浴中加热约0.5 h。反应过程中pH会下降,应补加NaOH溶液,保持pH为11~12,在沸水浴上再继续加热30 min,使反应完全。
步骤3:反应完毕后,将三口瓶移出水浴,趁热转入锥形瓶中,在搅拌下用浓盐酸酸化至pH为2~3。
步骤4:在冰水浴中冷却,析出固体,待结晶完全后,抽滤,洗涤,在60~65℃干燥,产量约6.0 g。
回答下列问题:
①仪器A的名称为 ,冷水应该从 口通入(填“b”或“c”)。
②装置中a的作用是 。步骤1中不能用NaOH溶液替代Na2CO3溶液理由是 。
③洗涤的具体操作是 。本实验产率最接近 (填标号)。
A.46% B.58% C.75% D.81%
18.(14分)三氯化钌(RuCl3)是一种重要的化工原料,广泛应用于催化、电镀等工业生产。从Co-Ru-Al2O3催化剂废料中分离制RuCl3和CoC2O4 xH2O的一种工艺流程如图。
请回答下列问题:
(1)Co位于元素周期表第 周期 族,CoC2O4 xH2O含有的化学键类型为 。
(2)“焙烧”后所得固体主要成分为CoO、Na2RuO4、NaNO2和 。
(3)“还原”过程会产生CH3CHO和Ru(OH)4沉淀,该反应的化学方程式为 。
(4)“酸溶”过程中,先加入盐酸溶解Ru(OH)4,然后加入盐酸羟胺(NH2OH·HCl)得到RuCl3和N2,则还原剂与氧化剂的物质的量之比为 。
(5)“沉钴”适宜温度为50℃,温度过高会使Co2+沉淀率下降,可能的原因是 。
(6)采用热重分析法测定草酸钴晶体样品所含结晶水数目,将样品加热到140℃时失掉1个结晶水,失重9.84%。CoC2O4 xH2O中x= 。
19.(14分)甲磺司特(G)是一种在临床上治疗支气管哮喘、特应性皮炎和过敏性鼻炎等疾病的药物。G的一种合成路线如下:
已知:
回答下列问题:
(1)A的官能团名称为 ,B的化学名称为 。
(2)D→E的反应类型为 。
(3)由E生成F的化学方程式为 。
(4)B生成C过程中,可用吡啶()代替K2CO3,说明理由 。
(5)同时满足下列条件的C的同分异构体共有 种。
a.核磁共振氢谱显示为4组峰,且峰面积比为;
b.红外光谱中存在C=O和硝基苯基()吸收峰。
(6)请结合题目所给信息,设计以和为原料,其他试剂任选,合成的合成路线 。
高中2023级第二学年末教学质量测试
化学参考答案和评分标准
说明:
1. 本答案供阅卷评分使用,试题的参考解答是用来说明评分标准的,考生如按其他方法或步骤解答,正确的同样给分;有错的,根据错误的性质,参照评分标准中相应的规定评分。
2. 化学专用名词中出现错别字、元素符号有错误,都要参照评分标准扣分。
3. 化学方程式、离子方程式未配平的,都不给分。
一、选择题(本题包括15小题,每小题3分,共45分。每小题只有一个选项符合题意)
1. C 2. A 3. C 4. B 5. B 6. A 7. C 8. D 9. B 10. D 11. B 12. A 13.B 14. D 15. D
二、非选择题(本题包括4小题,共58分)
16.(13分)
(1)①(1分) O>Cl>H>Cr(1分)
②CrCl2·4H2O(2分) 分子晶体(1分) NA=g/mol (2分)
(2)SnF4为离子晶体,熔点最高;后三个为分子晶体,熔点较低,随着相对分子质量增加,熔点逐渐升高。(2分)
(3)HC>HB>HA (2分) Se、S、O的电负性逐渐增大,使得HA、HB、HC中羟基的极性逐渐增大,其中羟基与H2O形成的氢键逐渐增强(2分)
17.(14分)
(1)①不能(1分) sp2(1分)
②(2分)
(2)①球形冷凝管(1分) b (1分)
②平衡气压,使试剂能顺利加入(2分) NaOH溶液碱性强,氯乙酸易水解(2分)
③向漏斗中加入冷水浸没晶体,待水自然流下,重复2-3次(2分) C(2分)
18.(14分)
(1)四或4(1分) VIII(1分) 离子键、共价键(2分)
(2)NaAlO2(2分)
(3)CH3CH2OH + Na2RuO4 + 2H2O == CH3CHO + Ru(OH)4↓+ 2NaOH(2分)
(4)1∶1(2分)
(5)温度过高,CoC2O4的溶解度增大(2分)
(6)2(2分)
19.(14分)
(1)硝基、碳氯键(2分) 对硝基苯酚(或4-硝基苯酚)(2分)
(2)还原反应(1分)
(3) + HCl +(2分)
(4)与产物HCl反应,促进B生成C的反应正向进行,提高产率(2分)
(5)6(2分)
(6)(3分)
同课章节目录
