江西省宜春市丰城市丰城中学2024-2025学年高一下学期期末化学试卷(含答案)
文档属性
| 名称 | 江西省宜春市丰城市丰城中学2024-2025学年高一下学期期末化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-25 11:01:55 | ||
图片预览



文档简介
丰城中学2024-2025学年下学期高一期末考试试卷化 学
相对原子质量:H-1 C-12 O-16 S-32 Zn-65 Cu-64 Pb-207
单选题(每题只有一个答案,每题3分,共42分)
1.合理的工业设计和能源利用是实现可持续发展、减少环境污染的关键手段。下列有关说法错误的是( )
A.燃煤脱硫不仅能减少酸雨,也有利于减缓温室效应和消除光化学污染
B.加强新能源汽车动力电池回收利用,不仅能变废为宝,还能防止环境污染
C.使用生物材质代替聚乙烯塑料盛装饮品,可以减少“白色污染”
D.工业合成氯乙烷采用加成反应比采用取代反应更符合“绿色化学”理念
2.设为阿伏加德罗常数的值。下列说法正确的是( )
A.一定条件下,0.5mol N2和1.5mol H2混合反应后,分子总数为NA
B.常温下常压下,78g苯分子中含有的碳碳双键数目为3NA
C.常温常压下,28gC2H4与C3H6混合气体中含有碳原子数为2NA
D.含2mol H2SO4的浓硫酸与64g Cu共热,生成SO2分子数为NA
3.下列有关有机物的说法正确的是( )
A.一氯甲烷的电子式: B.和 二者为同一种物质
C.C2H4和C3H6一定互为同系物 D.四氯化碳分子的空间填充模型:
4.下列有关物质的性质与用途具有对应关系的是( )
A.SO2属于酸性氧化物——能防止葡萄酒中的一些成分被氧化
B.叔丁基对苯二酚(TBHQ)具有还原性——可用作抗氧化剂
C.NH3极易溶于水——液氨可用作制冷剂
D.氢氧化铁胶体具有吸附性——可用于水体的杀菌和消毒
5.下列反应对应的方程式正确的是( )
A.少量乙酸和碳酸钠溶液反应:
B.丙烯与单质溴发生加成反应:
C.少量SO2与NaClO溶液反应:
D.过量的铁粉与稀硝酸反应:
6.类推的思维方法可以预测许多物质的性质。类比是相对的,不能违背客观事实。下列类比分析结果正确的是( )
A.Fe与S加热直接化合生成FeS,则Cu与S加热也能直接化合生成Cu2S
B.Na与H2O反应生成NaOH和H2,则Fe与H2O反应生成Fe(OH)2和H2
C.SO2通入BaCl2溶液不产生沉淀,则SO2通入Ba(NO3)2溶液也不产生沉淀
D.Si是半导体材料,同族的Ge是半导体材料,则IVA族的元素单质都是半导体材料
7.山梨酸是一种常用的食品防腐剂,其结构简式(每一个端点或转折点均表示一个碳原子)如图所示,下列说法不正确的是( )
A.山梨酸的分子式为
B.山梨酸分子中含有三种官能团
C.1mol山梨酸与足量的NaOH反应,需消耗
D.1mol山梨酸与足量的Na反应,生成标况下氢气体积约为22.4L
8.下列有关电化学知识的叙述正确的是( )
A.反应CaO+H2O=Ca(OH)2可以放出大量的热,故可将该反应设计成原电池,使其中的化学能转化为电能
B.某原电池反应为Cu+2AgNO3=Cu(NO3)2+2Ag,装置的盐桥中可以是装有含琼脂的KCl饱和溶液
C.原电池的两极可以是同样的材料
D.将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,则铁作负极,铜作正极
9.新型Zn-PbO2原电池工作原理如图所示,双极膜中间层中的H2O解离为H+和OH-并可通过阴、阳膜定向移动。下列说法正确的是( )
A.PbO2是原电池的负极,发生氧化反应
B.电子流向:Zn电极→导线→PbO2电极→双极膜→Zn电极
C.双极膜中OH-向Ⅰ室迁移
D.理论上当转移1 mol e-时,则正极增重32 g
10.有机物的结构可用键线式表示。如CH3—CH=CH—CH3可简写为。有机物X的键线式为。下列说法不正确的是( )
A.X的分子式为C8H8
B.有机物Y是X的同分异构体,则Y的结构简式可能为
C.X能使酸性高锰酸钾溶液褪色
D.X与足量的H2在一定条件下反应可生成环状饱和烃Z,Z的一氯代物有4种
11.下列除杂所选用的试剂及操作方法不合理的是( )
选项 物质(杂质) 除杂试剂 操作
A 固体 NaOH溶液 加入过量NaOH溶液,充分反应后过滤
B NaCl固体 ——— 加热
C 通入
D 溶液 Fe粉 加入过量Fe粉,充分反应后过滤
A.A B.B C.C D.D
12.下列叙述与图像不相对应的是( )
A.图1表示反应速率时间图像,时改变的条件可能是减小压强
B.图2是温度和压强对反应影响的示意图,则X、Y、Z均为气态
C.图3表示与足量盐酸的反应速率时间图像,其中段速率增大的原因是反应放热,溶液温度逐渐升高
D.图4可知,反应,a、b、c三点所处的平衡状态中,反应物的转化率最高的是c点
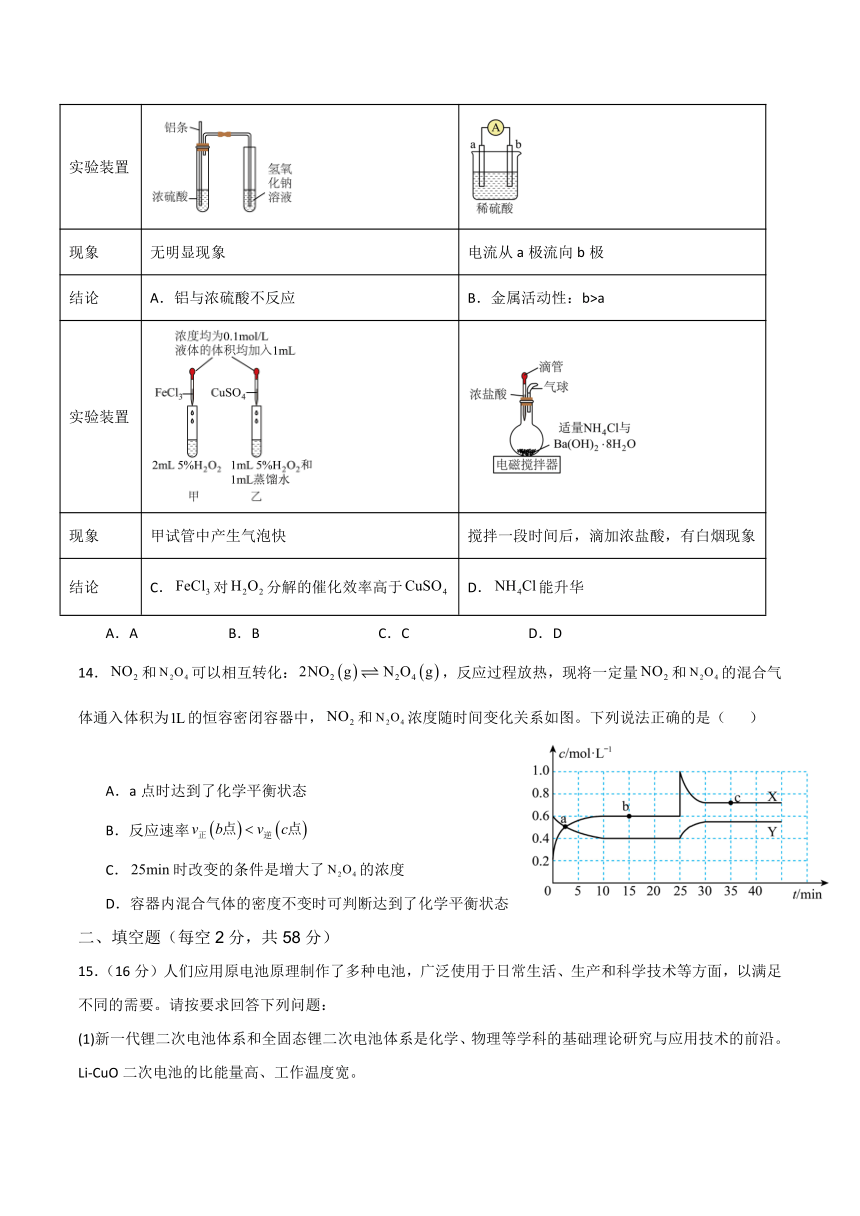
13.下列根据实验装置和现象能得出相应结论的是( )
实验装置
现象 无明显现象 电流从a极流向b极
结论 A.铝与浓硫酸不反应 B.金属活动性:b>a
实验装置
现象 甲试管中产生气泡快 搅拌一段时间后,滴加浓盐酸,有白烟现象
结论 C.对分解的催化效率高于 D.能升华
A.A B.B C.C D.D
14.和可以相互转化:,反应过程放热,现将一定量和的混合气体通入体积为的恒容密闭容器中,和浓度随时间变化关系如图。下列说法正确的是( )
A.a点时达到了化学平衡状态
B.反应速率
C.时改变的条件是增大了的浓度
D.容器内混合气体的密度不变时可判断达到了化学平衡状态
二、填空题(每空2分,共58分)
15.(16分)人们应用原电池原理制作了多种电池,广泛使用于日常生活、生产和科学技术等方面,以满足不同的需要。请按要求回答下列问题:
(1)新一代锂二次电池体系和全固态锂二次电池体系是化学、物理等学科的基础理论研究与应用技术的前沿。Li-CuO二次电池的比能量高、工作温度宽。
一种制备CuO的过程如图:
写出酸浸反应不能温度过高的原因: ,写出“混合沉淀”过程产生Cu2(OH)2CO3反应的离子方程式: 。
(2)NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示。该电池在放电过程中石墨I电极上生成可循环使用的N2O5。
①放电时,该电池的负极是 (填“石墨I”或“石墨II”)。其电极方程式为: 。
②若电路中有2mol电子转移,则理论上石墨II处需消耗标准状况下的O2为 L。
(3)某兴趣小组对原电池进行性能改进研究,并利用改进后的原电池装置进行物质验证实验。
已知:本题中涉及的盐桥由和琼脂组成。回答下列问题:
①装置2工作时,盐桥中的向 (填“左”或“右”)移动。
②装置2中,当电路中转移电子,理论上石墨电极质量增加 g。
③在酸化的溶液中滴加适量的溶液,振荡,溶液褪色,为确认氧化产物为,可利用装置3进行实验。闭合开关K,反应一段时间后,观察到石墨极烧杯中溶液褪色。
实验结束后,请设计实验证明氧化产物为: 。
16.(14分)氮氧化物的污染是化学研究的重要课题之一。
(1)在一定条件下可将还原。甲同学在实验室对该反应进行了探究。实验装置如图(部分夹持装置省略)。
①装置B内盛装的试剂是 ;装置D中的离子方程式为 。
②装置M中和充分反应,生成两种对环境友好的物质,该反应的化学方程式为 ;气球的作用是 。
(2)利用NaClO吸收液可在脱除烟气中的同时脱除,喷淋吸收塔装置(如下图一)中脱硝(NO)反应的离子方程式为 ,研究发现:在不同的初始pH条件下,吸收液对流动烟气中NO的脱除率如下图二所示。反应时间为60min时,由图可知,pH越小,NO脱除率越小,原因是 。
(3)工业制的尾气中含有和NO,用NaOH溶液吸收时的化学方程式为:;。现将平均组成为的NO、混合气体,通入足量NaOH溶液中,充分反应后无气体剩余,则x的取值范围为 。
17.(16分)A的产量可以用来衡量一个国家石油化学工业的发展水平。以A为原料合成香料G和高分子材料H的流程如下:
请回答下列问题:
(1)A→H的反应类型为 ,反应⑥的反应类型为 。
(2)C中官能团名称 ,常用检验该官能团的一种试剂 (填名称)。
(3)1molF与足量金属钠反应可产生 L气体(标准状况)。
(4)已知同一个碳原子上不能连接两个羟基,则的同分异构体中与F互为同系物的有 种。
(5)写出反应②的化学方程式 。
(6)有关上述物质的说法错误的是 。
a.可通过酸性高锰酸钾溶液洗气的方法除去乙烷中含有的A杂质
b.B可以与酸性重铬酸钾溶液反应生成D
c.反应②中B断裂了C-H键和O-H键
d.C和E互为同分异构体
e.H可以使溴水褪色
18.(12分)工业燃煤过程产生大量含硫烟气,研究烟气脱硫具有重要意义。回答下列问题:
方法一:还原脱硫
(1)已知:
则还原脱硫原理: 。
(2)在某恒温、恒容的密闭容器中,充入和发生反应:,下列描述可表示该反应达到平衡状态的有________(填序号)。
A.的浓度保持不变 B.混合气体密度保持不变
C. D.单位时间内生成和的量相等
方法二:还原脱硫
反应原理:Ⅰ.
Ⅱ.
(3)在不同催化剂条件下,的转化率随温度变化的曲线如图所示。
综合考虑,工业生成过程中选择的最佳催化剂是 ;若选择催化剂,的转化率随温度升高先减小后增大,则的转化率增大的原因是 。
(4)一定条件下,在压强为的恒压密闭容器中按体积比为充入、、发生反应I和II。测得的平衡转化率为80%,的平衡转化率为50%,则达到平衡时,的分压 ,反应II的压强平衡常数 (用平衡分压计算)。
参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 A C B B D A D C D D
题号 11 12 13 14
答案 C B B B
15.(1)温度过高H2O2会分解 2Cu2+++2NH3·H2O=Cu2(OH)2CO3↓+2
(2) 石墨I NO2 +-e-=N2O5 11.2
(3) 左 3.2
取少量电极附近溶液于试管中,滴加足量盐酸,再滴加适量溶液,产生白色沉淀,则证明氧化产物有
16.(1) 碱石灰 吸收尾气,防止污染空气
(2) pH越小,酸性越强,与结合生成了HClO,HClO见光分解后导致NaClO减少,使NO脱除率降低
(3)
17.(1)加聚反应 取代反应
(2) 醛基 银氨溶液或新制氢氧化铜
(3)22.4 (4)5
(5)2CH3CH2OH+O22CH3CHO+2H2O (6)ae
18.(1) (2)ABD
(3) Cat.3 温度升高,催化剂的活性增强,反应速率加快,的转化率增大
(4) 2
相对原子质量:H-1 C-12 O-16 S-32 Zn-65 Cu-64 Pb-207
单选题(每题只有一个答案,每题3分,共42分)
1.合理的工业设计和能源利用是实现可持续发展、减少环境污染的关键手段。下列有关说法错误的是( )
A.燃煤脱硫不仅能减少酸雨,也有利于减缓温室效应和消除光化学污染
B.加强新能源汽车动力电池回收利用,不仅能变废为宝,还能防止环境污染
C.使用生物材质代替聚乙烯塑料盛装饮品,可以减少“白色污染”
D.工业合成氯乙烷采用加成反应比采用取代反应更符合“绿色化学”理念
2.设为阿伏加德罗常数的值。下列说法正确的是( )
A.一定条件下,0.5mol N2和1.5mol H2混合反应后,分子总数为NA
B.常温下常压下,78g苯分子中含有的碳碳双键数目为3NA
C.常温常压下,28gC2H4与C3H6混合气体中含有碳原子数为2NA
D.含2mol H2SO4的浓硫酸与64g Cu共热,生成SO2分子数为NA
3.下列有关有机物的说法正确的是( )
A.一氯甲烷的电子式: B.和 二者为同一种物质
C.C2H4和C3H6一定互为同系物 D.四氯化碳分子的空间填充模型:
4.下列有关物质的性质与用途具有对应关系的是( )
A.SO2属于酸性氧化物——能防止葡萄酒中的一些成分被氧化
B.叔丁基对苯二酚(TBHQ)具有还原性——可用作抗氧化剂
C.NH3极易溶于水——液氨可用作制冷剂
D.氢氧化铁胶体具有吸附性——可用于水体的杀菌和消毒
5.下列反应对应的方程式正确的是( )
A.少量乙酸和碳酸钠溶液反应:
B.丙烯与单质溴发生加成反应:
C.少量SO2与NaClO溶液反应:
D.过量的铁粉与稀硝酸反应:
6.类推的思维方法可以预测许多物质的性质。类比是相对的,不能违背客观事实。下列类比分析结果正确的是( )
A.Fe与S加热直接化合生成FeS,则Cu与S加热也能直接化合生成Cu2S
B.Na与H2O反应生成NaOH和H2,则Fe与H2O反应生成Fe(OH)2和H2
C.SO2通入BaCl2溶液不产生沉淀,则SO2通入Ba(NO3)2溶液也不产生沉淀
D.Si是半导体材料,同族的Ge是半导体材料,则IVA族的元素单质都是半导体材料
7.山梨酸是一种常用的食品防腐剂,其结构简式(每一个端点或转折点均表示一个碳原子)如图所示,下列说法不正确的是( )
A.山梨酸的分子式为
B.山梨酸分子中含有三种官能团
C.1mol山梨酸与足量的NaOH反应,需消耗
D.1mol山梨酸与足量的Na反应,生成标况下氢气体积约为22.4L
8.下列有关电化学知识的叙述正确的是( )
A.反应CaO+H2O=Ca(OH)2可以放出大量的热,故可将该反应设计成原电池,使其中的化学能转化为电能
B.某原电池反应为Cu+2AgNO3=Cu(NO3)2+2Ag,装置的盐桥中可以是装有含琼脂的KCl饱和溶液
C.原电池的两极可以是同样的材料
D.将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,则铁作负极,铜作正极
9.新型Zn-PbO2原电池工作原理如图所示,双极膜中间层中的H2O解离为H+和OH-并可通过阴、阳膜定向移动。下列说法正确的是( )
A.PbO2是原电池的负极,发生氧化反应
B.电子流向:Zn电极→导线→PbO2电极→双极膜→Zn电极
C.双极膜中OH-向Ⅰ室迁移
D.理论上当转移1 mol e-时,则正极增重32 g
10.有机物的结构可用键线式表示。如CH3—CH=CH—CH3可简写为。有机物X的键线式为。下列说法不正确的是( )
A.X的分子式为C8H8
B.有机物Y是X的同分异构体,则Y的结构简式可能为
C.X能使酸性高锰酸钾溶液褪色
D.X与足量的H2在一定条件下反应可生成环状饱和烃Z,Z的一氯代物有4种
11.下列除杂所选用的试剂及操作方法不合理的是( )
选项 物质(杂质) 除杂试剂 操作
A 固体 NaOH溶液 加入过量NaOH溶液,充分反应后过滤
B NaCl固体 ——— 加热
C 通入
D 溶液 Fe粉 加入过量Fe粉,充分反应后过滤
A.A B.B C.C D.D
12.下列叙述与图像不相对应的是( )
A.图1表示反应速率时间图像,时改变的条件可能是减小压强
B.图2是温度和压强对反应影响的示意图,则X、Y、Z均为气态
C.图3表示与足量盐酸的反应速率时间图像,其中段速率增大的原因是反应放热,溶液温度逐渐升高
D.图4可知,反应,a、b、c三点所处的平衡状态中,反应物的转化率最高的是c点
13.下列根据实验装置和现象能得出相应结论的是( )
实验装置
现象 无明显现象 电流从a极流向b极
结论 A.铝与浓硫酸不反应 B.金属活动性:b>a
实验装置
现象 甲试管中产生气泡快 搅拌一段时间后,滴加浓盐酸,有白烟现象
结论 C.对分解的催化效率高于 D.能升华
A.A B.B C.C D.D
14.和可以相互转化:,反应过程放热,现将一定量和的混合气体通入体积为的恒容密闭容器中,和浓度随时间变化关系如图。下列说法正确的是( )
A.a点时达到了化学平衡状态
B.反应速率
C.时改变的条件是增大了的浓度
D.容器内混合气体的密度不变时可判断达到了化学平衡状态
二、填空题(每空2分,共58分)
15.(16分)人们应用原电池原理制作了多种电池,广泛使用于日常生活、生产和科学技术等方面,以满足不同的需要。请按要求回答下列问题:
(1)新一代锂二次电池体系和全固态锂二次电池体系是化学、物理等学科的基础理论研究与应用技术的前沿。Li-CuO二次电池的比能量高、工作温度宽。
一种制备CuO的过程如图:
写出酸浸反应不能温度过高的原因: ,写出“混合沉淀”过程产生Cu2(OH)2CO3反应的离子方程式: 。
(2)NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示。该电池在放电过程中石墨I电极上生成可循环使用的N2O5。
①放电时,该电池的负极是 (填“石墨I”或“石墨II”)。其电极方程式为: 。
②若电路中有2mol电子转移,则理论上石墨II处需消耗标准状况下的O2为 L。
(3)某兴趣小组对原电池进行性能改进研究,并利用改进后的原电池装置进行物质验证实验。
已知:本题中涉及的盐桥由和琼脂组成。回答下列问题:
①装置2工作时,盐桥中的向 (填“左”或“右”)移动。
②装置2中,当电路中转移电子,理论上石墨电极质量增加 g。
③在酸化的溶液中滴加适量的溶液,振荡,溶液褪色,为确认氧化产物为,可利用装置3进行实验。闭合开关K,反应一段时间后,观察到石墨极烧杯中溶液褪色。
实验结束后,请设计实验证明氧化产物为: 。
16.(14分)氮氧化物的污染是化学研究的重要课题之一。
(1)在一定条件下可将还原。甲同学在实验室对该反应进行了探究。实验装置如图(部分夹持装置省略)。
①装置B内盛装的试剂是 ;装置D中的离子方程式为 。
②装置M中和充分反应,生成两种对环境友好的物质,该反应的化学方程式为 ;气球的作用是 。
(2)利用NaClO吸收液可在脱除烟气中的同时脱除,喷淋吸收塔装置(如下图一)中脱硝(NO)反应的离子方程式为 ,研究发现:在不同的初始pH条件下,吸收液对流动烟气中NO的脱除率如下图二所示。反应时间为60min时,由图可知,pH越小,NO脱除率越小,原因是 。
(3)工业制的尾气中含有和NO,用NaOH溶液吸收时的化学方程式为:;。现将平均组成为的NO、混合气体,通入足量NaOH溶液中,充分反应后无气体剩余,则x的取值范围为 。
17.(16分)A的产量可以用来衡量一个国家石油化学工业的发展水平。以A为原料合成香料G和高分子材料H的流程如下:
请回答下列问题:
(1)A→H的反应类型为 ,反应⑥的反应类型为 。
(2)C中官能团名称 ,常用检验该官能团的一种试剂 (填名称)。
(3)1molF与足量金属钠反应可产生 L气体(标准状况)。
(4)已知同一个碳原子上不能连接两个羟基,则的同分异构体中与F互为同系物的有 种。
(5)写出反应②的化学方程式 。
(6)有关上述物质的说法错误的是 。
a.可通过酸性高锰酸钾溶液洗气的方法除去乙烷中含有的A杂质
b.B可以与酸性重铬酸钾溶液反应生成D
c.反应②中B断裂了C-H键和O-H键
d.C和E互为同分异构体
e.H可以使溴水褪色
18.(12分)工业燃煤过程产生大量含硫烟气,研究烟气脱硫具有重要意义。回答下列问题:
方法一:还原脱硫
(1)已知:
则还原脱硫原理: 。
(2)在某恒温、恒容的密闭容器中,充入和发生反应:,下列描述可表示该反应达到平衡状态的有________(填序号)。
A.的浓度保持不变 B.混合气体密度保持不变
C. D.单位时间内生成和的量相等
方法二:还原脱硫
反应原理:Ⅰ.
Ⅱ.
(3)在不同催化剂条件下,的转化率随温度变化的曲线如图所示。
综合考虑,工业生成过程中选择的最佳催化剂是 ;若选择催化剂,的转化率随温度升高先减小后增大,则的转化率增大的原因是 。
(4)一定条件下,在压强为的恒压密闭容器中按体积比为充入、、发生反应I和II。测得的平衡转化率为80%,的平衡转化率为50%,则达到平衡时,的分压 ,反应II的压强平衡常数 (用平衡分压计算)。
参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 A C B B D A D C D D
题号 11 12 13 14
答案 C B B B
15.(1)温度过高H2O2会分解 2Cu2+++2NH3·H2O=Cu2(OH)2CO3↓+2
(2) 石墨I NO2 +-e-=N2O5 11.2
(3) 左 3.2
取少量电极附近溶液于试管中,滴加足量盐酸,再滴加适量溶液,产生白色沉淀,则证明氧化产物有
16.(1) 碱石灰 吸收尾气,防止污染空气
(2) pH越小,酸性越强,与结合生成了HClO,HClO见光分解后导致NaClO减少,使NO脱除率降低
(3)
17.(1)加聚反应 取代反应
(2) 醛基 银氨溶液或新制氢氧化铜
(3)22.4 (4)5
(5)2CH3CH2OH+O22CH3CHO+2H2O (6)ae
18.(1) (2)ABD
(3) Cat.3 温度升高,催化剂的活性增强,反应速率加快,的转化率增大
(4) 2
同课章节目录
