第一章 物质及变化 易错知识点 强化练 2025--2026学年上学期高中化学人教版(2019) 必修第一册
文档属性
| 名称 | 第一章 物质及变化 易错知识点 强化练 2025--2026学年上学期高中化学人教版(2019) 必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 543.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-25 16:46:33 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
物质及变化 易错知识点 强化练
2025--2026学年上学期高中化学人教版(2019) 必修第一册
一、单选题
1.按物质组成分类,属于
A.酸 B.碱 C.盐 D.混合物
2.下列诗词中不涉及氧化还原反应的是
A.爆竹声中一岁除 B.吹尽狂沙始到金
C.野火烧不尽 D.蜡炬成灰泪始干
3.物质的转化是化学学习的重要内容,甲、乙、丙所代表的物质不符合如图所示转化关系的是
A. NaOH B.CuO
C. Fe D. NaCl
4.下列实验中的颜色变化与氧化还原反应有关的是
A.通入品红溶液中,溶液由红色变为无色
B.KI溶液滴入AgCl浊液中,沉淀由白色变为黄色
C.稀硫酸滴入溶液中,溶液由黄色变为橙色
D.苯酚长时间放置在空气中,晶体由无色变为粉红色
5.下列离子方程式中正确的是
A.向碳酸钠溶液中逐滴加入稀盐酸:CO+2H+=CO2↑+H2O
B.氧化铁粉末溶于稀盐酸:Fe2O3+6H+=2Fe3++3H2O
C.硫酸滴加到氢氧化钡溶液中:H++OH-=H2O
D.钠与水反应:Na+H2O=Na++OH-+H2↑
6.下列反应中,既是化合反应,又是氧化还原反应的是
A.生石灰与水反应:
B.氯气通入溴化钠溶液:
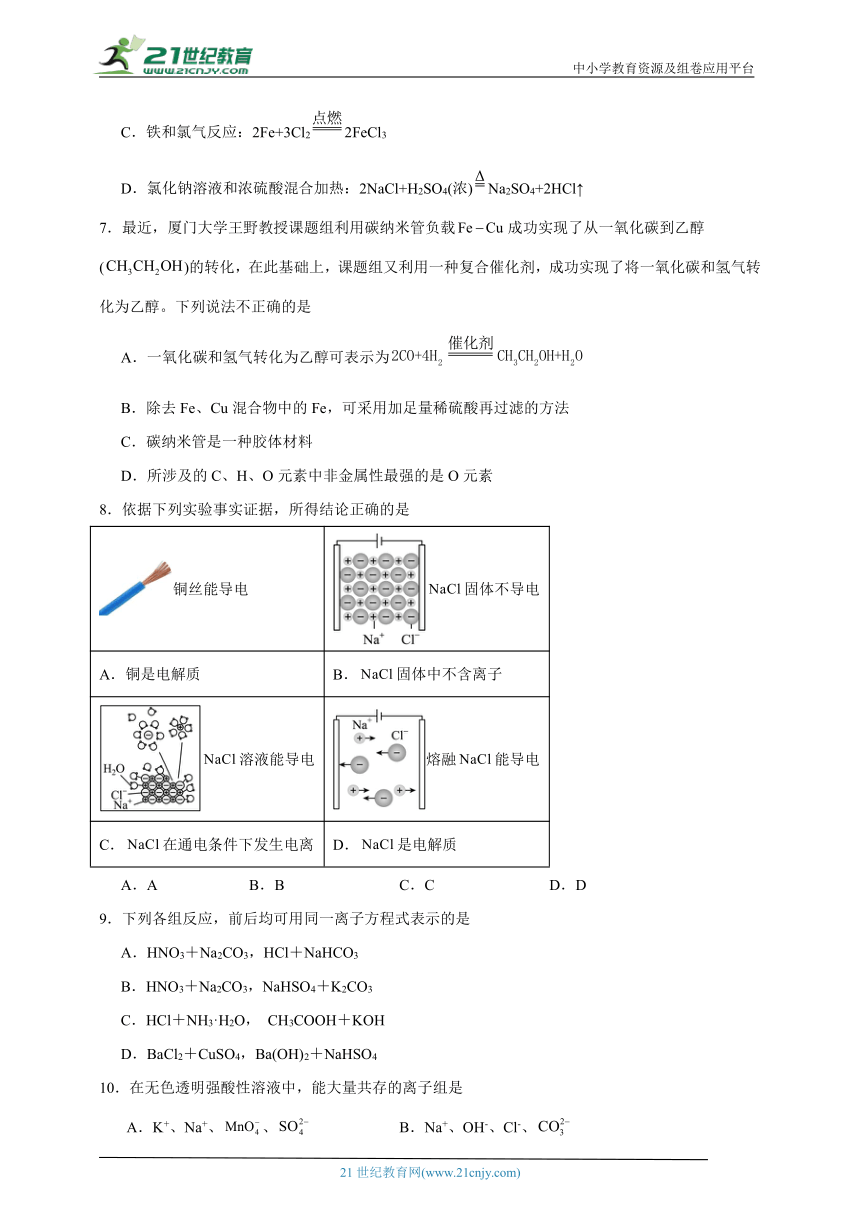
C.铁和氯气反应:2Fe+3Cl22FeCl3
D.氯化钠溶液和浓硫酸混合加热:2NaCl+H2SO4(浓)Na2SO4+2HCl↑
7.最近,厦门大学王野教授课题组利用碳纳米管负载成功实现了从一氧化碳到乙醇()的转化,在此基础上,课题组又利用一种复合催化剂,成功实现了将一氧化碳和氢气转化为乙醇。下列说法不正确的是
A.一氧化碳和氢气转化为乙醇可表示为
B.除去Fe、Cu混合物中的Fe,可采用加足量稀硫酸再过滤的方法
C.碳纳米管是一种胶体材料
D.所涉及的C、H、O元素中非金属性最强的是O元素
8.依据下列实验事实证据,所得结论正确的是
铜丝能导电 固体不导电
A.铜是电解质 B.固体中不含离子
溶液能导电 熔融能导电
C.在通电条件下发生电离 D.是电解质
A.A B.B C.C D.D
9.下列各组反应,前后均可用同一离子方程式表示的是
A.HNO3+Na2CO3,HCl+NaHCO3
B.HNO3+Na2CO3,NaHSO4+K2CO3
C.HCl+NH3·H2O, CH3COOH+KOH
D.BaCl2+CuSO4,Ba(OH)2+NaHSO4
10.在无色透明强酸性溶液中,能大量共存的离子组是
A.K+、Na+、、 B.Na+、OH-、Cl-、
C.Zn2+、Al3+、Cl-、 D.Na+、Fe2+、、Ba2+
11.粗食盐水中常含有少量Ca2+、Mg2+、杂质离子,实验室提纯粗食盐水制取食盐的流程如下,关于实验过程中所选用的试剂、目的及所发生反应的离子方程式均正确的是
选项 试剂 目的 离子方程式
A KOH溶液 仅除去Mg2+ Mg2++2OH-=Mg(OH)2↓
B BaCl2溶液 仅除去 Ba2++Na2SO4=BaSO4↓+2Na+
C Na2CO3溶液 仅除去Ca2+ Ca2++=CaCO3↓
D 盐酸 除去OH-和 H++OH-=H2O 2H++=CO2↑+H2O
A.A B.B C.C D.D
12.关于反应:的叙述不正确的是
A.既是氧化剂又是还原剂
B.发生了分解反应
C.只有氮元素价态变化了
D.氧化产物和还原产物质量比为9∶7
13.12 mL 0.1 mol·L-1的Na2SO3溶液恰好与20 mL 0.02 mol·L-1的K2Cr2O7(重铬酸钾)溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则Cr在还原产物中的化合价为( )
A.+2 B.+3 C.+4 D.+5
14.下列说法错误的是
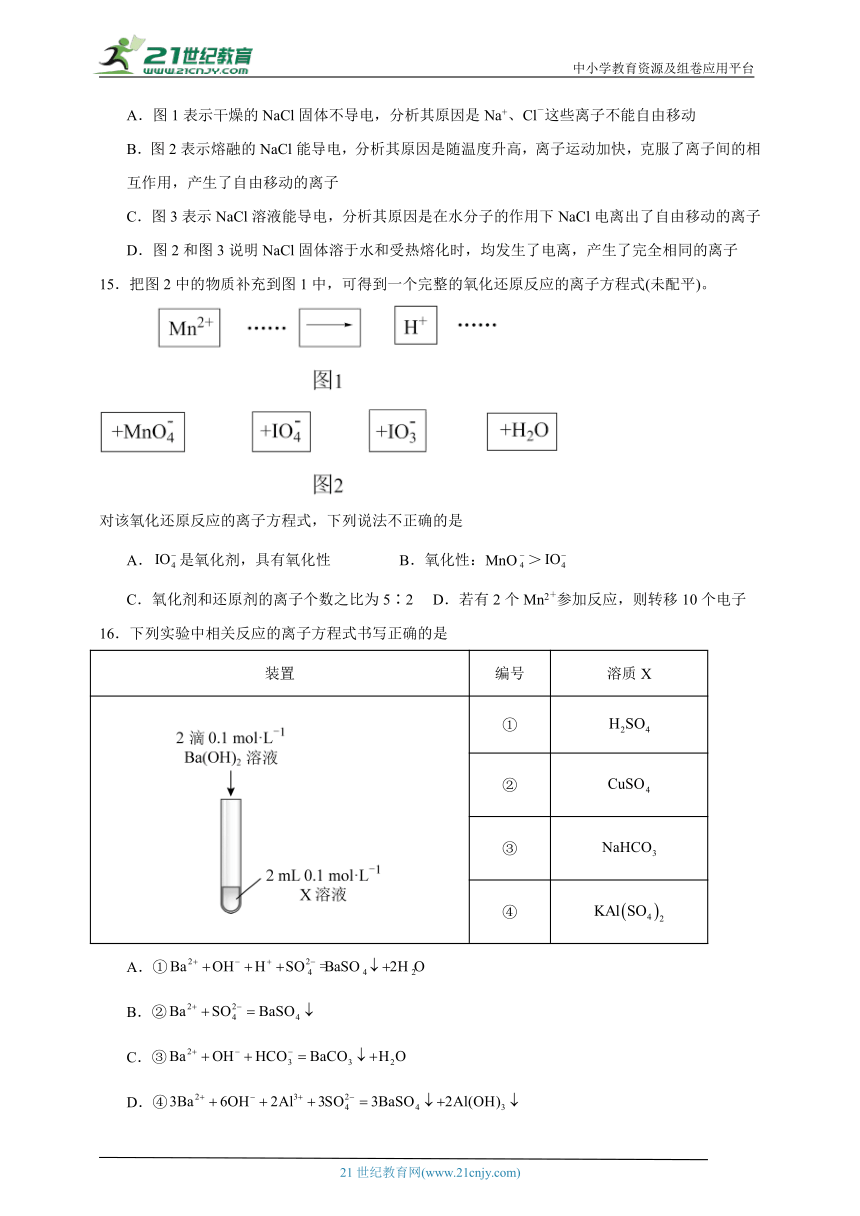
A.图1表示干燥的NaCl固体不导电,分析其原因是Na+、Cl-这些离子不能自由移动
B.图2表示熔融的NaCl能导电,分析其原因是随温度升高,离子运动加快,克服了离子间的相互作用,产生了自由移动的离子
C.图3表示NaCl溶液能导电,分析其原因是在水分子的作用下NaCl电离出了自由移动的离子
D.图2和图3说明NaCl固体溶于水和受热熔化时,均发生了电离,产生了完全相同的离子
15.把图2中的物质补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)。
对该氧化还原反应的离子方程式,下列说法不正确的是
A.是氧化剂,具有氧化性 B.氧化性:MnO>
C.氧化剂和还原剂的离子个数之比为5∶2 D.若有2个Mn2+参加反应,则转移10个电子
16.下列实验中相关反应的离子方程式书写正确的是
装置 编号 溶质X
①
②
③
④
A.①
B.②
C.③
D.④
17.制取漂白液时温度过高会发生副反应:,该反应中氧化剂与还原剂的物质的量之比为
A. B. C. D.
18.某透明溶液中可能含有、、、、、、、、、中的几种离子(浓度均为)。常温下,对其进行如下实验操作:
下列说法错误的是
A.实验过程中有氧化还原反应发生
B.无法判断原溶液中是否含有
C.原溶液中一定不含、、、、、
D.原溶液中一定含有、、、
19.常温下,在溶液中可发生以下反应:①2KBr+Cl2=2KCl+Br2;②2KI+Cl2=2KCl+I2;③2KI+Br2=2KBr+I2由此判断下列说法正确的是
A.溴元素在①和③中均被氧化
B.氧化性强弱顺序为:I2>Br2>Cl2
C.还原性强弱顺序为:KI>KBr>KCl
D.常温下也能进行如下反应:2KCl+Br2=2KBr+Cl2
20.已知氧化性强弱:。下列反应不可能发生的是
A.
B.
C.
D.
参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 C B D D B C C D B C
题号 11 12 13 14 15 16 17 18 19 20
答案 D D B D B D D B C B
1.C
【详解】KAl(SO4)2 12H2O是结晶水合物,属于纯净物;是由金属阳离子K+、Al3+和酸根阴离子组成的复盐;答案选C。
2.B
【分析】化合价升降为氧化还原反应的特征,则若反应中存在元素化台价变化的反应为氧化还原反应,以此进行判断。
【详解】A.炸药爆炸中涉及的反应中有元素化合价的变化,反应属于氧化还原反应,A错误;
B.吹尽狂沙始到金,是根据物质的密度大小分离混合物,为物理变化,不涉及氧化还原反应,B正确;
C.野火烧不尽,存在物质燃烧反应,燃烧反应有元素化合价的变化,反应一定属于氧化还原反应,C错误;
D.蜡烛主要成分是石蜡,蜡炬成灰泪始干,存在石蜡的燃烧现象,燃烧反应属于氧化还原反应,D错误;
故合理选项是B。
3.D
【详解】A.硫酸钠与氢氧化钡反应生成硫酸钡沉淀和氢氧化钠,碳酸钠和稀硫酸反应生成硫酸钠,氢氧化钠和二氧化碳反应生成碳酸钠和水,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,A正确;
B.氧化铜和氢气反应生成铜和水,氧气和铜反应生成氧化铜,电解水可以生成氢气和氧气,氧气和氢气反应生成水,B正确;
C.氯化亚铁和锌反应生成铁,硫酸亚铁和氯化钡反应生成氯化亚铁,铁和稀硫酸反应生成硫酸亚铁,硫酸亚铁和锌反应生成铁,C正确;
D.碳酸钠和稀盐酸反应生成氯化钠,硝酸钠无法生成碳酸钠,D错误;
故选D。
4.D
【详解】A.通入品红溶液中,溶液由红色变为无色,说明具有漂白性,元素化合价没有发生变化,与氧化还原反应无关,A不符合题意;
B.KI溶液滴入AgCl浊液中,沉淀由白色变为黄色,说明AgCl沉淀转化为更加难溶的AgI沉淀,元素化合价没有发生变化,与氧化还原反应无关,B不符合题意;
C.稀硫酸滴入溶液中,溶液由黄色变为橙色,说明平衡正向移动,元素化合价没有发生变化,与氧化还原反应无关,C不符合题意;
D.苯酚长时间放置在空气中,晶体由无色变为粉红色,这是苯酚被空气中的氧气氧化所致,元素化合价发生了变化,与氧化还原反应有关,D符合题意;
故选D。
5.B
【详解】A.向碳酸钠溶液中逐滴加入稀盐酸,应该先生成碳酸氢钠,再生成水和二氧化碳,,离子方程式为:CO+H+= HCO,H++ HCO= CO2↑+H2O,故A错误;
B.氧化铁粉末溶于稀盐酸反应产生氯化铁和水,反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O,故B正确;
C.硫酸滴加到氢氧化钡溶液中,发生反应产生硫酸钡沉淀和水,反应的离子方程式是:2H++SO42-+ Ba2++2OH-= BaSO4↓+2H2O,故C错误;
D.钠与水反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,故D错误。
答案选B。
6.C
【分析】
化合反应是两种或两种以上的物质生成另一种物质的反应,反应前后有元素化合价发生变化的反应是氧化还原反应,据此解答。
【详解】A. 生石灰与水反应:,属于化合反应,没有元素化合价发生变化,不是氧化还原反应,A不符合;
B. 氯气通入溴化钠溶液中:,属于氧化还原反应,不是化合反应,B不符合;
C. 铁和氯气反应:,Fe元素由0价升高到+3价,Cl元素由0价降低到-1价,既属于化合反应,又属于氧化还原反应,C符合;
D. 氯化钠溶液和浓硫酸混合加热:,既不是氧化还原反应,也不是化合反应,D不符合;
答案选C。
7.C
【详解】A.依题意,CO和H2在催化剂的催化作用下发生反应生成了CH3CH2OH,方程式为,A正确;
B.Fe比Cu活泼,能与稀硫酸反应生成可溶性FeSO4,过滤分离可得到Cu,B正确;
C.分散质粒子直径在1 100 nm之间的分散系称为胶体,特征是具有丁达尔效应,碳纳米管不具有胶体的特征,不属于胶体,C错误;
D.C、H、O三种元素中H的非金属最弱,C和O在同一周期,从左至右,非金属依次增强,故O的非金属最强,D正确;
故答案选C。
8.D
【详解】A.铜是单质,既不是电解质也不是非电解质,A项错误;
B.固体中含Na+、Cl-,但要溶于水或熔融态离子才可以自由移动,才能导电,B项错误;
C.在溶于水或熔融态发生电离,C项错误;
D.电解质指在水或熔融态能导电的化合物,是电解质,D项正确;
答案选D。
9.B
【详解】A.Na2CO3写成Na+和CO离子形式,NaHCO3写成Na+和HCO离子, 分别与盐酸反应的离子反应不同,故A错误;
B.两个反应实质均为氢离子与碳酸根离子反应,离子反应方程式相同,故B正确;
C.CH3COOH、NH3·H2O属于弱酸、弱碱,应保留化学式,HCl、KOH写成离子形式,因此二者反应的离子反应不同,故C错误;
D.BaCl2和CuSO4反应生成硫酸钡沉淀和氯化铜,Ba(OH)2和NaHSO4反应生成硫酸钡沉淀、硫酸钠和水,水在离子反应中保留化学式,则离子反应不同,故D错误;
答案选B。
10.C
【详解】A.无色溶液,说明溶液中不存在有颜色的离子,而K+、Na+、、离子中呈紫色,故A不符合题意;
B.无色透明强酸性溶液,说明溶液中存在大量的H+,而Na+、OH-、Cl-、离子中的OH-、能与H+反应,即OH-+H+=H2O,+2H+=CO2↑+H2O,不能大量共存,故B不符合题意;
C.在Zn2+、Al3+、Cl-、离子中各离子之间不发生反应,无色且在强酸性溶液中能大量共存,故C符合题意;
D.在Na+、Fe2+、、Ba2+离子中与Ba2+发生反应生成BaSO4沉淀,即Ba2++=BaSO4↓,不能大量共存,且Fe2+呈现浅绿色,故D不符合题意;
答案为C。
11.D
【详解】A.除去NaCl溶液中的Mg2+,应该用NaOH,不能用KOH,故A错误;
B.加入BaCl2溶液除去的离子方程式是Ba2++=BaSO4↓,故B错误;
C.加入Na2CO3溶液的目的是除去Ca2+、Ba2+,故C错误;
D.加入盐酸的目的是除去过量的NaOH、Na2CO3,反应的离子方程式是H++OH-=H2O、2H++=CO2↑+H2O,故D正确;
选D。
12.D
【分析】在反应中, 中氮元素从-3价升高至0价,化合价从+3价降至0价,则既是氧化剂也是还原剂,N2既是氧化产物也是还原产物,据此回答;
【详解】A.由分析知,中氮元素从-3价升高至0价,化合价从+3价降至0价,则既是氧化剂也是还原剂,故A项正确;
B.分解反应是一种物质反应生成两种或两种以上的物质,故B项正确;
C.在反应中, 中氮元素从-3价升高至0价,化合价从+3价降至0价,其余元素化合价均未改变,故C项正确;
D.N2既是氧化产物也是还原产物,其中有1个氮原子为氧化产物,1个氮原子为还原产物,故质量比为1:1,故D项错误;
故本题选D。
13.B
【分析】本题没有给出具体的氧化还原反应方程式,不能直接根据化学计量数列比例式计算。但题目给出了氧化剂,还原剂的量,所以只要找到氧化剂和还原剂之间计量关系即可求出还原产物中Cr元素化合价,由此分析。
【详解】还原剂与氧化产物、失电子数之间的关系为:Na2SO3~Na2SO4~失2e-;氧化剂与还原产物(设还原产物中Cr的化合价为x)、得电子数之间的关系为:K2Cr2O7~2~得2(6-x)e-,因为n(Na2SO3)=0.012L×0.1mol/L=0.0012mol,n(K2Cr2O7)=0.02L×0.02mol/L=0.0004mol,根据电子得失守恒列方程式:0.0012mol×2e-=0.0004mol×2(6-x)e-,解得x=3,答案选B。
【点睛】根据氧化还原反应中得失电子守恒建立氧化剂与还原剂之间的计量关系。
14.D
【详解】A.NaCl固体无自由移动的离子,不导电,故A正确;
B.图2没有水分子,其表示熔融的NaCl能导电,原因是随温度升高,离子运动加快,克服了离子间的相互作用,产生了自由移动的钠离子和氯离子,故B正确;
C.氯化钠为电解质,在水分子的作用下可发生电离,产生自由移动的水合离子,故C正确;
D.图2在熔融状态下,存在自由移动的离子Na+和Cl-,图3中离子以水合离子的形成存在,即水合钠离子和水合氯离子,产生了不同的离子,故D错误;
故选D。
15.B
【分析】已知锰离子是反应物,反应后生成高锰酸根离子,则锰离子失电子作还原剂,含有碘元素的离子在反应中作氧化剂,碘元素应该得电子化合价降低,所以是反应物,是生成物,根据元素守恒知,水是反应物,根据氧化还原反应中化合价升降数值相等以及原子守恒知识,可以得出该反应方程式为:2Mn2++5+3H2O=2MnO+5+6H+。
【详解】A.中的碘元素在反应中化合价降低,得电子,作氧化剂,具有氧化性,故A正确;
B.根据反应方程式可知,该反应的氧化剂是,氧化产物是MnO,根据氧化剂的氧化性大于氧化产物的氧化性,则氧化性强弱顺序是:>MnO,故B错误;
C.根据方程式可知:氧化剂碘酸根离子和还原剂锰离子的物质的量之比为5:2,故C正确;
D.根据反应方程式可知,有2个 Mn2+参加反应时,转移电子的物质的量是:2×(7-2)=10个,故D正确;
故答案选B。
16.D
【详解】A.与溶液反应的离子方程式为,A错误;
B.与反应产生两种沉淀,离子方程式为,B错误;
C.少量,离子方程式为,C错误;
D.是少量的,反应生成和沉淀,即参与反应的与的物质的量之比为3∶2,D正确;
故选D。
【点睛】(排除法)A项不符合原子守恒,错误。B项漏写沉淀,错误。少量,C项中不符合“以少定多”规则,错误。
17.D
【详解】在 3Cl2+6NaOH=5NaCl+NaClO3+3H2O 反应中,氯气中氯元素化合价由0价降低为-1价,氯气是氧化剂;氯气中氯元素化合价由0价升高为+5价,氯气是还原剂,根据得失电子守恒可知,该反应的氧化剂与还原剂之比为5∶1;
答案选D。
18.B
【分析】溶液pH=1,说明有H+,则不含有、、;继续滴加足量硝酸钡溶液,生成白色沉淀,说明原溶液中有;向得到的澄清溶液中加入KSCN溶液,溶液变红色,说明原溶液中含有,由于H+与同时有时溶液有强氧化性,故溶液中不含有;浓度均为,根据电荷守恒可以判断出溶液中含有,、都不能含有;综上,原溶液中一定含有的离子是:、、、,一定不含有的离子是、、、、、;
【详解】A.加入足量硝酸钡溶液时,在酸性溶液中,将氧化为Fe3+,发生了氧化还原反应,故A正确;
B.由分析可知,原溶液中不含有,故B错误;
C.由分析可知,原溶液中一定不含、、、、、,故C正确;
D.由分析可知,原溶液中一定含有、、、,故D正确。
答案选B。
19.C
【详解】A.在反应①中Br元素化合价升高,失去电子,被氧化;在反应③中,Br元素化合价降低,得到电子,被还原,A错误;
B.物质的氧化性:氧化剂>氧化产物。根据反应①可知物质的氧化性:Cl2>Br2;根据反应②可知物质的氧化性:Cl2>I2;根据反应③可知物质的氧化性:Br2>I2,故三种物质的氧化性由强到弱的顺序为:Cl2>Br2>I2,B错误;
C.物质的还原性:还原剂>还原产物。根据反应①可知物质的还原性:KBr>KCl;根据反应②可知物质的还原性:KI>KCl;根据反应③可知物质的还原性:KI>KBr,故三种物质的还原性由强到弱的顺序为:KI>KBr>KCl,C正确;
D.物质的氧化性:氧化剂>氧化产物。若反应2KCl+Br2=2KBr+Cl2能够发生,则可得氧化性:Br2>Cl2,这与物质的氧化性:Cl2>Br2相违背,说明该反应不能发生,D错误;
故合理选项是C。
20.B
【详解】A.由氧化性可知,反应可以发生,故不选A项;
B.由题意可知,氧化性,而B项中将Pb2+氧化为PbO2,与反应物的氧化性强于氧化产物的氧化性这一规律不符,反应不能发生,故选B项;
C.由氧化性可知,反应可以发生,故不选C项;
D.由氧化性可知,反应可以发生,故不选D项。
综上所述,本题正确答案为B。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
物质及变化 易错知识点 强化练
2025--2026学年上学期高中化学人教版(2019) 必修第一册
一、单选题
1.按物质组成分类,属于
A.酸 B.碱 C.盐 D.混合物
2.下列诗词中不涉及氧化还原反应的是
A.爆竹声中一岁除 B.吹尽狂沙始到金
C.野火烧不尽 D.蜡炬成灰泪始干
3.物质的转化是化学学习的重要内容,甲、乙、丙所代表的物质不符合如图所示转化关系的是
A. NaOH B.CuO
C. Fe D. NaCl
4.下列实验中的颜色变化与氧化还原反应有关的是
A.通入品红溶液中,溶液由红色变为无色
B.KI溶液滴入AgCl浊液中,沉淀由白色变为黄色
C.稀硫酸滴入溶液中,溶液由黄色变为橙色
D.苯酚长时间放置在空气中,晶体由无色变为粉红色
5.下列离子方程式中正确的是
A.向碳酸钠溶液中逐滴加入稀盐酸:CO+2H+=CO2↑+H2O
B.氧化铁粉末溶于稀盐酸:Fe2O3+6H+=2Fe3++3H2O
C.硫酸滴加到氢氧化钡溶液中:H++OH-=H2O
D.钠与水反应:Na+H2O=Na++OH-+H2↑
6.下列反应中,既是化合反应,又是氧化还原反应的是
A.生石灰与水反应:
B.氯气通入溴化钠溶液:
C.铁和氯气反应:2Fe+3Cl22FeCl3
D.氯化钠溶液和浓硫酸混合加热:2NaCl+H2SO4(浓)Na2SO4+2HCl↑
7.最近,厦门大学王野教授课题组利用碳纳米管负载成功实现了从一氧化碳到乙醇()的转化,在此基础上,课题组又利用一种复合催化剂,成功实现了将一氧化碳和氢气转化为乙醇。下列说法不正确的是
A.一氧化碳和氢气转化为乙醇可表示为
B.除去Fe、Cu混合物中的Fe,可采用加足量稀硫酸再过滤的方法
C.碳纳米管是一种胶体材料
D.所涉及的C、H、O元素中非金属性最强的是O元素
8.依据下列实验事实证据,所得结论正确的是
铜丝能导电 固体不导电
A.铜是电解质 B.固体中不含离子
溶液能导电 熔融能导电
C.在通电条件下发生电离 D.是电解质
A.A B.B C.C D.D
9.下列各组反应,前后均可用同一离子方程式表示的是
A.HNO3+Na2CO3,HCl+NaHCO3
B.HNO3+Na2CO3,NaHSO4+K2CO3
C.HCl+NH3·H2O, CH3COOH+KOH
D.BaCl2+CuSO4,Ba(OH)2+NaHSO4
10.在无色透明强酸性溶液中,能大量共存的离子组是
A.K+、Na+、、 B.Na+、OH-、Cl-、
C.Zn2+、Al3+、Cl-、 D.Na+、Fe2+、、Ba2+
11.粗食盐水中常含有少量Ca2+、Mg2+、杂质离子,实验室提纯粗食盐水制取食盐的流程如下,关于实验过程中所选用的试剂、目的及所发生反应的离子方程式均正确的是
选项 试剂 目的 离子方程式
A KOH溶液 仅除去Mg2+ Mg2++2OH-=Mg(OH)2↓
B BaCl2溶液 仅除去 Ba2++Na2SO4=BaSO4↓+2Na+
C Na2CO3溶液 仅除去Ca2+ Ca2++=CaCO3↓
D 盐酸 除去OH-和 H++OH-=H2O 2H++=CO2↑+H2O
A.A B.B C.C D.D
12.关于反应:的叙述不正确的是
A.既是氧化剂又是还原剂
B.发生了分解反应
C.只有氮元素价态变化了
D.氧化产物和还原产物质量比为9∶7
13.12 mL 0.1 mol·L-1的Na2SO3溶液恰好与20 mL 0.02 mol·L-1的K2Cr2O7(重铬酸钾)溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则Cr在还原产物中的化合价为( )
A.+2 B.+3 C.+4 D.+5
14.下列说法错误的是
A.图1表示干燥的NaCl固体不导电,分析其原因是Na+、Cl-这些离子不能自由移动
B.图2表示熔融的NaCl能导电,分析其原因是随温度升高,离子运动加快,克服了离子间的相互作用,产生了自由移动的离子
C.图3表示NaCl溶液能导电,分析其原因是在水分子的作用下NaCl电离出了自由移动的离子
D.图2和图3说明NaCl固体溶于水和受热熔化时,均发生了电离,产生了完全相同的离子
15.把图2中的物质补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)。
对该氧化还原反应的离子方程式,下列说法不正确的是
A.是氧化剂,具有氧化性 B.氧化性:MnO>
C.氧化剂和还原剂的离子个数之比为5∶2 D.若有2个Mn2+参加反应,则转移10个电子
16.下列实验中相关反应的离子方程式书写正确的是
装置 编号 溶质X
①
②
③
④
A.①
B.②
C.③
D.④
17.制取漂白液时温度过高会发生副反应:,该反应中氧化剂与还原剂的物质的量之比为
A. B. C. D.
18.某透明溶液中可能含有、、、、、、、、、中的几种离子(浓度均为)。常温下,对其进行如下实验操作:
下列说法错误的是
A.实验过程中有氧化还原反应发生
B.无法判断原溶液中是否含有
C.原溶液中一定不含、、、、、
D.原溶液中一定含有、、、
19.常温下,在溶液中可发生以下反应:①2KBr+Cl2=2KCl+Br2;②2KI+Cl2=2KCl+I2;③2KI+Br2=2KBr+I2由此判断下列说法正确的是
A.溴元素在①和③中均被氧化
B.氧化性强弱顺序为:I2>Br2>Cl2
C.还原性强弱顺序为:KI>KBr>KCl
D.常温下也能进行如下反应:2KCl+Br2=2KBr+Cl2
20.已知氧化性强弱:。下列反应不可能发生的是
A.
B.
C.
D.
参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 C B D D B C C D B C
题号 11 12 13 14 15 16 17 18 19 20
答案 D D B D B D D B C B
1.C
【详解】KAl(SO4)2 12H2O是结晶水合物,属于纯净物;是由金属阳离子K+、Al3+和酸根阴离子组成的复盐;答案选C。
2.B
【分析】化合价升降为氧化还原反应的特征,则若反应中存在元素化台价变化的反应为氧化还原反应,以此进行判断。
【详解】A.炸药爆炸中涉及的反应中有元素化合价的变化,反应属于氧化还原反应,A错误;
B.吹尽狂沙始到金,是根据物质的密度大小分离混合物,为物理变化,不涉及氧化还原反应,B正确;
C.野火烧不尽,存在物质燃烧反应,燃烧反应有元素化合价的变化,反应一定属于氧化还原反应,C错误;
D.蜡烛主要成分是石蜡,蜡炬成灰泪始干,存在石蜡的燃烧现象,燃烧反应属于氧化还原反应,D错误;
故合理选项是B。
3.D
【详解】A.硫酸钠与氢氧化钡反应生成硫酸钡沉淀和氢氧化钠,碳酸钠和稀硫酸反应生成硫酸钠,氢氧化钠和二氧化碳反应生成碳酸钠和水,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,A正确;
B.氧化铜和氢气反应生成铜和水,氧气和铜反应生成氧化铜,电解水可以生成氢气和氧气,氧气和氢气反应生成水,B正确;
C.氯化亚铁和锌反应生成铁,硫酸亚铁和氯化钡反应生成氯化亚铁,铁和稀硫酸反应生成硫酸亚铁,硫酸亚铁和锌反应生成铁,C正确;
D.碳酸钠和稀盐酸反应生成氯化钠,硝酸钠无法生成碳酸钠,D错误;
故选D。
4.D
【详解】A.通入品红溶液中,溶液由红色变为无色,说明具有漂白性,元素化合价没有发生变化,与氧化还原反应无关,A不符合题意;
B.KI溶液滴入AgCl浊液中,沉淀由白色变为黄色,说明AgCl沉淀转化为更加难溶的AgI沉淀,元素化合价没有发生变化,与氧化还原反应无关,B不符合题意;
C.稀硫酸滴入溶液中,溶液由黄色变为橙色,说明平衡正向移动,元素化合价没有发生变化,与氧化还原反应无关,C不符合题意;
D.苯酚长时间放置在空气中,晶体由无色变为粉红色,这是苯酚被空气中的氧气氧化所致,元素化合价发生了变化,与氧化还原反应有关,D符合题意;
故选D。
5.B
【详解】A.向碳酸钠溶液中逐滴加入稀盐酸,应该先生成碳酸氢钠,再生成水和二氧化碳,,离子方程式为:CO+H+= HCO,H++ HCO= CO2↑+H2O,故A错误;
B.氧化铁粉末溶于稀盐酸反应产生氯化铁和水,反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O,故B正确;
C.硫酸滴加到氢氧化钡溶液中,发生反应产生硫酸钡沉淀和水,反应的离子方程式是:2H++SO42-+ Ba2++2OH-= BaSO4↓+2H2O,故C错误;
D.钠与水反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,故D错误。
答案选B。
6.C
【分析】
化合反应是两种或两种以上的物质生成另一种物质的反应,反应前后有元素化合价发生变化的反应是氧化还原反应,据此解答。
【详解】A. 生石灰与水反应:,属于化合反应,没有元素化合价发生变化,不是氧化还原反应,A不符合;
B. 氯气通入溴化钠溶液中:,属于氧化还原反应,不是化合反应,B不符合;
C. 铁和氯气反应:,Fe元素由0价升高到+3价,Cl元素由0价降低到-1价,既属于化合反应,又属于氧化还原反应,C符合;
D. 氯化钠溶液和浓硫酸混合加热:,既不是氧化还原反应,也不是化合反应,D不符合;
答案选C。
7.C
【详解】A.依题意,CO和H2在催化剂的催化作用下发生反应生成了CH3CH2OH,方程式为,A正确;
B.Fe比Cu活泼,能与稀硫酸反应生成可溶性FeSO4,过滤分离可得到Cu,B正确;
C.分散质粒子直径在1 100 nm之间的分散系称为胶体,特征是具有丁达尔效应,碳纳米管不具有胶体的特征,不属于胶体,C错误;
D.C、H、O三种元素中H的非金属最弱,C和O在同一周期,从左至右,非金属依次增强,故O的非金属最强,D正确;
故答案选C。
8.D
【详解】A.铜是单质,既不是电解质也不是非电解质,A项错误;
B.固体中含Na+、Cl-,但要溶于水或熔融态离子才可以自由移动,才能导电,B项错误;
C.在溶于水或熔融态发生电离,C项错误;
D.电解质指在水或熔融态能导电的化合物,是电解质,D项正确;
答案选D。
9.B
【详解】A.Na2CO3写成Na+和CO离子形式,NaHCO3写成Na+和HCO离子, 分别与盐酸反应的离子反应不同,故A错误;
B.两个反应实质均为氢离子与碳酸根离子反应,离子反应方程式相同,故B正确;
C.CH3COOH、NH3·H2O属于弱酸、弱碱,应保留化学式,HCl、KOH写成离子形式,因此二者反应的离子反应不同,故C错误;
D.BaCl2和CuSO4反应生成硫酸钡沉淀和氯化铜,Ba(OH)2和NaHSO4反应生成硫酸钡沉淀、硫酸钠和水,水在离子反应中保留化学式,则离子反应不同,故D错误;
答案选B。
10.C
【详解】A.无色溶液,说明溶液中不存在有颜色的离子,而K+、Na+、、离子中呈紫色,故A不符合题意;
B.无色透明强酸性溶液,说明溶液中存在大量的H+,而Na+、OH-、Cl-、离子中的OH-、能与H+反应,即OH-+H+=H2O,+2H+=CO2↑+H2O,不能大量共存,故B不符合题意;
C.在Zn2+、Al3+、Cl-、离子中各离子之间不发生反应,无色且在强酸性溶液中能大量共存,故C符合题意;
D.在Na+、Fe2+、、Ba2+离子中与Ba2+发生反应生成BaSO4沉淀,即Ba2++=BaSO4↓,不能大量共存,且Fe2+呈现浅绿色,故D不符合题意;
答案为C。
11.D
【详解】A.除去NaCl溶液中的Mg2+,应该用NaOH,不能用KOH,故A错误;
B.加入BaCl2溶液除去的离子方程式是Ba2++=BaSO4↓,故B错误;
C.加入Na2CO3溶液的目的是除去Ca2+、Ba2+,故C错误;
D.加入盐酸的目的是除去过量的NaOH、Na2CO3,反应的离子方程式是H++OH-=H2O、2H++=CO2↑+H2O,故D正确;
选D。
12.D
【分析】在反应中, 中氮元素从-3价升高至0价,化合价从+3价降至0价,则既是氧化剂也是还原剂,N2既是氧化产物也是还原产物,据此回答;
【详解】A.由分析知,中氮元素从-3价升高至0价,化合价从+3价降至0价,则既是氧化剂也是还原剂,故A项正确;
B.分解反应是一种物质反应生成两种或两种以上的物质,故B项正确;
C.在反应中, 中氮元素从-3价升高至0价,化合价从+3价降至0价,其余元素化合价均未改变,故C项正确;
D.N2既是氧化产物也是还原产物,其中有1个氮原子为氧化产物,1个氮原子为还原产物,故质量比为1:1,故D项错误;
故本题选D。
13.B
【分析】本题没有给出具体的氧化还原反应方程式,不能直接根据化学计量数列比例式计算。但题目给出了氧化剂,还原剂的量,所以只要找到氧化剂和还原剂之间计量关系即可求出还原产物中Cr元素化合价,由此分析。
【详解】还原剂与氧化产物、失电子数之间的关系为:Na2SO3~Na2SO4~失2e-;氧化剂与还原产物(设还原产物中Cr的化合价为x)、得电子数之间的关系为:K2Cr2O7~2~得2(6-x)e-,因为n(Na2SO3)=0.012L×0.1mol/L=0.0012mol,n(K2Cr2O7)=0.02L×0.02mol/L=0.0004mol,根据电子得失守恒列方程式:0.0012mol×2e-=0.0004mol×2(6-x)e-,解得x=3,答案选B。
【点睛】根据氧化还原反应中得失电子守恒建立氧化剂与还原剂之间的计量关系。
14.D
【详解】A.NaCl固体无自由移动的离子,不导电,故A正确;
B.图2没有水分子,其表示熔融的NaCl能导电,原因是随温度升高,离子运动加快,克服了离子间的相互作用,产生了自由移动的钠离子和氯离子,故B正确;
C.氯化钠为电解质,在水分子的作用下可发生电离,产生自由移动的水合离子,故C正确;
D.图2在熔融状态下,存在自由移动的离子Na+和Cl-,图3中离子以水合离子的形成存在,即水合钠离子和水合氯离子,产生了不同的离子,故D错误;
故选D。
15.B
【分析】已知锰离子是反应物,反应后生成高锰酸根离子,则锰离子失电子作还原剂,含有碘元素的离子在反应中作氧化剂,碘元素应该得电子化合价降低,所以是反应物,是生成物,根据元素守恒知,水是反应物,根据氧化还原反应中化合价升降数值相等以及原子守恒知识,可以得出该反应方程式为:2Mn2++5+3H2O=2MnO+5+6H+。
【详解】A.中的碘元素在反应中化合价降低,得电子,作氧化剂,具有氧化性,故A正确;
B.根据反应方程式可知,该反应的氧化剂是,氧化产物是MnO,根据氧化剂的氧化性大于氧化产物的氧化性,则氧化性强弱顺序是:>MnO,故B错误;
C.根据方程式可知:氧化剂碘酸根离子和还原剂锰离子的物质的量之比为5:2,故C正确;
D.根据反应方程式可知,有2个 Mn2+参加反应时,转移电子的物质的量是:2×(7-2)=10个,故D正确;
故答案选B。
16.D
【详解】A.与溶液反应的离子方程式为,A错误;
B.与反应产生两种沉淀,离子方程式为,B错误;
C.少量,离子方程式为,C错误;
D.是少量的,反应生成和沉淀,即参与反应的与的物质的量之比为3∶2,D正确;
故选D。
【点睛】(排除法)A项不符合原子守恒,错误。B项漏写沉淀,错误。少量,C项中不符合“以少定多”规则,错误。
17.D
【详解】在 3Cl2+6NaOH=5NaCl+NaClO3+3H2O 反应中,氯气中氯元素化合价由0价降低为-1价,氯气是氧化剂;氯气中氯元素化合价由0价升高为+5价,氯气是还原剂,根据得失电子守恒可知,该反应的氧化剂与还原剂之比为5∶1;
答案选D。
18.B
【分析】溶液pH=1,说明有H+,则不含有、、;继续滴加足量硝酸钡溶液,生成白色沉淀,说明原溶液中有;向得到的澄清溶液中加入KSCN溶液,溶液变红色,说明原溶液中含有,由于H+与同时有时溶液有强氧化性,故溶液中不含有;浓度均为,根据电荷守恒可以判断出溶液中含有,、都不能含有;综上,原溶液中一定含有的离子是:、、、,一定不含有的离子是、、、、、;
【详解】A.加入足量硝酸钡溶液时,在酸性溶液中,将氧化为Fe3+,发生了氧化还原反应,故A正确;
B.由分析可知,原溶液中不含有,故B错误;
C.由分析可知,原溶液中一定不含、、、、、,故C正确;
D.由分析可知,原溶液中一定含有、、、,故D正确。
答案选B。
19.C
【详解】A.在反应①中Br元素化合价升高,失去电子,被氧化;在反应③中,Br元素化合价降低,得到电子,被还原,A错误;
B.物质的氧化性:氧化剂>氧化产物。根据反应①可知物质的氧化性:Cl2>Br2;根据反应②可知物质的氧化性:Cl2>I2;根据反应③可知物质的氧化性:Br2>I2,故三种物质的氧化性由强到弱的顺序为:Cl2>Br2>I2,B错误;
C.物质的还原性:还原剂>还原产物。根据反应①可知物质的还原性:KBr>KCl;根据反应②可知物质的还原性:KI>KCl;根据反应③可知物质的还原性:KI>KBr,故三种物质的还原性由强到弱的顺序为:KI>KBr>KCl,C正确;
D.物质的氧化性:氧化剂>氧化产物。若反应2KCl+Br2=2KBr+Cl2能够发生,则可得氧化性:Br2>Cl2,这与物质的氧化性:Cl2>Br2相违背,说明该反应不能发生,D错误;
故合理选项是C。
20.B
【详解】A.由氧化性可知,反应可以发生,故不选A项;
B.由题意可知,氧化性,而B项中将Pb2+氧化为PbO2,与反应物的氧化性强于氧化产物的氧化性这一规律不符,反应不能发生,故选B项;
C.由氧化性可知,反应可以发生,故不选C项;
D.由氧化性可知,反应可以发生,故不选D项。
综上所述,本题正确答案为B。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
