专题十一 第五讲 主族金属——锡及其化合物(含解析)2026届高中化学大一轮复习讲义
文档属性
| 名称 | 专题十一 第五讲 主族金属——锡及其化合物(含解析)2026届高中化学大一轮复习讲义 |  | |
| 格式 | doc | ||
| 文件大小 | 994.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-28 22:03:48 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
锡及其化合物
【核心知识梳理】
1.铅(Pb)的原子结构——50Pb
电子排布式 1s22s22p63s23p63d104s24p64d105s25p2
简化电子排布式 [Kr]4d105s25p2
原子结构示意图
价层电子排布图(轨道表示式)
价层电子排布式 5s25p2
周期表中的位置 第六周期第ⅣA族
2.锡(Sn):锡和铝化学性质相似,既能与酸反应,又能与碱反应
(1)与稀盐酸缓慢作用,与浓盐酸在加热条件下反应加快:Sn+2HCl(浓)SnCl2+H2↑
(2)与氢氧化钠反应生成亚锡酸钠和氢气:Sn+2NaOH===Na2SnO2+H2↑
3.氢氧化锡[Sn(OH)2]:氢氧化锡是两性氢氧化物
(1)与酸反应:Sn(OH)2+2HCl===SnCl2+2H2O
(2)与碱反应:Sn(OH)2+2NaOH===Na2SnO2+2H2O
4.Sn2+与Sn4+:Sn2+与Sn4+均易水解
(1)Sn2+水解:SnCl2+H2OSn(OH)Cl(白色)+HCl;故配制SnCl2溶液要使用盐酸,抑制Sn2+水解
(2)Sn2+在空气中被氧气氧化:2Sn2++O2+4H+===2Sn4++2H2O,要加入单质Sn,防止Sn2+被氧化
(4)Sn4+水解:SnCl4+4H2OSn(OH)4↓+4HCl;故配制SnCl4溶液要使用盐酸,抑制Sn4+水解
【巩固练习】
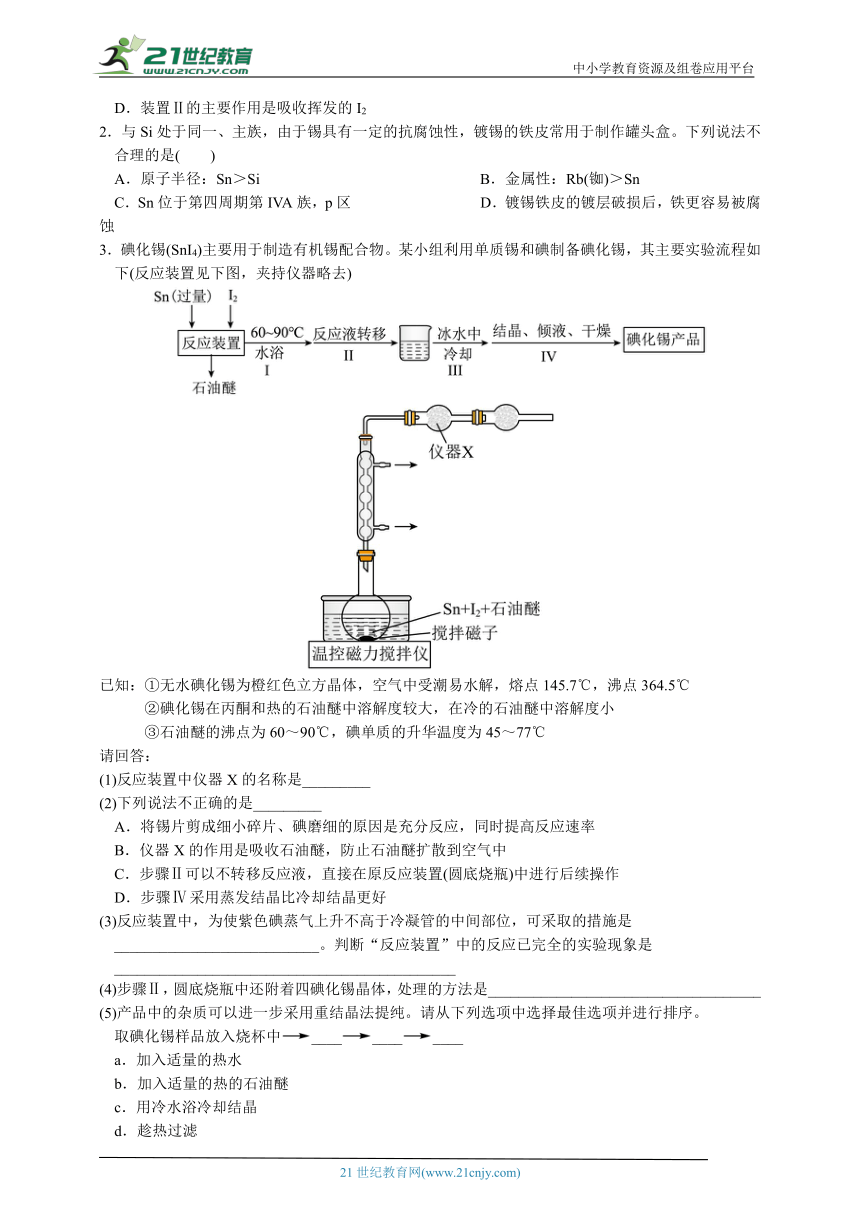
1.锡为ⅣA族元素,四碘化锡是常用的有机合成试剂(SnI4,熔点114.5℃,沸点364.5℃,易水解)。实验室以过量锡箔为原料通过反应Sn+2I2SnI4制备SnI4,装置如图(夹持、加热装置略去)。下列说法正确的是( )
A.SnI4不溶于CCl4
B.装置Ⅰ中b为冷凝水进水口
C.加入碎瓷片的目的是防止暴沸
D.装置Ⅱ的主要作用是吸收挥发的I2
2.与Si处于同一、主族,由于锡具有一定的抗腐蚀性,镀锡的铁皮常用于制作罐头盒。下列说法不合理的是( )
A.原子半径:Sn>Si B.金属性:Rb(铷)>Sn
C.Sn位于第四周期第IVA族,p区 D.镀锡铁皮的镀层破损后,铁更容易被腐蚀
3.碘化锡(SnI4)主要用于制造有机锡配合物。某小组利用单质锡和碘制备碘化锡,其主要实验流程如下(反应装置见下图,夹持仪器略去)
已知:①无水碘化锡为橙红色立方晶体,空气中受潮易水解,熔点145.7℃,沸点364.5℃
②碘化锡在丙酮和热的石油醚中溶解度较大,在冷的石油醚中溶解度小
③石油醚的沸点为60~90℃,碘单质的升华温度为45~77℃
请回答:
(1)反应装置中仪器X的名称是_________
(2)下列说法不正确的是_________
A.将锡片剪成细小碎片、碘磨细的原因是充分反应,同时提高反应速率
B.仪器X的作用是吸收石油醚,防止石油醚扩散到空气中
C.步骤可以不转移反应液,直接在原反应装置(圆底烧瓶)中进行后续操作
D.步骤采用蒸发结晶比冷却结晶更好
(3)反应装置中,为使紫色碘蒸气上升不高于冷凝管的中间部位,可采取的措施是___________________________。判断“反应装置”中的反应已完全的实验现象是_____________________________________________
(4)步骤,圆底烧瓶中还附着四碘化锡晶体,处理的方法是____________________________________
(5)产品中的杂质可以进一步采用重结晶法提纯。请从下列选项中选择最佳选项并进行排序。
取碘化锡样品放入烧杯中____________
a.加入适量的热水
b.加入适量的热的石油醚
c.用冷水浴冷却结晶
d.趁热过滤
e.加入适量的冷的石油醚
(6)该小组对制备的碘化锡产品进行性质和组成上的研究。
①取适量的产品溶解在2 mL丙酮中配成溶液,再加入1 ml蒸馏水,产生白色无定型沉淀,写出反应的化学方程式____________________________________
②本实验可以通过测定某些物理量来确定碘化锡的化学式,需测定的物理量有________________________
4.四氯化锡(SnCl4)是合成有机锡化合物的原料,其熔点为-33℃,沸点为114℃,在潮湿的空气中强烈水解产生有刺激性的白色烟雾,产物之一为SnO2。实验室制备四氯化锡的操作是:将金属锡熔融,然后泼入冷水,制成锡花;将干燥的锡花加入反应器中,再向反应器中缓慢地通入干燥的氯气。(装置C中的试剂Ⅹ未画出)
I.图1为实验室制备干燥氯气的实验装置(夹持装置已略)
(1)该装置制备氯气选用的药品为漂粉精固体[主要成分Ca(ClO2]和浓盐酸,A中发生反应的化学方程式为____________________________________
(2)装置B中的饱和食盐水能够除去Cl2中的HCl,此外还有___________作用
(3)试剂Ⅹ可能为__________
A.无水氯化钙 B.浓硫酸 C.五氧化二磷 D.碱石灰
(4)用锡花代替锡粒的目的是_________________________________
(5)四氯化锡在潮湿空气中水解的化学方程式为_________________________________
Ⅱ.图2是蒸馏SnCl4的装置
(6)该装置尚有两处不当之处,它们分别是____________________、______________________
(7)实验用的锡花中含有金属铜。某同学设计下列实验测定锡花的纯度:
第一步:称取7.500g锡花溶于足量稀硫酸中,充分反应后过滤;
第二步:向滤液中加入过量Fe2(SO4)3,将生成的Sn2+氧化成Sn4+;
第三步:用0.9500mol·L-1的K2Cr2O7溶液滴定生成的Fe2+,发生反应的方程式为
6FeCl2+K2Cr2O7+14HCl===6FeCl3+2KCl+2CrCl3+7H2O
若达到滴定终点时共消耗21.00mLK2Cr2O7溶液,试计算锡花中锡的百分含量:___________(结果保留4位有效数字)
5.硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。研究小组设计SnSO4制备路线如下:
查阅资料:Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化
Ⅱ.SnCl2易水解生成碱式氯化亚锡
回答下列问题:
(1)操作Ⅰ的步骤为____________、____________、过滤、洗涤、干燥。对沉淀进行洗涤的方法是_______________
(2)SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式用平衡移动原理解释原因_____________________
(3)加入Sn粉的作用有两个:①调节溶液pH;②____________________________________
(4)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是_________________________
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):取ag锡粉溶于盐酸中,向生成的SnCl2中加入过量的FeCl3溶液,用bmol·L-1K2Cr2O7滴定生成的Fe2+(已知酸性环境下,Cr2O72—可被还原为Cr3+),共用去K2Cr2O7溶液mmL。则锡粉中锡的质量分数是 (Sn的摩尔质量为Mg·mol-1,用含a、b、m、M的代数式表示)
6.硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下。回答下列问题:
查阅资料:I.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化
Ⅱ.SnC12易水解生成碱式氯化亚锡[Sn(OH)Cl]
(1)操作I是____________
(2)SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式用平衡移动原理解释原因__________________
(3)加入Sn粉的作用有两个:①调节溶液pH;②__________________________
(4)反应I得到沉淀SnO,得到该沉淀的离子反应方程式是________________
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是____________________________
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应)
①试样溶于盐酸中,发生的反应为:Sn+2HCl===SnCl2+H2↑
②加入过量的FeC13
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2+K2Cr2O7+14HCl===6FeCl3+2KCl+2CrCl3+7H2O
取1.226g锡粉,经上述各步反应后共用去0.100 mol·L-1 K2Cr2O7溶液32.0 mL。锡粉中锡的质量分数是________(保留三位有效数字)
7.四氯化锡在工业上常用作媒染剂和有机合成的氯化催化剂,在电镀和电子工业等方面也有应用。熔融的金属锡在300℃左右能与严格干燥过的氯气作用生成无水四氯化锡。实验室制取无水四氯化锡的装置如下图所示。
已知:金属锡的熔点为231℃;四氯化锡的熔点为-33℃,沸点为114.1℃,极易水解。
请回答下列问题:
(1)装置Ⅰ中仪器a的名称是__________,其中发生反应的离子方程式为______________________________
(2)为得到严格干燥的氯气,装置II和装置Ⅲ中试剂相同,均应为____________________
(3)实验时,先点燃装置I的煤气灯,观察到__________,再点燃装置Ⅳ的煤气灯
(4)装置Ⅴ中冷凝管的作用是__________,冷凝水应从_____口通入。
(5)装置VI中球形干燥管内试剂为碱石灰,若缺少该仪器,产生的影响是 。
(6)SnCl4遇水反应生成白色粉末状SnO2 xH2O,并释放出HCl而呈现白色烟雾,该反应的化学方程式为_________,收集少量白色粉末并称量,质量为m g,然后加热至恒重时质量为n g,则x= (用m、n表示)
【锡及其化合物】答案
1.C。解析:A.根据题干中SnI4的熔沸点,从组成分析可知SnI4与CCl4为同族形成的同类物质,依据“相似相溶原理”可知SnI4可溶于CCl4中,故A错误;B.冷凝管的冷凝水为“下进上出”,所以装置Ⅰ中a为泠凝水进水口,故B错误;C.液体加热时,加入碎瓷片目的是防止暴沸,故C正确;D.由题可知:SnI4,易水解,所以装置Ⅱ的主要作用是防止水蒸气进入装置使SnI4水解,故D错误;故选C。
2.C。解析:A.锡(50Sn)与Si处于同一主族,同主族原子半径从上至下逐渐增大,原子半径:Sn>Si,A正确;
B.同周期从左至右金属性逐渐减弱,金属性:Rb(铷)>Sn,B正确;C.Sn的价电子排布式为:5s25p2位于第五周期第IVA族,p区,C错误;D.镀锡铁皮的镀层破损后,形成原电池,铁做负极,铁更容易被腐蚀,D正确;
答案选C。
3.(1)干燥管
(2)CD
(3)调节冷凝管的进水速度 I2蒸气的紫色消失
(4)用1-2mL热的石油醚洗涤内壁,一起转移到小烧杯中
(5)bdc
(6)SnI4+4H2O===Sn(OH)4↓+4HI 加入锡片的总质量,剩余锡片质量,加入碘的质量
解析:(1)由反应装置图,反应装置中仪器X的名称是干燥管;
(2)A.将锡片剪成细小碎片、碘磨细,增大了反应物之间的接触面积,可以使反应物充分反应,同时提高反应速率,A正确;B.装置中冷凝管连接两个干燥器,第一个即图中X的作用是是吸收石油醚,防止石油醚扩散到空气中,第二个是防止由水蒸气进入装置内与产物反应,B正确;C.由于Sn过量,如果不转移反应液,直接在原反应装置(圆底烧瓶)中进行后续操作,会导致产品中有Sn杂质,C错误;D.由于碘化锡在热的石油醚中溶解度较大,步骤Ⅳ采用蒸发结晶可能导致析出的晶体较少,产率低,D错误;故不正确的选CD;
(3)反应装置中,为使紫色碘蒸气上升不高于冷凝管的中间部位,可采取的措施是调节冷凝管的进水速度,通过加快进水速度加强冷却效果,由于Sn过量,碘会被反应完,故判断“反应装置”中的反应已完全的实验现象是I2蒸气的紫色消失;
(4)由于碘化锡在热的石油醚中溶解度较大,故圆底烧瓶中还附着的四碘化锡晶体可以用1-2mL热的石油醚洗涤内壁,一起转移到小烧杯中;
(5)重结晶就是将粗产品重新溶解并结晶,故需要加入适量的热的石油醚溶解,趁热过滤滤去不容杂质,最后用冷水浴冷却结晶,故选择的最佳选项并进行排序为b→d→c;
(6)①由于无水碘化锡受潮易水解,故取适量的产品溶解在2mL丙酮中配成溶液,再加入1ml蒸馏水,发生水解,产生白色无定型沉淀为Sn(OH)4,反应的化学方程式为SnI4+4H2O=Sn(OH)4↓+4HI;
②本实验可以通过测定加入锡片的总质量,剩余锡片质量,加入碘的质量,从而得出参与反应的锡和碘的物质的量之比,确定碘化锡的化学式。
4.(1)Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
(2)安全瓶
(3)AC
(4)增大与氯气的接触面积,加快反应速率
(5)SnCl4+2H2O===SnO2+4HCl
(6)温度计水银球位置不对 Ⅱ和Ⅲ之间缺少干燥装置
(7)94.96%
5.(1)加热浓缩 冷却结晶 将沉淀置于漏斗中,让蒸馏水浸没沉淀,使水自然流下,重复操作2~3次
(2)SnCl2+H2OSn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解
(3)防止Sn2+被氧化
(4)Sn2++H2O2+2H+===Sn4++2H2O
(5)
解析:(1)操作1最终得到SnSO4晶体,而过滤之前是加热浓缩、冷却结晶,沉淀的洗涤方法是将沉淀置于漏斗中,让蒸馏水浸没沉淀,使水自然流下,重复操作2~3次;
(2)SnCl2加盐酸的目的是防止其水解:SnCl2+H2OSn(OH)Cl+HCl;
(3)根据资料Ⅰ的信息可知,酸溶后的溶液含Sn4+,加Sn的目的还有防止Sn2+被氧化或还原Sn4+的作用;
(4)SnSO4有还原性,可还原过氧化氢:Sn2++H2O2+2H+===Sn4++2H2O;
(5)根据3Sn~3SnCl2~6FeCl3~Cr2O
3×M 1
x bm×10-3
x=3Mbm×10-3,
则质量分数为 ×100%=。
6.(1)加热浓缩、冷却结晶、过滤、洗涤
(2)SnCl2+H2OSn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解
(3)防止Sn2+被氧化
(4)Sn2++CO===SnO↓+CO2↑
(5)Sn2++H2O2+H+===Sn4++2H2O
(6)93.2%
7.(1)蒸馏烧瓶 MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
(2)浓硫酸
(3)装置IV中充满黄绿色气体
(4)将四氯化锡蒸气冷凝液化 c
(5)产物四氯化锡与空气中的水蒸气发生水解反应;尾气中的氯气污染空气。
(6)SnCl4+(x+2)H2O===4HCl+SnO2 xH2O
解析:从实验装置图可知,装置Ⅰ为氯气的生成装置根据第二小问可知,装置Ⅱ和Ⅲ中试剂相同,则装置Ⅱ和Ⅲ中都为浓硫酸,用途为干燥氯气,装置Ⅳ中金属锡与Cl2在300°C条件下反应生成SnCl4,生成的SnCl4沸点为114.1℃,会蒸出因此需要用冷凝管冷凝,进水口为c,Ⅵ为SnCl4的收集装置, 球形干燥管中试剂为碱石灰,用途为防止空气中的水蒸气进入Ⅵ,从而防止SnCl4与水反应,也能除去多余的氯气。
(1)图中装置Ⅰ中仪器a的名称是蒸馏烧瓶,MnO2与浓盐酸共热时发生反应生成氯气,反应的离子方程式为
MnO2+4H++2Cl-Mn2++Cl2↑+2H2。
(2)装置Ⅱ和装置Ⅲ的作用是除去氯气中混有的水蒸气,使之严格干燥,其中盛放的试剂均应为浓硫酸;
(3)在装置中添加药品之后,应先点燃装置Ⅰ的煤气灯,发生反应生成氯气,待装置Ⅳ中充满黄绿色气体后点燃该处煤气灯,以避免金属锡与空气中的氧气发生反应;
(4)装置Ⅴ中冷凝管的作用是将四氯化锡蒸气冷凝液化,冷凝水应从c口通入;
(5)装置Ⅵ中球形干燥管内试剂为碱石灰,其作用是除去尾气中的Cl2,防止污染空气;防止四氯化锡与空气中的水蒸气发生水解反应。若缺少该仪器,产物四氯化锡与空气中的水蒸气发生水解反应;尾气中的氯气污染空气;
(6)SnCl4遇水反应生成SnO2 xH2O和HCl,根据质量守恒配平该反应的化学方程式为SnCl4+(x+2)H2O===4HCl+SnO2 xH2O。依据题意列方程式= ,解得x=。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
锡及其化合物
【核心知识梳理】
1.铅(Pb)的原子结构——50Pb
电子排布式 1s22s22p63s23p63d104s24p64d105s25p2
简化电子排布式 [Kr]4d105s25p2
原子结构示意图
价层电子排布图(轨道表示式)
价层电子排布式 5s25p2
周期表中的位置 第六周期第ⅣA族
2.锡(Sn):锡和铝化学性质相似,既能与酸反应,又能与碱反应
(1)与稀盐酸缓慢作用,与浓盐酸在加热条件下反应加快:Sn+2HCl(浓)SnCl2+H2↑
(2)与氢氧化钠反应生成亚锡酸钠和氢气:Sn+2NaOH===Na2SnO2+H2↑
3.氢氧化锡[Sn(OH)2]:氢氧化锡是两性氢氧化物
(1)与酸反应:Sn(OH)2+2HCl===SnCl2+2H2O
(2)与碱反应:Sn(OH)2+2NaOH===Na2SnO2+2H2O
4.Sn2+与Sn4+:Sn2+与Sn4+均易水解
(1)Sn2+水解:SnCl2+H2OSn(OH)Cl(白色)+HCl;故配制SnCl2溶液要使用盐酸,抑制Sn2+水解
(2)Sn2+在空气中被氧气氧化:2Sn2++O2+4H+===2Sn4++2H2O,要加入单质Sn,防止Sn2+被氧化
(4)Sn4+水解:SnCl4+4H2OSn(OH)4↓+4HCl;故配制SnCl4溶液要使用盐酸,抑制Sn4+水解
【巩固练习】
1.锡为ⅣA族元素,四碘化锡是常用的有机合成试剂(SnI4,熔点114.5℃,沸点364.5℃,易水解)。实验室以过量锡箔为原料通过反应Sn+2I2SnI4制备SnI4,装置如图(夹持、加热装置略去)。下列说法正确的是( )
A.SnI4不溶于CCl4
B.装置Ⅰ中b为冷凝水进水口
C.加入碎瓷片的目的是防止暴沸
D.装置Ⅱ的主要作用是吸收挥发的I2
2.与Si处于同一、主族,由于锡具有一定的抗腐蚀性,镀锡的铁皮常用于制作罐头盒。下列说法不合理的是( )
A.原子半径:Sn>Si B.金属性:Rb(铷)>Sn
C.Sn位于第四周期第IVA族,p区 D.镀锡铁皮的镀层破损后,铁更容易被腐蚀
3.碘化锡(SnI4)主要用于制造有机锡配合物。某小组利用单质锡和碘制备碘化锡,其主要实验流程如下(反应装置见下图,夹持仪器略去)
已知:①无水碘化锡为橙红色立方晶体,空气中受潮易水解,熔点145.7℃,沸点364.5℃
②碘化锡在丙酮和热的石油醚中溶解度较大,在冷的石油醚中溶解度小
③石油醚的沸点为60~90℃,碘单质的升华温度为45~77℃
请回答:
(1)反应装置中仪器X的名称是_________
(2)下列说法不正确的是_________
A.将锡片剪成细小碎片、碘磨细的原因是充分反应,同时提高反应速率
B.仪器X的作用是吸收石油醚,防止石油醚扩散到空气中
C.步骤可以不转移反应液,直接在原反应装置(圆底烧瓶)中进行后续操作
D.步骤采用蒸发结晶比冷却结晶更好
(3)反应装置中,为使紫色碘蒸气上升不高于冷凝管的中间部位,可采取的措施是___________________________。判断“反应装置”中的反应已完全的实验现象是_____________________________________________
(4)步骤,圆底烧瓶中还附着四碘化锡晶体,处理的方法是____________________________________
(5)产品中的杂质可以进一步采用重结晶法提纯。请从下列选项中选择最佳选项并进行排序。
取碘化锡样品放入烧杯中____________
a.加入适量的热水
b.加入适量的热的石油醚
c.用冷水浴冷却结晶
d.趁热过滤
e.加入适量的冷的石油醚
(6)该小组对制备的碘化锡产品进行性质和组成上的研究。
①取适量的产品溶解在2 mL丙酮中配成溶液,再加入1 ml蒸馏水,产生白色无定型沉淀,写出反应的化学方程式____________________________________
②本实验可以通过测定某些物理量来确定碘化锡的化学式,需测定的物理量有________________________
4.四氯化锡(SnCl4)是合成有机锡化合物的原料,其熔点为-33℃,沸点为114℃,在潮湿的空气中强烈水解产生有刺激性的白色烟雾,产物之一为SnO2。实验室制备四氯化锡的操作是:将金属锡熔融,然后泼入冷水,制成锡花;将干燥的锡花加入反应器中,再向反应器中缓慢地通入干燥的氯气。(装置C中的试剂Ⅹ未画出)
I.图1为实验室制备干燥氯气的实验装置(夹持装置已略)
(1)该装置制备氯气选用的药品为漂粉精固体[主要成分Ca(ClO2]和浓盐酸,A中发生反应的化学方程式为____________________________________
(2)装置B中的饱和食盐水能够除去Cl2中的HCl,此外还有___________作用
(3)试剂Ⅹ可能为__________
A.无水氯化钙 B.浓硫酸 C.五氧化二磷 D.碱石灰
(4)用锡花代替锡粒的目的是_________________________________
(5)四氯化锡在潮湿空气中水解的化学方程式为_________________________________
Ⅱ.图2是蒸馏SnCl4的装置
(6)该装置尚有两处不当之处,它们分别是____________________、______________________
(7)实验用的锡花中含有金属铜。某同学设计下列实验测定锡花的纯度:
第一步:称取7.500g锡花溶于足量稀硫酸中,充分反应后过滤;
第二步:向滤液中加入过量Fe2(SO4)3,将生成的Sn2+氧化成Sn4+;
第三步:用0.9500mol·L-1的K2Cr2O7溶液滴定生成的Fe2+,发生反应的方程式为
6FeCl2+K2Cr2O7+14HCl===6FeCl3+2KCl+2CrCl3+7H2O
若达到滴定终点时共消耗21.00mLK2Cr2O7溶液,试计算锡花中锡的百分含量:___________(结果保留4位有效数字)
5.硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。研究小组设计SnSO4制备路线如下:
查阅资料:Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化
Ⅱ.SnCl2易水解生成碱式氯化亚锡
回答下列问题:
(1)操作Ⅰ的步骤为____________、____________、过滤、洗涤、干燥。对沉淀进行洗涤的方法是_______________
(2)SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式用平衡移动原理解释原因_____________________
(3)加入Sn粉的作用有两个:①调节溶液pH;②____________________________________
(4)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是_________________________
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):取ag锡粉溶于盐酸中,向生成的SnCl2中加入过量的FeCl3溶液,用bmol·L-1K2Cr2O7滴定生成的Fe2+(已知酸性环境下,Cr2O72—可被还原为Cr3+),共用去K2Cr2O7溶液mmL。则锡粉中锡的质量分数是 (Sn的摩尔质量为Mg·mol-1,用含a、b、m、M的代数式表示)
6.硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下。回答下列问题:
查阅资料:I.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化
Ⅱ.SnC12易水解生成碱式氯化亚锡[Sn(OH)Cl]
(1)操作I是____________
(2)SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式用平衡移动原理解释原因__________________
(3)加入Sn粉的作用有两个:①调节溶液pH;②__________________________
(4)反应I得到沉淀SnO,得到该沉淀的离子反应方程式是________________
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是____________________________
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应)
①试样溶于盐酸中,发生的反应为:Sn+2HCl===SnCl2+H2↑
②加入过量的FeC13
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2+K2Cr2O7+14HCl===6FeCl3+2KCl+2CrCl3+7H2O
取1.226g锡粉,经上述各步反应后共用去0.100 mol·L-1 K2Cr2O7溶液32.0 mL。锡粉中锡的质量分数是________(保留三位有效数字)
7.四氯化锡在工业上常用作媒染剂和有机合成的氯化催化剂,在电镀和电子工业等方面也有应用。熔融的金属锡在300℃左右能与严格干燥过的氯气作用生成无水四氯化锡。实验室制取无水四氯化锡的装置如下图所示。
已知:金属锡的熔点为231℃;四氯化锡的熔点为-33℃,沸点为114.1℃,极易水解。
请回答下列问题:
(1)装置Ⅰ中仪器a的名称是__________,其中发生反应的离子方程式为______________________________
(2)为得到严格干燥的氯气,装置II和装置Ⅲ中试剂相同,均应为____________________
(3)实验时,先点燃装置I的煤气灯,观察到__________,再点燃装置Ⅳ的煤气灯
(4)装置Ⅴ中冷凝管的作用是__________,冷凝水应从_____口通入。
(5)装置VI中球形干燥管内试剂为碱石灰,若缺少该仪器,产生的影响是 。
(6)SnCl4遇水反应生成白色粉末状SnO2 xH2O,并释放出HCl而呈现白色烟雾,该反应的化学方程式为_________,收集少量白色粉末并称量,质量为m g,然后加热至恒重时质量为n g,则x= (用m、n表示)
【锡及其化合物】答案
1.C。解析:A.根据题干中SnI4的熔沸点,从组成分析可知SnI4与CCl4为同族形成的同类物质,依据“相似相溶原理”可知SnI4可溶于CCl4中,故A错误;B.冷凝管的冷凝水为“下进上出”,所以装置Ⅰ中a为泠凝水进水口,故B错误;C.液体加热时,加入碎瓷片目的是防止暴沸,故C正确;D.由题可知:SnI4,易水解,所以装置Ⅱ的主要作用是防止水蒸气进入装置使SnI4水解,故D错误;故选C。
2.C。解析:A.锡(50Sn)与Si处于同一主族,同主族原子半径从上至下逐渐增大,原子半径:Sn>Si,A正确;
B.同周期从左至右金属性逐渐减弱,金属性:Rb(铷)>Sn,B正确;C.Sn的价电子排布式为:5s25p2位于第五周期第IVA族,p区,C错误;D.镀锡铁皮的镀层破损后,形成原电池,铁做负极,铁更容易被腐蚀,D正确;
答案选C。
3.(1)干燥管
(2)CD
(3)调节冷凝管的进水速度 I2蒸气的紫色消失
(4)用1-2mL热的石油醚洗涤内壁,一起转移到小烧杯中
(5)bdc
(6)SnI4+4H2O===Sn(OH)4↓+4HI 加入锡片的总质量,剩余锡片质量,加入碘的质量
解析:(1)由反应装置图,反应装置中仪器X的名称是干燥管;
(2)A.将锡片剪成细小碎片、碘磨细,增大了反应物之间的接触面积,可以使反应物充分反应,同时提高反应速率,A正确;B.装置中冷凝管连接两个干燥器,第一个即图中X的作用是是吸收石油醚,防止石油醚扩散到空气中,第二个是防止由水蒸气进入装置内与产物反应,B正确;C.由于Sn过量,如果不转移反应液,直接在原反应装置(圆底烧瓶)中进行后续操作,会导致产品中有Sn杂质,C错误;D.由于碘化锡在热的石油醚中溶解度较大,步骤Ⅳ采用蒸发结晶可能导致析出的晶体较少,产率低,D错误;故不正确的选CD;
(3)反应装置中,为使紫色碘蒸气上升不高于冷凝管的中间部位,可采取的措施是调节冷凝管的进水速度,通过加快进水速度加强冷却效果,由于Sn过量,碘会被反应完,故判断“反应装置”中的反应已完全的实验现象是I2蒸气的紫色消失;
(4)由于碘化锡在热的石油醚中溶解度较大,故圆底烧瓶中还附着的四碘化锡晶体可以用1-2mL热的石油醚洗涤内壁,一起转移到小烧杯中;
(5)重结晶就是将粗产品重新溶解并结晶,故需要加入适量的热的石油醚溶解,趁热过滤滤去不容杂质,最后用冷水浴冷却结晶,故选择的最佳选项并进行排序为b→d→c;
(6)①由于无水碘化锡受潮易水解,故取适量的产品溶解在2mL丙酮中配成溶液,再加入1ml蒸馏水,发生水解,产生白色无定型沉淀为Sn(OH)4,反应的化学方程式为SnI4+4H2O=Sn(OH)4↓+4HI;
②本实验可以通过测定加入锡片的总质量,剩余锡片质量,加入碘的质量,从而得出参与反应的锡和碘的物质的量之比,确定碘化锡的化学式。
4.(1)Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
(2)安全瓶
(3)AC
(4)增大与氯气的接触面积,加快反应速率
(5)SnCl4+2H2O===SnO2+4HCl
(6)温度计水银球位置不对 Ⅱ和Ⅲ之间缺少干燥装置
(7)94.96%
5.(1)加热浓缩 冷却结晶 将沉淀置于漏斗中,让蒸馏水浸没沉淀,使水自然流下,重复操作2~3次
(2)SnCl2+H2OSn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解
(3)防止Sn2+被氧化
(4)Sn2++H2O2+2H+===Sn4++2H2O
(5)
解析:(1)操作1最终得到SnSO4晶体,而过滤之前是加热浓缩、冷却结晶,沉淀的洗涤方法是将沉淀置于漏斗中,让蒸馏水浸没沉淀,使水自然流下,重复操作2~3次;
(2)SnCl2加盐酸的目的是防止其水解:SnCl2+H2OSn(OH)Cl+HCl;
(3)根据资料Ⅰ的信息可知,酸溶后的溶液含Sn4+,加Sn的目的还有防止Sn2+被氧化或还原Sn4+的作用;
(4)SnSO4有还原性,可还原过氧化氢:Sn2++H2O2+2H+===Sn4++2H2O;
(5)根据3Sn~3SnCl2~6FeCl3~Cr2O
3×M 1
x bm×10-3
x=3Mbm×10-3,
则质量分数为 ×100%=。
6.(1)加热浓缩、冷却结晶、过滤、洗涤
(2)SnCl2+H2OSn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解
(3)防止Sn2+被氧化
(4)Sn2++CO===SnO↓+CO2↑
(5)Sn2++H2O2+H+===Sn4++2H2O
(6)93.2%
7.(1)蒸馏烧瓶 MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
(2)浓硫酸
(3)装置IV中充满黄绿色气体
(4)将四氯化锡蒸气冷凝液化 c
(5)产物四氯化锡与空气中的水蒸气发生水解反应;尾气中的氯气污染空气。
(6)SnCl4+(x+2)H2O===4HCl+SnO2 xH2O
解析:从实验装置图可知,装置Ⅰ为氯气的生成装置根据第二小问可知,装置Ⅱ和Ⅲ中试剂相同,则装置Ⅱ和Ⅲ中都为浓硫酸,用途为干燥氯气,装置Ⅳ中金属锡与Cl2在300°C条件下反应生成SnCl4,生成的SnCl4沸点为114.1℃,会蒸出因此需要用冷凝管冷凝,进水口为c,Ⅵ为SnCl4的收集装置, 球形干燥管中试剂为碱石灰,用途为防止空气中的水蒸气进入Ⅵ,从而防止SnCl4与水反应,也能除去多余的氯气。
(1)图中装置Ⅰ中仪器a的名称是蒸馏烧瓶,MnO2与浓盐酸共热时发生反应生成氯气,反应的离子方程式为
MnO2+4H++2Cl-Mn2++Cl2↑+2H2。
(2)装置Ⅱ和装置Ⅲ的作用是除去氯气中混有的水蒸气,使之严格干燥,其中盛放的试剂均应为浓硫酸;
(3)在装置中添加药品之后,应先点燃装置Ⅰ的煤气灯,发生反应生成氯气,待装置Ⅳ中充满黄绿色气体后点燃该处煤气灯,以避免金属锡与空气中的氧气发生反应;
(4)装置Ⅴ中冷凝管的作用是将四氯化锡蒸气冷凝液化,冷凝水应从c口通入;
(5)装置Ⅵ中球形干燥管内试剂为碱石灰,其作用是除去尾气中的Cl2,防止污染空气;防止四氯化锡与空气中的水蒸气发生水解反应。若缺少该仪器,产物四氯化锡与空气中的水蒸气发生水解反应;尾气中的氯气污染空气;
(6)SnCl4遇水反应生成SnO2 xH2O和HCl,根据质量守恒配平该反应的化学方程式为SnCl4+(x+2)H2O===4HCl+SnO2 xH2O。依据题意列方程式= ,解得x=。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
