专题十一 第七讲 主族金属——镓、铟、铊及其化合物(含解析)2026届高中化学大一轮复习讲义
文档属性
| 名称 | 专题十一 第七讲 主族金属——镓、铟、铊及其化合物(含解析)2026届高中化学大一轮复习讲义 |  | |
| 格式 | doc | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-28 22:04:38 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
镓、铟、铊及其化合物
【核心知识梳理】
1.镓、铟、铊的原子结构
原子符号 31Ga 49In 81Tl
电子排布式 [Ar]3d104s24p1 [Kr]4d105s25p1 [Xe]4f145d106s26p1
原子结构示意图
价层电子排布图(轨道表示式)
价层电子排布式 4s24p1 5s25p1 6s26p1
周期表中的位置 第四周期第ⅢA族 第五周期第ⅢA族 第六周期第ⅢA族
2.镓、铟、铊的单质
(1)物理性质:镓是银白色软金属,熔点为29.7646℃,在人的手掌中就能熔化,而其沸点为2229℃,熔点和沸点之差在所有金属中是最大的。基于这一特点,镓被用来制造测量高温的温度计。铟、铊的物理性质和镓近似
(2)化学性质
①镓、铟和铊3种金属都能与非氧化性酸反应
2Ga+3H2SO4(稀)===Ga2(SO4)3+3H2↑
2In+3H2SO4(稀)===In2(SO4)3+3H2↑
2Tl+3H2SO4(稀)===Tl2(SO4)3+3H2↑
②镓、铟和铊3种金属都能与氧化性酸反应,Ga、In被氧化到+3价,Tl只被氧化到+1价
Ga+6HNO3(浓)===Ga(NO3)3+3NO2↑+3H2O
In+6HNO3(浓)===In(NO3)3+3NO2↑+3H2O
Tl+2HNO3(浓)===InNO3+NO2↑+H2O
③Ga与铝类似,具有两性,金属性弱于铝,既可以与酸反应,也可以与碱反应
2Ga+2NaOH+6H2O===2Na[Ga(OH)4]+3H2↑
④常温下,镓与铟表面存在氧化层,导致其化学性质不活泼
⑤镓、铟和铊与F2反应剧烈,与Cl2、Br2、I2及P,S等反应较慢,有的反应需要加热
3.镓、铟和铊的氧化物和氢氧化物
镓、铟和铊的氢氧化物均不稳定,且按镓、铟、铊的顺序稳定性下降。这些氧化物均易脱水,生成氧化物
(1)Ga(OH)3、In(OH)3微热时脱水,生成氧化物:2M(OH)3M2O3+3H2O (M=Ga或In)
(2)Tl(OH)3不稳定到几乎不能存在,向TlCl3溶液中加入强碱,将直接生成Tl2O3沉淀
2TlCl3+6NaOH===Tl2O3↓+6NaCl+3H2O
(3)Tl2O3棕色的受热熔化后发生分解,产物是黑色的Tl2O:Tl2O3Tl2O+O2↑
(4)Al2O3和Al(OH)3属于典型的两性化合物,而Ga2O3和Ga(OH)3为两性偏酸性。在铝、镓、铟、铊的氢氧化物中,Ga(OH)3酸性最强,比Al(OH)3强,Ga(OH)3可溶于NH3·H2O,而Al(OH)3不溶于NH3·H2O
Ga(OH)3+3OH-===[Ga(OH)6]3-
(5)In2O3和In(OH)3几乎无两性表现,In2O3溶于酸,但不溶于碱
(6)TlOH尽管的碱性不如KOH强,但仍不失为强碱
(7)镓、铟和铊的氢氧化物(M(OH)3)虽然极不稳定,但它们在水中的溶解度却相当小,其Ksp数量级均在10-44~10-46,可见比Al(OH)3还难溶
4.Tl(Ⅲ)的化合物
(1)Tl(Ⅲ)是较强氧化剂,具有较强的氧化性,可以将许多物质氧化
Tl2(SO4)3+4FeSO4===Tl2SO4+2Fe2(SO4)3
Tl(NO3)3+SO2+2H2O===TlNO3+H2SO4+2HNO3
Tl(NO3)3+3KI===3KNO3+TlI↓+I2↓
(2)由于Tl(Ⅲ)的氧化性强,TlBr3、TlI3难于存在。TlCl3也不稳定,受热时易分解成白色的TlCl
TlCl3TlCl+Cl2↑
4.Tl(I)的化合物
(1)Tl(I)遇到强氧化剂时可以被氧化成Tl(Ⅲ)
①硝酸亚铊可以被氯气流氧化成硝酸铊和氯化铊:3TlNO3+3Cl2===Tl(NO3)3+2TlCl3
②TlCl的悬浊液在氯气流下加热,冷却后生成白色针状结晶水合氯化铊:TlCl+Cl2+4H2OTlCl3 4H2O
③H2O2也可以将Tl(I)氧化成Tl2O3
(2)硫酸亚铊溶液中加入NaCl,将生成TlCl沉淀:Tl2SO4+2NaCl===TlCl↓+Na2SO4
(3)硫酸亚铊溶液中加入NaHS,将生成黑色Tl2S沉淀:Tl2SO4+NaHS===Tl2S↓+NaHSO4
(4)向亚铊盐溶液中加入强碱,虽然可以生成TlOH,但TlOH受热时很容易分解
2Tl2SO4+2NaOH===TlOH↓+Na2SO4
2TlOHTl2O+H2O
(5)TlCl在水中溶解度很小,但可以溶于硫酸,生成硫酸氢亚铊:TlCl+H2SO4===TlHSO4+3HCl,TlCl连同其他卤化铊对于光很敏感,见光将其分解成单质
5.镓与铟的制备
(1)因为镓常与铝、锌、锗等金属混在一起,所以可在提取出这些金属之后的废料中提取。例如,由铝矾土矿制备Al2O3的工艺流程中,铝酸盐溶液经CO2酸化后分离出Al(OH)3沉淀的母液富集了镓。将母液再次经CO2酸化后便可得到富集的Ga(OH)3,使之溶于碱再进行电解即可得到单质镓
Ga(OH)3+OH-===Ga(OH),Ga(OH)+3e-===Ga+4OH-
(2)铟的制备方法是将提取过的闪锌矿残渣用硫酸浸取,酸浸取液经中和后投入锌片,铟就沉积在锌片上,用极稀的硫酸溶去锌,将不溶杂质溶于硝酸,再加入BaCO3,便沉淀出氧化铟,在高温下用氢气还原制得金属铟
【巩固练习】
1.Ga(镓)的稳定同位素Ga和Ga是显示地表风化过程的一种指示剂。下列说法不正确的是( )
A.Ga和Ga的化学性质不相同 B.可用质谱法区分Ga和Ga
C.位于元素周期表中第四周期、第ⅢA族 D.的第一电离能大于K的第一电离能
2.近年来我国科技研究取得重大成就,科技创新离不开化学。下列相关叙述正确的是( )
A.量子通信材料螺旋碳纳米管TEM与石墨烯互为同位素
B.中国空间站太阳翼使用氮化镓(GaN)半导体材料,GaN属于新型金属材料
C.可再生生物降解餐具的成分为聚乳酸(PLA),PLA属于有机高分子材料
D.华为Mate60pro手机的CPU基础材料是SiO2
3.从砷化镓废料(主要成分为GaAs、Fe2O3、SiO2和CaCO3)中回收镓和砷的工艺流程如图所示。下列说法错误的是( )
A.“碱浸”时,温度保持在70℃的目的是提高“碱浸”速率,同时防止H2O2过度分解
B.滤渣Ⅲ的主要成分是H2SO4
C.“旋流电积”所得“尾液”溶质主要是H2SO4,可进行循环利用,提高经济效益
D.得到Na3AsO4 12H2O的操作为直接蒸干
4.用“H2SO4浸出一萃取”法从铅烟灰(主要含有In2O3,还含有PbO和SiO2杂质)中回收单质铟(In)的生产工艺流程如图所示。
已知:I.“萃取”反应:In2(SO4)3+6(HA)2(有机液)2In(HA2)3(有机液)+3H2SO4
II.“反萃”反应:In(HA2)3(有机液)+4HCl3(HA)2(有机液)+HInCl4
下列说法正确的是( )
A.“高温酸浸”时,用浓盐酸代替稀硫酸可提高酸浸速率
B.“萃取”时,等量的萃取剂一次萃取和分多次萃取的效率相同
C.“反萃”时,适当增加盐酸的浓度可提高铟的反萃取率
D.“置换”时,得到海绵铟的化学方程式为:Zn+2HInCl4===ZnCl2+H2↑+2InCl3
5.铟(In)是一种稀有贵金属,广泛应用于航空航天、太阳能电池等高科技领域。从铜烟灰酸浸渣(主要含PbO、FeAsO4 2H2O、In2O3)中提取铟的工艺流程如图:
下列说法错误的是( )
A.整个流程中可循环利用的物质是萃余液
B.亚铁离子在萃取剂中的溶解度大于水中的溶解度
C.“水浸”所得浸渣中还含有PbSO4
D.“还原铁”时发生反应的离子方程式为:2Fe3++S2O===2Fe2++S4O
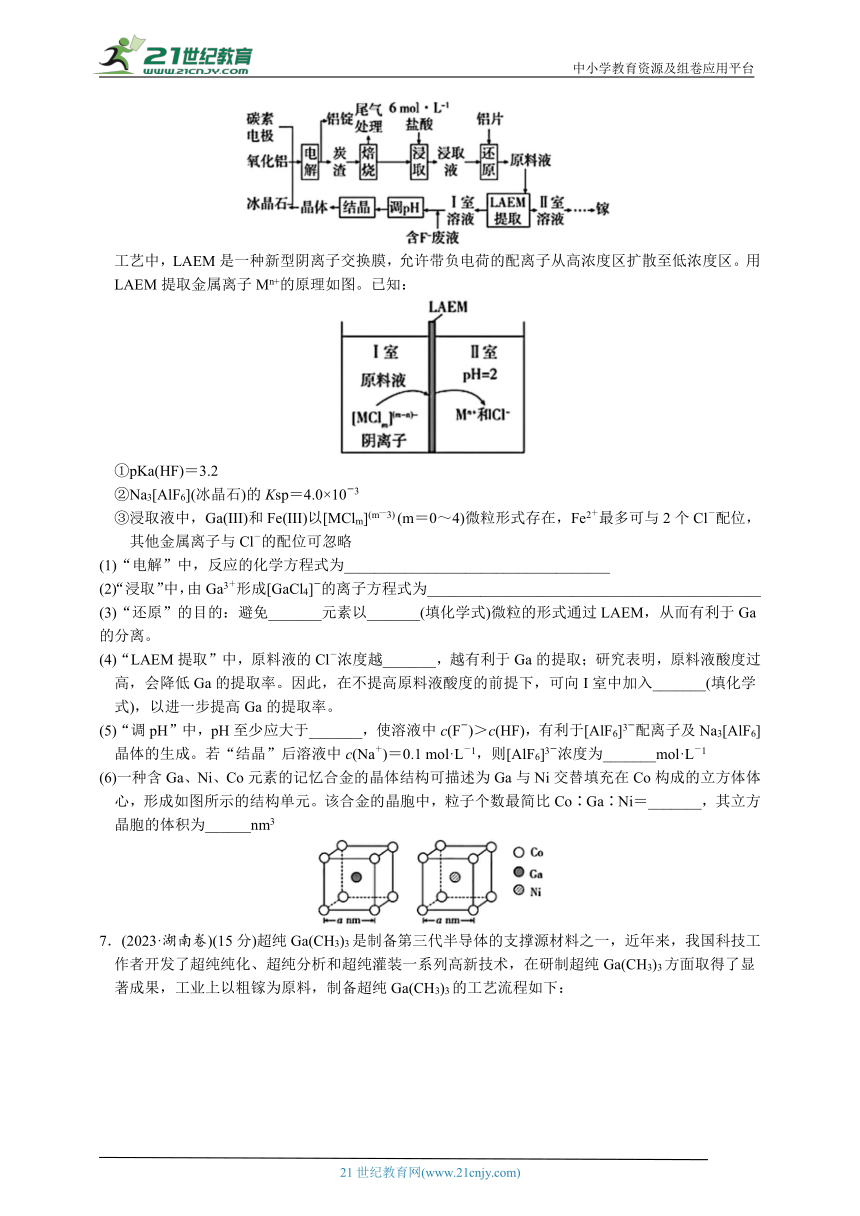
6.(2024·广东卷)镓(Ga)在半导体、记忆合金等高精尖材料领域有重要应用。一种从电解铝的副产品炭渣(含C、Na、Al、F和少量的Ga、Fe、K、Ca等元素)中提取镓及循环利用铝的工艺如下
工艺中,LAEM是一种新型阴离子交换膜,允许带负电荷的配离子从高浓度区扩散至低浓度区。用LAEM提取金属离子Mn+的原理如图。已知:
①pKa(HF)=3.2
②Na3[AlF6](冰晶石)的Ksp=4.0×10-3
③浸取液中,Ga(III)和Fe(III)以[MClm](m—3) (m=0~4)微粒形式存在,Fe2+最多可与2个Cl-配位,其他金属离子与Cl-的配位可忽略
(1)“电解”中,反应的化学方程式为___________________________________
(2)“浸取”中,由Ga3+形成[GaCl4]-的离子方程式为____________________________________________
(3)“还原”的目的:避免_______元素以_______(填化学式)微粒的形式通过LAEM,从而有利于Ga的分离。
(4)“LAEM提取”中,原料液的Cl-浓度越_______,越有利于Ga的提取;研究表明,原料液酸度过高,会降低Ga的提取率。因此,在不提高原料液酸度的前提下,可向I室中加入_______(填化学式),以进一步提高Ga的提取率。
(5)“调pH”中,pH至少应大于_______,使溶液中c(F-)>c(HF),有利于[AlF6]3-配离子及Na3[AlF6]晶体的生成。若“结晶”后溶液中c(Na+)=0.1 mol·L-1,则[AlF6]3-浓度为_______mol·L-1
(6)一种含Ga、Ni、Co元素的记忆合金的晶体结构可描述为Ga与Ni交替填充在Co构成的立方体体心,形成如图所示的结构单元。该合金的晶胞中,粒子个数最简比Co∶Ga∶Ni=_______,其立方晶胞的体积为______nm3
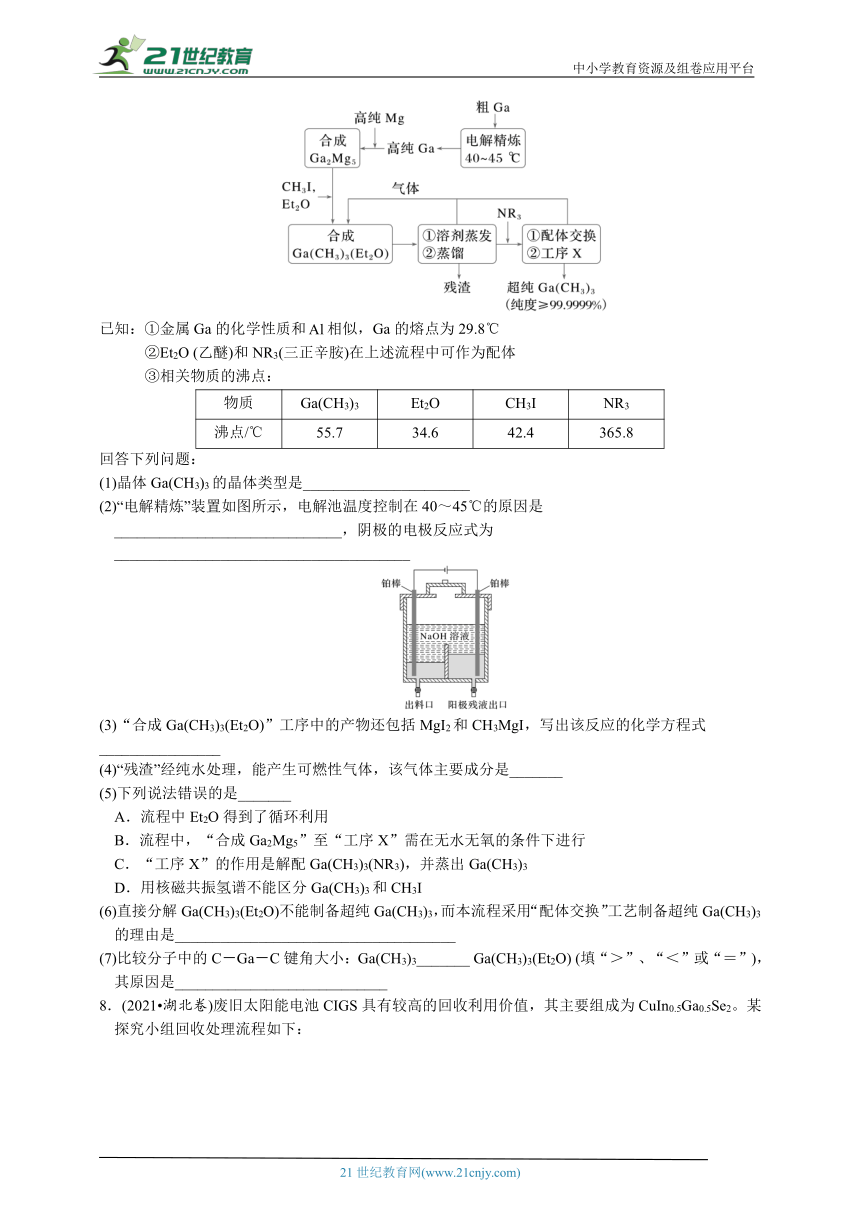
7.(2023·湖南卷)(15分)超纯Ga(CH3)3是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯Ga(CH3)3方面取得了显著成果,工业上以粗镓为原料,制备超纯Ga(CH3)3的工艺流程如下:
已知:①金属Ga的化学性质和相似,Ga的熔点为29.8℃
②Et2O (乙醚)和NR3(三正辛胺)在上述流程中可作为配体
③相关物质的沸点:
物质 Ga(CH3)3 Et2O CH3I NR3
沸点/℃ 55.7 34.6 42.4 365.8
回答下列问题:
(1)晶体Ga(CH3)3的晶体类型是______________________
(2)“电解精炼”装置如图所示,电解池温度控制在40~45℃的原因是______________________________,阴极的电极反应式为_______________________________________
(3)“合成Ga(CH3)3(Et2O)”工序中的产物还包括MgI2和CH3MgI,写出该反应的化学方程式________________
(4)“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是_______
(5)下列说法错误的是_______
A.流程中Et2O得到了循环利用
B.流程中,“合成Ga2Mg5”至“工序X”需在无水无氧的条件下进行
C.“工序X”的作用是解配Ga(CH3)3(NR3),并蒸出Ga(CH3)3
D.用核磁共振氢谱不能区分Ga(CH3)3和CH3I
(6)直接分解Ga(CH3)3(Et2O)不能制备超纯Ga(CH3)3,而本流程采用“配体交换”工艺制备超纯Ga(CH3)3的理由是_____________________________________
(7)比较分子中的C-Ga-C键角大小:Ga(CH3)3_______ Ga(CH3)3(Et2O) (填“>”、“<”或“=”),其原因是____________________________
8.(2021 湖北卷)废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成为CuIn0.5Ga0.5Se2。某探究小组回收处理流程如下:
回答下列问题:
(1)硒(Se)与S为同族元素,Se的最外层电子数为_______________;镓(Ga)和铟(In)位于周期表第三主族,CuIn0.5Ga0.5Se2中Cu的化合价为_______
(2) “酸浸氧化”发生的主要氧化还原反应的化学方程式为_____________________________________________
(3)25℃时,已知:Kb(NH3·H2O)=2.0×10-5,Ksp[Ga(OH)3]=1.0×10-35,Ksp[In(OH)3]=1.0×10-33,Ksp[Cu(OH)2]=1.0×10-20,浸出液中c(Cu2+)=0.01 mol·L-1。当金属阳离子浓度小于1.0×10-5 mol·L-1时完全沉淀,In3+恰好完全沉淀时溶液的pH约为___(保留一位小数);若继续加入6.0mol/L氨水至过量,观察到的实验现象是先有蓝色沉淀,然后________;为探究Ga(OH)3在氨水中能否溶解,计算反应Ga(OH)3(s)+NH3·H2O[Ga(OH)4]-+NH4+的平衡常数K=_______;(已知Ga3++4OH-[Ga(OH)4]- K′=1.0×1034)
(4)“滤渣”与SOCl2混合前需要洗涤、干燥,检验滤渣中SO是否洗净的试剂是________;“回流过滤”中SOCl2的作用是将氢氧化物转化为氯化物和作________________
(5)“高温气相沉积”过程中发生的化学反应方程式为________________________________________
9.从砷化镓废料(主要成分为GaAs,含Fe2O3、SiO2和CaCO3等杂质)中回收镓和砷的工艺流程如图所示:
已知:Ga(OH)3是两性氢氧化物。回答下列问题:
(1)写出Ga(OH)3的电离方程式:________________________________________
(2)“浆化”过程将砷化镓废料转变为悬浊液,目的是__________________________________
(3)“碱浸”过程,砷化镓转化为NaGaO2和Na3AsO4,该反应的离子方程式为______________________________
(4)“电解”时,阴极放电的电极反应式为____________________________。
(5)向“调pH”后得到的滤液中加入足量NaOH溶液,使pH大于12,经______________、降温结晶、过滤、洗涤、________后得到Na3AsO4·12H2O
10.GaN是制造微电子器件,光电子器件的新型半导体材料。综合利用炼锌矿渣{主要含铁酸镓[Ga2(Fe2O4)3]、铁酸锌(ZnFe2O4),还含少量Fe及一些难溶于酸的物质}获得金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如图
已知:①Fe2O在酸性条件下不稳定,易转化为Fe3+
②常温下,“浸出液”中的金属离子对应的氢氧化物的溶度积常数如下表,离子浓度小于1×10-5 mol·L-1时可视为沉淀完全
氢氧化物 Fe(OH)2 Fe(OH)3 Zn(OH)2 Ga(OH)3
Ksp 4.9×10-17 2.8×10-39 1.8×10-14 8.0×10-32
③lg2≈0.3,lg5≈0.7
回答下列问题:
(1)为提高浸出率,可采取的措施为________(填标号)
a.将矿渣粉碎 b.降低温度 c.把稀硫酸换成浓硫酸 d.延长浸出时间
(2)已知纤锌矿结构的GaN晶胞结构与金刚石结构类似,则该种GaN晶体的类型为______________,基态Ga原子价层电子的轨道表示式为________________
(3)与稀硫酸反应的化学方程式为________________________
(4)“调pH”时需调节溶液pH的最小值为________________
(5)检验“滤液1”中是否含有的试剂为________(填名称)
(6)电解反萃取液(溶质为GaAlO2)制粗镓的装置如图所示,阳极的电极反应式为________________
11.从某铋(Bi)、锌的冶炼厂的高铟烟灰(主要含ZnO、Bi2O3、Fe2O3、SnO2、In2O3)中提取铟和铋的流程如图:
已知:SnO2不溶于稀硫酸;NaBiO3难溶于水
回答下列问题:
(1)“滤液1”中含有的金属阳离子有_______(填离子符号)
(2)“酸浸”过程中使用稀硫酸而不用75%的)H2SO4溶液,其原因是___________________________________
(3)“酸溶”生成的(BiO)2SO4中,Bi元素的化合价为_______
(4)“转化2”时发生反应的化学方程式为___________________________________
(5)“系列操作”的流程如下:
已知:“萃取”时发生反应:Mn+(金属阳离子)+H2A2(有机液)M(HA2)n(有机液)+nH+;In3+与Al3+相似,易水解
①试剂X的名称为______________,“萃取”和“反萃取”的目的是______________
②关于虚线框内的实验步骤,下列说法正确的是______________(填标号)
A.可以提高InCl3溶液的浓度
B.烧碱溶液可用纯碱溶液代替
C.需用到分液漏斗、烧杯、玻璃棒等仪器
(6)a kg的高铟烟灰经上述流程后,得到NaBiO3质量分数为w的产品b g,则高铟烟灰中Bi的百分含量为______(用含a、b、w的计算式表示)
【镓、铟、铊及其化合物】答案
1.A。解析:A.Ga和Ga为同位素,化学性质几乎完全相同,但物理性质有所差异,故A错误;B.质谱法可以测相对分子量,由于同位素的相对质量不同,可用质谱法区分Ga和Ga,故B正确;C.Ga位于元素周期表第四周期第IIIA族,故C正确;D.同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,Ga的第一电离能大于K的第一电离能,故D正确;故选:A。
2.C。解析:A.碳纳米管TEM与石墨烯都是碳元素组成的单质,二者互为同素异形体,A不正确;B.金属材料包括金属及合金,氮化镓(GaN)半导体材料中,GaN属于新型无机非金属材料,B不正确;C.聚乳酸(PLA)为有机高分子化合物,则PLA属于有机高分子材料,C正确;D.手机的CPU基础材料是Si,SiO2用于生产光导纤维,D不正确;故选C。
3.D。解析:A.“碱浸”时,温度保持在70℃可以提高“碱浸”速率,同时防止温度过高过氧化氢分解,故A正确;B.根据流程分析可知,SiO2碱浸时发生反应生成SiO进入溶液,加入H2SO4后又反应生成H2SO4,而Ga元素又溶于过量的硫酸,所以滤渣Ⅲ主要为H2SO4,故B正确;C.“旋流电积”时,Ga2(SO4)3溶液电解生成Ga、O2和H2SO4,所以“尾液”溶质主要是H2SO4,可进行循环利用,故C正确;D.因滤液中有其他物质,直接蒸干会有杂质,且会脱结晶水,故D错误;答案选D。
4.C。解析:A.二氧化锰与浓盐酸加热生成氯气,且高温会造成大量的HCl挥发造成损失,不能提高酸浸速率,A错误;B.每一次萃取都是按照一定比例进行的溶质分配,所以多次萃取的效率更高,B错误;C.“反萃”时,适当增加盐酸的浓度,平衡In(HA2)3(有机液)+4HCl3(HA)2(有机液)+HInCl4正向移动,可提高铟的反萃取率,C正确;D.“置换”时锌与HInCl4反应产生In单质而不是氢气,发生反应的化学方程式为
3Zn+2HInCl4===3ZnCl2+2HCl+2In,D错误;综上所述答案为C。
5.B。解析:A.由流程可知萃余液中主要成分为硫酸,可循环利用,A正确;B.萃取剂加入亚铁离子进入水层,所以得出亚铁离子在萃取剂中溶解度小于水中溶解度,故B错误;C.PbO与H2SO4反应生成难溶于水的PbSO4,C正确;D.根据还原铁的信息,可知铁离子转化为亚铁离子、S2O转化为S4O,反应为:2Fe3++S2O===2Fe2++S4O,D正确。
故答案选B。
6.(1)2Al2O34Al+3O2↑
(2)Ga3++4Cl-===[GaCl4]-
(3)铁 [FeCl6]3-
(4)高 NaCl
(5)3.2 4.0×10-7
(6)2∶1∶1 8a3
解析:电解铝的副产品炭渣(含C、Na、Al、F和少量的Ga、Fe、K、Ca等元素)进行焙烧,金属转化为氧化物,焙烧后的固体加入盐酸浸取,浸取液加入铝片将Fe3+进行还原,得到原料液,原料液利用LAEM提取,[GaCl4]-通过交换膜进入II室并转化为Ga3+,II室溶液进一步处理得到镓,I室溶液加入含F-的废液调pH并结晶得到NaAlF6晶体用于电解铝;
(1)“电解”是电解熔融的氧化铝冶炼铝单质,反应的化学方程式为2Al2O34Al+3O2↑;
(2)“浸取”中,由Ga3+形成[GaCl4]-的离子方程式为Ga3++4Cl-===[GaCl4]-;
(3)由已知,浸取液中,Ga(III)和Fe(III)以[MClm](m-3)(m=0~4)微粒形式存在,为了避免铁元素以[FeCl6]3-的微粒形式通过LAEM,故要加入铝片还原Fe3+,从而有利于Ga的分离;
(4)“LAEM提取”中,原料液的Cl-浓度越高,更有利于生成[GaCl4]-的反应正向移动,更有利于Ga的提取,在不提高原料液酸度的前提下,同时不引入新杂质,可向I室中加入NaCl,提高Cl-浓度,进一步提高Ga的提取率;
(5)由pKa(HF)=3.2,Ka(HF)==10-3.2,为了使溶液中c(F-)>c(HF),c(H+)=×10-3.2<10-3.2mol/L,故pH至少应大于3.2,有利于[AlF6]3-配离子及Na3[AlF6]晶体的生成,若“结晶”后溶液中c(Na+)=0.10mol L-1,根据Na3[AlF6](冰晶石)的Ksp为4.0×10-10,[AlF6]3-浓度为=4.0×10-7mol L-1;
(6)合金的晶体结构可描述为Ga与Ni交替填充在Co构成的立方体体心,形成如图所示的结构单元,取Ga为晶胞顶点,晶胞面心也是Ga,Ni处于晶胞棱心和体心,Ga和Ni形成类似氯化钠晶胞的结构,晶胞中Ga和Ni形成的8个小正方体体心为Co,故晶胞中Ga、Ni个数为4,Co个数为8,粒子个数最简比Co:Ga:Ni=2:1:1,晶胞棱长为两个最近的Ga之间(或最近的Ni之间)的距离,为2a nm,故晶胞的体积为8a3nm。
7.(1)分子晶体
(2) 保证Ga为液体,便于纯Ga流出 Ga3++3eˉ=Ga
(3)8CH3I+2Et2O+Ga2Mg5===2Ga(CH3)3(Et2O)+3 MgI2+2CH3MgI
(4)CH4
(5)D
(6)NR3沸点较高,易与Ga(CH3)3分离,Et2O的沸点低于Ga(CH3)3,一起气化,难以得到超纯Ga(CH3)3
(7)> Ga(CH3)3中Ga为sp2杂化,所以为平面结构,而Ga(CH3)3(Et2O)中Ga为sp3杂化,所以为四面体结构,故夹角较小
解析:以粗镓为原料,制备超纯Ga(CH3)3,粗Ga经过电解精炼得到纯Ga,Ga和Mg反应生产Ga2Mg5,Ga2Mg5和CH3I、Et2O反应生成Ga(CH3)3(Et2O)、MgI2和CH3MgI,然后经过蒸发溶剂、蒸馏,除去残渣MgI2、CH3MgI,加入NR3进行配体交换、进一步蒸出得到超纯Ga(CH3)3,Et2O重复利用。(1)晶体Ga(CH3)3的沸点较低,晶体类型是分子晶体;(2)电解池温度控制在40~45℃可以保证Ga为液体,便于纯Ga流出;粗Ga在阳极失去电子,阴极得到Ga,电极反应式为Ga3++3eˉ=Ga;(3)“合成Ga(CH3)3(Et2O)”工序中的产物还包括MgI2和CH3MgI,该反应的化学方程式8CH3I+2Et2O+Ga2Mg5===2Ga(CH3)3(Et2O)+3 MgI2+2CH3MgI;(4)“残渣”含CH3MgI,经纯水处理,能产生可燃性气体CH4;(5)A项,流程中Et2O得到了循环利用,A正确;B项, Ga(CH3)3(Et2O)容易和水反应,容易被氧化,则流程中,“合成Ga2Mg5”至“工序X”需在无水无氧的条件下进行,B正确;C项, “配体交换”得到Ga(CH3)3(NR3),“工序X”先解配Ga(CH3)3(NR3)后蒸出Ga(CH3)3,C正确;D项,二者甲基的环境不同,核磁共振氢谱化学位移不同,用核磁共振氢谱能区分Ga(CH3)3和CH3I,D错误;故选D;(6)直接分解Ga(CH3)3(Et2O)时由于Et2O的沸点较低,与Ga(CH3)3一起蒸出,不能制备超纯Ga(CH3)3,而本流程采用“配体交换”工艺制备超纯Ga(CH3)3的理由是,根据题给相关物质沸点可知,NR3沸点远高于Ga(CH3)3,与Ga(CH3)3易分离;(7)分子中的C-Ga-C键角Ga(CH3)3> Ga(CH3)3(Et2O),其原因是Ga(CH3)3中Ga为sp2杂化,所以为平面结构,而Ga(CH3)3(Et2O)中Ga为sp3杂化,所以为四面体结构,故夹角较小。
8.(1)6 +1
(2)Cu2O+H2O2+2H2SO4==2CuSO4+3H2O
(3)4.7 蓝色沉淀溶解,溶液变为深蓝色 2.0×10-6
(4)HCl溶液、BaCl2溶液 溶剂
(5)GaCl3+NH3GaN+3HCl
解析:⑴Se与S同主族,故其最外层有6个电子。Se为VIA组元素,化合价为—2,Ga与In同为IIIA组元素,化合价均为+3,根据化合价规则可求得Cu的化合价为+1; ⑵该化合物中Ga和In元素均处于最高价态,高温焙烧时Se元素转化为SeO2,则酸浸氧化时H2O2氧化+1价的Cu,高温焙烧时Cu转化为更为稳定的Cu2O,故酸浸氧化时发生的主要氧化还原反应为:Cu2O+H2O2+2H2SO4==2CuSO4+3H2O; ⑶根据Ksp[In(OH)3]=c(In3+)·c3(OH—)可求得当In3+完全沉淀时溶液的c(OH—)=1.0×10—(28/3),进而求得pH=4.7.若继续加入6.0mol/L氨水至过量,先生成蓝色Cu(OH)2沉淀,然后蓝色沉淀溶解,得到深蓝色溶液Cu(NH3)42+。将Ga(OH)3(s)Ga3+(aq)+3OH—(aq)、Ga3++3OH—[Ga(OH)4]—、NH3·H2ONH4++OH—三个反应叠加可以得到Ga(OH)3(s)+NH3·H2O[Ga(OH)4]—+NH4+,则该平衡常数K=Ksp[Ga(OH)3]·K′·Kb=1.0×10—35×1.0×1034×2.0×10—5=2.0×10—6; ⑷加氨水的目的是沉淀溶液中的Ga3+、In3+,得到的滤液I主要含有(NH4)2SO4、Cu(NH3)4SO4,检验滤渣中SO是否洗净,可加入盐酸酸化的BaCl2溶液。SOCl2与体系中少许的H2O生成HCl和SO2,故能将氢氧化物转化为氯化物,同时将滤渣进行分散,让反应得以充分进行,故作溶剂作用;⑸高温气相沉积时GaCl3和NH3反应生成GaN,同时得到HCl:GaCl3+NH3GaN+3HCl。
9.(1)H2O+H++GaOGa(OH)3Ga3++3OH-
(2)增大固液接触面积,提高碱浸速率
(3)GaAs+4OH-+4H2O2===GaO+AsO+6H2O
(4)Ga3++3e-===Ga
(5)蒸发浓缩(或加热浓缩) 低温干燥
解析:
10.(1)ad
(2)共价晶体
(3)ZnFe2O4+4H2SO4===ZnSO4+Fe2(SO4)3+4H2O
(4)5.3
(5)硫氰化钾
(6)2H2O-4e-+4CO=O2↑+4HCO
解析:(1)为提高浸出率,可采取的措施有粉碎矿渣,延长浸出时间,故选ad;
(2)金刚石为共价晶体,GaN晶胞结构与金刚石结构类似,则该种GaN晶体的类型为共价晶体;Ga为31号元素,则基态Ga原子价层电子的轨道表示式为;
(3)根据化合物中各元素化合价代数和为0可知,铁元素的化合价为+3价,ZnFe2O4与稀硫酸反应生成硫酸锌、硫酸铁和水,反应的化学方程式为ZnFe2O4+4H2SO4===ZnSO4+Fe2(SO4)3+4H2O;
(4)调节pH,沉淀铁离子和Ga3+,滤液1中含有锌离子,,c(OH-)=mol/L,c(H+)=5×10-6,pH=6-lg5=5.3,则“调pH”时需调节溶液pH的最小值为5.3;
(5)Fe3+遇到硫氰根离子显红色,则检验“滤液1”中是否含有Fe3+的试剂为硫氰化钾;
(6)由图可知,阳极水失去电子生成氧气同时生成碳酸氢根离子,则阳极的电极反应式为:2H2O-4e-+4CO=O2↑+4HCO;
11.(1)Zn2+和Al3+
(2)用75%的硫酸会使SnO2溶解,达不到与ZnO、Fe2O3分离的目的
(3)+3
(4)BiCl3+4NaOH+NaClO===NaBiO3↓+4NaCl+2H2O
(5)盐酸 选择性除去锡离子,提纯铟离子,后续可以得到高纯度的铟产品 AB
(6) ×100%
解析:(1)由分析可知,滤液1中的阳离子有Fe3+和Zn2+;
(2)由题给已知SnO2 不溶于稀硫酸,若用75%的硫酸则使SnO2溶解,达不到与ZnO、Fe2O3分离的目的;
(3)“酸溶”生成的(BiO)2SO4中,Bi元素的化合价为+3价;
(4)“转化2”时发生反应为氯化铋与氢氧化钠、次氯酸钠转化为NaBiO3,反应化学方程式为:BiCl3+4NaOH+NaClO===NaBiO3↓+4NaCl+2H2O;
(5)①要使萃取平衡逆向移动且不能引入新的阴离子,则实际X为盐酸;②“萃取”和“反萃取”的目的是:选择性除去锡离子,提纯铟离子,后续可以得到高纯度的铟产品;③A.先将铟转化为沉淀再加盐酸溶解,可以起到富集铟的作用,提高InCl3溶液的浓度,A正确 B.纯碱也可以沉淀铟,所以可以用烧碱溶液代替纯碱溶液,B正确;C.该过程涉及到过滤,不需要用到分液漏斗,C错误;故选AB。
(6)Bi的质量为 g,则高铟烟灰中Bi的百分含量为 ×100%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
镓、铟、铊及其化合物
【核心知识梳理】
1.镓、铟、铊的原子结构
原子符号 31Ga 49In 81Tl
电子排布式 [Ar]3d104s24p1 [Kr]4d105s25p1 [Xe]4f145d106s26p1
原子结构示意图
价层电子排布图(轨道表示式)
价层电子排布式 4s24p1 5s25p1 6s26p1
周期表中的位置 第四周期第ⅢA族 第五周期第ⅢA族 第六周期第ⅢA族
2.镓、铟、铊的单质
(1)物理性质:镓是银白色软金属,熔点为29.7646℃,在人的手掌中就能熔化,而其沸点为2229℃,熔点和沸点之差在所有金属中是最大的。基于这一特点,镓被用来制造测量高温的温度计。铟、铊的物理性质和镓近似
(2)化学性质
①镓、铟和铊3种金属都能与非氧化性酸反应
2Ga+3H2SO4(稀)===Ga2(SO4)3+3H2↑
2In+3H2SO4(稀)===In2(SO4)3+3H2↑
2Tl+3H2SO4(稀)===Tl2(SO4)3+3H2↑
②镓、铟和铊3种金属都能与氧化性酸反应,Ga、In被氧化到+3价,Tl只被氧化到+1价
Ga+6HNO3(浓)===Ga(NO3)3+3NO2↑+3H2O
In+6HNO3(浓)===In(NO3)3+3NO2↑+3H2O
Tl+2HNO3(浓)===InNO3+NO2↑+H2O
③Ga与铝类似,具有两性,金属性弱于铝,既可以与酸反应,也可以与碱反应
2Ga+2NaOH+6H2O===2Na[Ga(OH)4]+3H2↑
④常温下,镓与铟表面存在氧化层,导致其化学性质不活泼
⑤镓、铟和铊与F2反应剧烈,与Cl2、Br2、I2及P,S等反应较慢,有的反应需要加热
3.镓、铟和铊的氧化物和氢氧化物
镓、铟和铊的氢氧化物均不稳定,且按镓、铟、铊的顺序稳定性下降。这些氧化物均易脱水,生成氧化物
(1)Ga(OH)3、In(OH)3微热时脱水,生成氧化物:2M(OH)3M2O3+3H2O (M=Ga或In)
(2)Tl(OH)3不稳定到几乎不能存在,向TlCl3溶液中加入强碱,将直接生成Tl2O3沉淀
2TlCl3+6NaOH===Tl2O3↓+6NaCl+3H2O
(3)Tl2O3棕色的受热熔化后发生分解,产物是黑色的Tl2O:Tl2O3Tl2O+O2↑
(4)Al2O3和Al(OH)3属于典型的两性化合物,而Ga2O3和Ga(OH)3为两性偏酸性。在铝、镓、铟、铊的氢氧化物中,Ga(OH)3酸性最强,比Al(OH)3强,Ga(OH)3可溶于NH3·H2O,而Al(OH)3不溶于NH3·H2O
Ga(OH)3+3OH-===[Ga(OH)6]3-
(5)In2O3和In(OH)3几乎无两性表现,In2O3溶于酸,但不溶于碱
(6)TlOH尽管的碱性不如KOH强,但仍不失为强碱
(7)镓、铟和铊的氢氧化物(M(OH)3)虽然极不稳定,但它们在水中的溶解度却相当小,其Ksp数量级均在10-44~10-46,可见比Al(OH)3还难溶
4.Tl(Ⅲ)的化合物
(1)Tl(Ⅲ)是较强氧化剂,具有较强的氧化性,可以将许多物质氧化
Tl2(SO4)3+4FeSO4===Tl2SO4+2Fe2(SO4)3
Tl(NO3)3+SO2+2H2O===TlNO3+H2SO4+2HNO3
Tl(NO3)3+3KI===3KNO3+TlI↓+I2↓
(2)由于Tl(Ⅲ)的氧化性强,TlBr3、TlI3难于存在。TlCl3也不稳定,受热时易分解成白色的TlCl
TlCl3TlCl+Cl2↑
4.Tl(I)的化合物
(1)Tl(I)遇到强氧化剂时可以被氧化成Tl(Ⅲ)
①硝酸亚铊可以被氯气流氧化成硝酸铊和氯化铊:3TlNO3+3Cl2===Tl(NO3)3+2TlCl3
②TlCl的悬浊液在氯气流下加热,冷却后生成白色针状结晶水合氯化铊:TlCl+Cl2+4H2OTlCl3 4H2O
③H2O2也可以将Tl(I)氧化成Tl2O3
(2)硫酸亚铊溶液中加入NaCl,将生成TlCl沉淀:Tl2SO4+2NaCl===TlCl↓+Na2SO4
(3)硫酸亚铊溶液中加入NaHS,将生成黑色Tl2S沉淀:Tl2SO4+NaHS===Tl2S↓+NaHSO4
(4)向亚铊盐溶液中加入强碱,虽然可以生成TlOH,但TlOH受热时很容易分解
2Tl2SO4+2NaOH===TlOH↓+Na2SO4
2TlOHTl2O+H2O
(5)TlCl在水中溶解度很小,但可以溶于硫酸,生成硫酸氢亚铊:TlCl+H2SO4===TlHSO4+3HCl,TlCl连同其他卤化铊对于光很敏感,见光将其分解成单质
5.镓与铟的制备
(1)因为镓常与铝、锌、锗等金属混在一起,所以可在提取出这些金属之后的废料中提取。例如,由铝矾土矿制备Al2O3的工艺流程中,铝酸盐溶液经CO2酸化后分离出Al(OH)3沉淀的母液富集了镓。将母液再次经CO2酸化后便可得到富集的Ga(OH)3,使之溶于碱再进行电解即可得到单质镓
Ga(OH)3+OH-===Ga(OH),Ga(OH)+3e-===Ga+4OH-
(2)铟的制备方法是将提取过的闪锌矿残渣用硫酸浸取,酸浸取液经中和后投入锌片,铟就沉积在锌片上,用极稀的硫酸溶去锌,将不溶杂质溶于硝酸,再加入BaCO3,便沉淀出氧化铟,在高温下用氢气还原制得金属铟
【巩固练习】
1.Ga(镓)的稳定同位素Ga和Ga是显示地表风化过程的一种指示剂。下列说法不正确的是( )
A.Ga和Ga的化学性质不相同 B.可用质谱法区分Ga和Ga
C.位于元素周期表中第四周期、第ⅢA族 D.的第一电离能大于K的第一电离能
2.近年来我国科技研究取得重大成就,科技创新离不开化学。下列相关叙述正确的是( )
A.量子通信材料螺旋碳纳米管TEM与石墨烯互为同位素
B.中国空间站太阳翼使用氮化镓(GaN)半导体材料,GaN属于新型金属材料
C.可再生生物降解餐具的成分为聚乳酸(PLA),PLA属于有机高分子材料
D.华为Mate60pro手机的CPU基础材料是SiO2
3.从砷化镓废料(主要成分为GaAs、Fe2O3、SiO2和CaCO3)中回收镓和砷的工艺流程如图所示。下列说法错误的是( )
A.“碱浸”时,温度保持在70℃的目的是提高“碱浸”速率,同时防止H2O2过度分解
B.滤渣Ⅲ的主要成分是H2SO4
C.“旋流电积”所得“尾液”溶质主要是H2SO4,可进行循环利用,提高经济效益
D.得到Na3AsO4 12H2O的操作为直接蒸干
4.用“H2SO4浸出一萃取”法从铅烟灰(主要含有In2O3,还含有PbO和SiO2杂质)中回收单质铟(In)的生产工艺流程如图所示。
已知:I.“萃取”反应:In2(SO4)3+6(HA)2(有机液)2In(HA2)3(有机液)+3H2SO4
II.“反萃”反应:In(HA2)3(有机液)+4HCl3(HA)2(有机液)+HInCl4
下列说法正确的是( )
A.“高温酸浸”时,用浓盐酸代替稀硫酸可提高酸浸速率
B.“萃取”时,等量的萃取剂一次萃取和分多次萃取的效率相同
C.“反萃”时,适当增加盐酸的浓度可提高铟的反萃取率
D.“置换”时,得到海绵铟的化学方程式为:Zn+2HInCl4===ZnCl2+H2↑+2InCl3
5.铟(In)是一种稀有贵金属,广泛应用于航空航天、太阳能电池等高科技领域。从铜烟灰酸浸渣(主要含PbO、FeAsO4 2H2O、In2O3)中提取铟的工艺流程如图:
下列说法错误的是( )
A.整个流程中可循环利用的物质是萃余液
B.亚铁离子在萃取剂中的溶解度大于水中的溶解度
C.“水浸”所得浸渣中还含有PbSO4
D.“还原铁”时发生反应的离子方程式为:2Fe3++S2O===2Fe2++S4O
6.(2024·广东卷)镓(Ga)在半导体、记忆合金等高精尖材料领域有重要应用。一种从电解铝的副产品炭渣(含C、Na、Al、F和少量的Ga、Fe、K、Ca等元素)中提取镓及循环利用铝的工艺如下
工艺中,LAEM是一种新型阴离子交换膜,允许带负电荷的配离子从高浓度区扩散至低浓度区。用LAEM提取金属离子Mn+的原理如图。已知:
①pKa(HF)=3.2
②Na3[AlF6](冰晶石)的Ksp=4.0×10-3
③浸取液中,Ga(III)和Fe(III)以[MClm](m—3) (m=0~4)微粒形式存在,Fe2+最多可与2个Cl-配位,其他金属离子与Cl-的配位可忽略
(1)“电解”中,反应的化学方程式为___________________________________
(2)“浸取”中,由Ga3+形成[GaCl4]-的离子方程式为____________________________________________
(3)“还原”的目的:避免_______元素以_______(填化学式)微粒的形式通过LAEM,从而有利于Ga的分离。
(4)“LAEM提取”中,原料液的Cl-浓度越_______,越有利于Ga的提取;研究表明,原料液酸度过高,会降低Ga的提取率。因此,在不提高原料液酸度的前提下,可向I室中加入_______(填化学式),以进一步提高Ga的提取率。
(5)“调pH”中,pH至少应大于_______,使溶液中c(F-)>c(HF),有利于[AlF6]3-配离子及Na3[AlF6]晶体的生成。若“结晶”后溶液中c(Na+)=0.1 mol·L-1,则[AlF6]3-浓度为_______mol·L-1
(6)一种含Ga、Ni、Co元素的记忆合金的晶体结构可描述为Ga与Ni交替填充在Co构成的立方体体心,形成如图所示的结构单元。该合金的晶胞中,粒子个数最简比Co∶Ga∶Ni=_______,其立方晶胞的体积为______nm3
7.(2023·湖南卷)(15分)超纯Ga(CH3)3是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯Ga(CH3)3方面取得了显著成果,工业上以粗镓为原料,制备超纯Ga(CH3)3的工艺流程如下:
已知:①金属Ga的化学性质和相似,Ga的熔点为29.8℃
②Et2O (乙醚)和NR3(三正辛胺)在上述流程中可作为配体
③相关物质的沸点:
物质 Ga(CH3)3 Et2O CH3I NR3
沸点/℃ 55.7 34.6 42.4 365.8
回答下列问题:
(1)晶体Ga(CH3)3的晶体类型是______________________
(2)“电解精炼”装置如图所示,电解池温度控制在40~45℃的原因是______________________________,阴极的电极反应式为_______________________________________
(3)“合成Ga(CH3)3(Et2O)”工序中的产物还包括MgI2和CH3MgI,写出该反应的化学方程式________________
(4)“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是_______
(5)下列说法错误的是_______
A.流程中Et2O得到了循环利用
B.流程中,“合成Ga2Mg5”至“工序X”需在无水无氧的条件下进行
C.“工序X”的作用是解配Ga(CH3)3(NR3),并蒸出Ga(CH3)3
D.用核磁共振氢谱不能区分Ga(CH3)3和CH3I
(6)直接分解Ga(CH3)3(Et2O)不能制备超纯Ga(CH3)3,而本流程采用“配体交换”工艺制备超纯Ga(CH3)3的理由是_____________________________________
(7)比较分子中的C-Ga-C键角大小:Ga(CH3)3_______ Ga(CH3)3(Et2O) (填“>”、“<”或“=”),其原因是____________________________
8.(2021 湖北卷)废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成为CuIn0.5Ga0.5Se2。某探究小组回收处理流程如下:
回答下列问题:
(1)硒(Se)与S为同族元素,Se的最外层电子数为_______________;镓(Ga)和铟(In)位于周期表第三主族,CuIn0.5Ga0.5Se2中Cu的化合价为_______
(2) “酸浸氧化”发生的主要氧化还原反应的化学方程式为_____________________________________________
(3)25℃时,已知:Kb(NH3·H2O)=2.0×10-5,Ksp[Ga(OH)3]=1.0×10-35,Ksp[In(OH)3]=1.0×10-33,Ksp[Cu(OH)2]=1.0×10-20,浸出液中c(Cu2+)=0.01 mol·L-1。当金属阳离子浓度小于1.0×10-5 mol·L-1时完全沉淀,In3+恰好完全沉淀时溶液的pH约为___(保留一位小数);若继续加入6.0mol/L氨水至过量,观察到的实验现象是先有蓝色沉淀,然后________;为探究Ga(OH)3在氨水中能否溶解,计算反应Ga(OH)3(s)+NH3·H2O[Ga(OH)4]-+NH4+的平衡常数K=_______;(已知Ga3++4OH-[Ga(OH)4]- K′=1.0×1034)
(4)“滤渣”与SOCl2混合前需要洗涤、干燥,检验滤渣中SO是否洗净的试剂是________;“回流过滤”中SOCl2的作用是将氢氧化物转化为氯化物和作________________
(5)“高温气相沉积”过程中发生的化学反应方程式为________________________________________
9.从砷化镓废料(主要成分为GaAs,含Fe2O3、SiO2和CaCO3等杂质)中回收镓和砷的工艺流程如图所示:
已知:Ga(OH)3是两性氢氧化物。回答下列问题:
(1)写出Ga(OH)3的电离方程式:________________________________________
(2)“浆化”过程将砷化镓废料转变为悬浊液,目的是__________________________________
(3)“碱浸”过程,砷化镓转化为NaGaO2和Na3AsO4,该反应的离子方程式为______________________________
(4)“电解”时,阴极放电的电极反应式为____________________________。
(5)向“调pH”后得到的滤液中加入足量NaOH溶液,使pH大于12,经______________、降温结晶、过滤、洗涤、________后得到Na3AsO4·12H2O
10.GaN是制造微电子器件,光电子器件的新型半导体材料。综合利用炼锌矿渣{主要含铁酸镓[Ga2(Fe2O4)3]、铁酸锌(ZnFe2O4),还含少量Fe及一些难溶于酸的物质}获得金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如图
已知:①Fe2O在酸性条件下不稳定,易转化为Fe3+
②常温下,“浸出液”中的金属离子对应的氢氧化物的溶度积常数如下表,离子浓度小于1×10-5 mol·L-1时可视为沉淀完全
氢氧化物 Fe(OH)2 Fe(OH)3 Zn(OH)2 Ga(OH)3
Ksp 4.9×10-17 2.8×10-39 1.8×10-14 8.0×10-32
③lg2≈0.3,lg5≈0.7
回答下列问题:
(1)为提高浸出率,可采取的措施为________(填标号)
a.将矿渣粉碎 b.降低温度 c.把稀硫酸换成浓硫酸 d.延长浸出时间
(2)已知纤锌矿结构的GaN晶胞结构与金刚石结构类似,则该种GaN晶体的类型为______________,基态Ga原子价层电子的轨道表示式为________________
(3)与稀硫酸反应的化学方程式为________________________
(4)“调pH”时需调节溶液pH的最小值为________________
(5)检验“滤液1”中是否含有的试剂为________(填名称)
(6)电解反萃取液(溶质为GaAlO2)制粗镓的装置如图所示,阳极的电极反应式为________________
11.从某铋(Bi)、锌的冶炼厂的高铟烟灰(主要含ZnO、Bi2O3、Fe2O3、SnO2、In2O3)中提取铟和铋的流程如图:
已知:SnO2不溶于稀硫酸;NaBiO3难溶于水
回答下列问题:
(1)“滤液1”中含有的金属阳离子有_______(填离子符号)
(2)“酸浸”过程中使用稀硫酸而不用75%的)H2SO4溶液,其原因是___________________________________
(3)“酸溶”生成的(BiO)2SO4中,Bi元素的化合价为_______
(4)“转化2”时发生反应的化学方程式为___________________________________
(5)“系列操作”的流程如下:
已知:“萃取”时发生反应:Mn+(金属阳离子)+H2A2(有机液)M(HA2)n(有机液)+nH+;In3+与Al3+相似,易水解
①试剂X的名称为______________,“萃取”和“反萃取”的目的是______________
②关于虚线框内的实验步骤,下列说法正确的是______________(填标号)
A.可以提高InCl3溶液的浓度
B.烧碱溶液可用纯碱溶液代替
C.需用到分液漏斗、烧杯、玻璃棒等仪器
(6)a kg的高铟烟灰经上述流程后,得到NaBiO3质量分数为w的产品b g,则高铟烟灰中Bi的百分含量为______(用含a、b、w的计算式表示)
【镓、铟、铊及其化合物】答案
1.A。解析:A.Ga和Ga为同位素,化学性质几乎完全相同,但物理性质有所差异,故A错误;B.质谱法可以测相对分子量,由于同位素的相对质量不同,可用质谱法区分Ga和Ga,故B正确;C.Ga位于元素周期表第四周期第IIIA族,故C正确;D.同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,Ga的第一电离能大于K的第一电离能,故D正确;故选:A。
2.C。解析:A.碳纳米管TEM与石墨烯都是碳元素组成的单质,二者互为同素异形体,A不正确;B.金属材料包括金属及合金,氮化镓(GaN)半导体材料中,GaN属于新型无机非金属材料,B不正确;C.聚乳酸(PLA)为有机高分子化合物,则PLA属于有机高分子材料,C正确;D.手机的CPU基础材料是Si,SiO2用于生产光导纤维,D不正确;故选C。
3.D。解析:A.“碱浸”时,温度保持在70℃可以提高“碱浸”速率,同时防止温度过高过氧化氢分解,故A正确;B.根据流程分析可知,SiO2碱浸时发生反应生成SiO进入溶液,加入H2SO4后又反应生成H2SO4,而Ga元素又溶于过量的硫酸,所以滤渣Ⅲ主要为H2SO4,故B正确;C.“旋流电积”时,Ga2(SO4)3溶液电解生成Ga、O2和H2SO4,所以“尾液”溶质主要是H2SO4,可进行循环利用,故C正确;D.因滤液中有其他物质,直接蒸干会有杂质,且会脱结晶水,故D错误;答案选D。
4.C。解析:A.二氧化锰与浓盐酸加热生成氯气,且高温会造成大量的HCl挥发造成损失,不能提高酸浸速率,A错误;B.每一次萃取都是按照一定比例进行的溶质分配,所以多次萃取的效率更高,B错误;C.“反萃”时,适当增加盐酸的浓度,平衡In(HA2)3(有机液)+4HCl3(HA)2(有机液)+HInCl4正向移动,可提高铟的反萃取率,C正确;D.“置换”时锌与HInCl4反应产生In单质而不是氢气,发生反应的化学方程式为
3Zn+2HInCl4===3ZnCl2+2HCl+2In,D错误;综上所述答案为C。
5.B。解析:A.由流程可知萃余液中主要成分为硫酸,可循环利用,A正确;B.萃取剂加入亚铁离子进入水层,所以得出亚铁离子在萃取剂中溶解度小于水中溶解度,故B错误;C.PbO与H2SO4反应生成难溶于水的PbSO4,C正确;D.根据还原铁的信息,可知铁离子转化为亚铁离子、S2O转化为S4O,反应为:2Fe3++S2O===2Fe2++S4O,D正确。
故答案选B。
6.(1)2Al2O34Al+3O2↑
(2)Ga3++4Cl-===[GaCl4]-
(3)铁 [FeCl6]3-
(4)高 NaCl
(5)3.2 4.0×10-7
(6)2∶1∶1 8a3
解析:电解铝的副产品炭渣(含C、Na、Al、F和少量的Ga、Fe、K、Ca等元素)进行焙烧,金属转化为氧化物,焙烧后的固体加入盐酸浸取,浸取液加入铝片将Fe3+进行还原,得到原料液,原料液利用LAEM提取,[GaCl4]-通过交换膜进入II室并转化为Ga3+,II室溶液进一步处理得到镓,I室溶液加入含F-的废液调pH并结晶得到NaAlF6晶体用于电解铝;
(1)“电解”是电解熔融的氧化铝冶炼铝单质,反应的化学方程式为2Al2O34Al+3O2↑;
(2)“浸取”中,由Ga3+形成[GaCl4]-的离子方程式为Ga3++4Cl-===[GaCl4]-;
(3)由已知,浸取液中,Ga(III)和Fe(III)以[MClm](m-3)(m=0~4)微粒形式存在,为了避免铁元素以[FeCl6]3-的微粒形式通过LAEM,故要加入铝片还原Fe3+,从而有利于Ga的分离;
(4)“LAEM提取”中,原料液的Cl-浓度越高,更有利于生成[GaCl4]-的反应正向移动,更有利于Ga的提取,在不提高原料液酸度的前提下,同时不引入新杂质,可向I室中加入NaCl,提高Cl-浓度,进一步提高Ga的提取率;
(5)由pKa(HF)=3.2,Ka(HF)==10-3.2,为了使溶液中c(F-)>c(HF),c(H+)=×10-3.2<10-3.2mol/L,故pH至少应大于3.2,有利于[AlF6]3-配离子及Na3[AlF6]晶体的生成,若“结晶”后溶液中c(Na+)=0.10mol L-1,根据Na3[AlF6](冰晶石)的Ksp为4.0×10-10,[AlF6]3-浓度为=4.0×10-7mol L-1;
(6)合金的晶体结构可描述为Ga与Ni交替填充在Co构成的立方体体心,形成如图所示的结构单元,取Ga为晶胞顶点,晶胞面心也是Ga,Ni处于晶胞棱心和体心,Ga和Ni形成类似氯化钠晶胞的结构,晶胞中Ga和Ni形成的8个小正方体体心为Co,故晶胞中Ga、Ni个数为4,Co个数为8,粒子个数最简比Co:Ga:Ni=2:1:1,晶胞棱长为两个最近的Ga之间(或最近的Ni之间)的距离,为2a nm,故晶胞的体积为8a3nm。
7.(1)分子晶体
(2) 保证Ga为液体,便于纯Ga流出 Ga3++3eˉ=Ga
(3)8CH3I+2Et2O+Ga2Mg5===2Ga(CH3)3(Et2O)+3 MgI2+2CH3MgI
(4)CH4
(5)D
(6)NR3沸点较高,易与Ga(CH3)3分离,Et2O的沸点低于Ga(CH3)3,一起气化,难以得到超纯Ga(CH3)3
(7)> Ga(CH3)3中Ga为sp2杂化,所以为平面结构,而Ga(CH3)3(Et2O)中Ga为sp3杂化,所以为四面体结构,故夹角较小
解析:以粗镓为原料,制备超纯Ga(CH3)3,粗Ga经过电解精炼得到纯Ga,Ga和Mg反应生产Ga2Mg5,Ga2Mg5和CH3I、Et2O反应生成Ga(CH3)3(Et2O)、MgI2和CH3MgI,然后经过蒸发溶剂、蒸馏,除去残渣MgI2、CH3MgI,加入NR3进行配体交换、进一步蒸出得到超纯Ga(CH3)3,Et2O重复利用。(1)晶体Ga(CH3)3的沸点较低,晶体类型是分子晶体;(2)电解池温度控制在40~45℃可以保证Ga为液体,便于纯Ga流出;粗Ga在阳极失去电子,阴极得到Ga,电极反应式为Ga3++3eˉ=Ga;(3)“合成Ga(CH3)3(Et2O)”工序中的产物还包括MgI2和CH3MgI,该反应的化学方程式8CH3I+2Et2O+Ga2Mg5===2Ga(CH3)3(Et2O)+3 MgI2+2CH3MgI;(4)“残渣”含CH3MgI,经纯水处理,能产生可燃性气体CH4;(5)A项,流程中Et2O得到了循环利用,A正确;B项, Ga(CH3)3(Et2O)容易和水反应,容易被氧化,则流程中,“合成Ga2Mg5”至“工序X”需在无水无氧的条件下进行,B正确;C项, “配体交换”得到Ga(CH3)3(NR3),“工序X”先解配Ga(CH3)3(NR3)后蒸出Ga(CH3)3,C正确;D项,二者甲基的环境不同,核磁共振氢谱化学位移不同,用核磁共振氢谱能区分Ga(CH3)3和CH3I,D错误;故选D;(6)直接分解Ga(CH3)3(Et2O)时由于Et2O的沸点较低,与Ga(CH3)3一起蒸出,不能制备超纯Ga(CH3)3,而本流程采用“配体交换”工艺制备超纯Ga(CH3)3的理由是,根据题给相关物质沸点可知,NR3沸点远高于Ga(CH3)3,与Ga(CH3)3易分离;(7)分子中的C-Ga-C键角Ga(CH3)3> Ga(CH3)3(Et2O),其原因是Ga(CH3)3中Ga为sp2杂化,所以为平面结构,而Ga(CH3)3(Et2O)中Ga为sp3杂化,所以为四面体结构,故夹角较小。
8.(1)6 +1
(2)Cu2O+H2O2+2H2SO4==2CuSO4+3H2O
(3)4.7 蓝色沉淀溶解,溶液变为深蓝色 2.0×10-6
(4)HCl溶液、BaCl2溶液 溶剂
(5)GaCl3+NH3GaN+3HCl
解析:⑴Se与S同主族,故其最外层有6个电子。Se为VIA组元素,化合价为—2,Ga与In同为IIIA组元素,化合价均为+3,根据化合价规则可求得Cu的化合价为+1; ⑵该化合物中Ga和In元素均处于最高价态,高温焙烧时Se元素转化为SeO2,则酸浸氧化时H2O2氧化+1价的Cu,高温焙烧时Cu转化为更为稳定的Cu2O,故酸浸氧化时发生的主要氧化还原反应为:Cu2O+H2O2+2H2SO4==2CuSO4+3H2O; ⑶根据Ksp[In(OH)3]=c(In3+)·c3(OH—)可求得当In3+完全沉淀时溶液的c(OH—)=1.0×10—(28/3),进而求得pH=4.7.若继续加入6.0mol/L氨水至过量,先生成蓝色Cu(OH)2沉淀,然后蓝色沉淀溶解,得到深蓝色溶液Cu(NH3)42+。将Ga(OH)3(s)Ga3+(aq)+3OH—(aq)、Ga3++3OH—[Ga(OH)4]—、NH3·H2ONH4++OH—三个反应叠加可以得到Ga(OH)3(s)+NH3·H2O[Ga(OH)4]—+NH4+,则该平衡常数K=Ksp[Ga(OH)3]·K′·Kb=1.0×10—35×1.0×1034×2.0×10—5=2.0×10—6; ⑷加氨水的目的是沉淀溶液中的Ga3+、In3+,得到的滤液I主要含有(NH4)2SO4、Cu(NH3)4SO4,检验滤渣中SO是否洗净,可加入盐酸酸化的BaCl2溶液。SOCl2与体系中少许的H2O生成HCl和SO2,故能将氢氧化物转化为氯化物,同时将滤渣进行分散,让反应得以充分进行,故作溶剂作用;⑸高温气相沉积时GaCl3和NH3反应生成GaN,同时得到HCl:GaCl3+NH3GaN+3HCl。
9.(1)H2O+H++GaOGa(OH)3Ga3++3OH-
(2)增大固液接触面积,提高碱浸速率
(3)GaAs+4OH-+4H2O2===GaO+AsO+6H2O
(4)Ga3++3e-===Ga
(5)蒸发浓缩(或加热浓缩) 低温干燥
解析:
10.(1)ad
(2)共价晶体
(3)ZnFe2O4+4H2SO4===ZnSO4+Fe2(SO4)3+4H2O
(4)5.3
(5)硫氰化钾
(6)2H2O-4e-+4CO=O2↑+4HCO
解析:(1)为提高浸出率,可采取的措施有粉碎矿渣,延长浸出时间,故选ad;
(2)金刚石为共价晶体,GaN晶胞结构与金刚石结构类似,则该种GaN晶体的类型为共价晶体;Ga为31号元素,则基态Ga原子价层电子的轨道表示式为;
(3)根据化合物中各元素化合价代数和为0可知,铁元素的化合价为+3价,ZnFe2O4与稀硫酸反应生成硫酸锌、硫酸铁和水,反应的化学方程式为ZnFe2O4+4H2SO4===ZnSO4+Fe2(SO4)3+4H2O;
(4)调节pH,沉淀铁离子和Ga3+,滤液1中含有锌离子,,c(OH-)=mol/L,c(H+)=5×10-6,pH=6-lg5=5.3,则“调pH”时需调节溶液pH的最小值为5.3;
(5)Fe3+遇到硫氰根离子显红色,则检验“滤液1”中是否含有Fe3+的试剂为硫氰化钾;
(6)由图可知,阳极水失去电子生成氧气同时生成碳酸氢根离子,则阳极的电极反应式为:2H2O-4e-+4CO=O2↑+4HCO;
11.(1)Zn2+和Al3+
(2)用75%的硫酸会使SnO2溶解,达不到与ZnO、Fe2O3分离的目的
(3)+3
(4)BiCl3+4NaOH+NaClO===NaBiO3↓+4NaCl+2H2O
(5)盐酸 选择性除去锡离子,提纯铟离子,后续可以得到高纯度的铟产品 AB
(6) ×100%
解析:(1)由分析可知,滤液1中的阳离子有Fe3+和Zn2+;
(2)由题给已知SnO2 不溶于稀硫酸,若用75%的硫酸则使SnO2溶解,达不到与ZnO、Fe2O3分离的目的;
(3)“酸溶”生成的(BiO)2SO4中,Bi元素的化合价为+3价;
(4)“转化2”时发生反应为氯化铋与氢氧化钠、次氯酸钠转化为NaBiO3,反应化学方程式为:BiCl3+4NaOH+NaClO===NaBiO3↓+4NaCl+2H2O;
(5)①要使萃取平衡逆向移动且不能引入新的阴离子,则实际X为盐酸;②“萃取”和“反萃取”的目的是:选择性除去锡离子,提纯铟离子,后续可以得到高纯度的铟产品;③A.先将铟转化为沉淀再加盐酸溶解,可以起到富集铟的作用,提高InCl3溶液的浓度,A正确 B.纯碱也可以沉淀铟,所以可以用烧碱溶液代替纯碱溶液,B正确;C.该过程涉及到过滤,不需要用到分液漏斗,C错误;故选AB。
(6)Bi的质量为 g,则高铟烟灰中Bi的百分含量为 ×100%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
