专题十一 第十四讲 过渡金属——钒及其化合物(含解析)2026届高中化学大一轮复习讲义
文档属性
| 名称 | 专题十一 第十四讲 过渡金属——钒及其化合物(含解析)2026届高中化学大一轮复习讲义 |  | |
| 格式 | doc | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-28 22:04:56 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
钒及其化合物
【核心知识梳理】
1.钒的原子结构——23V
电子排布式 1s22s22p63s23p63d34s2
简化电子排布式 [Ar]3d34s2
电子排布图(轨道表示式)
价层电子排布式 3d34s2
周期表中的位置 第四周期第ⅤB族
常见化合价 +3、+4、+5
2.钒(V)
(1)物理性质:银白色金属,熔点高,有延展性,质坚硬,无磁性
(2)化学性质:常温下不活泼,在空气中不被氧化,不能与除HF以外的非氧化性酸及碱发生作用,能溶于浓硫酸、硝酸等氧化性酸溶液中
3.五氧化二钒(V2O5)
(1)五氧化二钒既能溶于强碱,又能溶于强酸,属于两性氧化物,但以酸性为主
V2O5+6NaOH===2Na3VO4+3H2O
V2O5+H2SO4===(VO2)2SO4+H2O
(2)V2O5中V的化合价为+5,有较强的氧化性:V2O5+6HCl(浓)===2VOCl2+Cl2+3H2O
(3)1 800 ℃发生分解反应:2V2O52V2O4+O2↑
4.钒的氧化物:钒能分别以+2、+3、+4、+5价与氧结合,形成四种氧化物:一氧化钒、三氧化二钒、二氧化钒、五氧化二钒
5.VO2+、VO:在酸性介质中,VO具有强氧化性
VO+Fe2++2H+===VO2++Fe3++H2O
2VO+H2C2O4+2H+===2VO2++2CO2↑+2H2O
6.钒盐
五价钒盐包括VO(偏钒酸盐)、VO(正钒酸盐),如:偏钒酸铵、偏钒酸钠、偏钒酸钾、正钒酸钠;四价钒盐:硫酸氧钒、草酸氧钒。不同价态的钒离子有不同的颜色:VO颜色为浅黄色,VO2+颜色为蓝色,V3+为绿色,V2+为紫色
7.钒酸盐
偏钒酸盐(NH4VO3)、正钒酸盐(Na3VO4)等在加热条件下不稳定,2NH4VO3V2O5+2NH3↑+H2O
【巩固练习】
1.钒是一种熔点高、硬度大、无磁性的金属,广泛应用于钢铁、航空航天、能源等领域。工业上利用冶炼铝生成的固体废料——赤泥(主要成分为Fe2O3、Al2O3、V2O5及少量稀土金属氧化物)提取金属钒,其工艺流程图如下,下列说法正确的是( )
已知:钒有多种价态,其中+5价最稳定。钒在溶液中主要以VO和VO的形式存在,且存在平衡VO+H2OVO+2H+
A.工业生产中,碱浸步骤可选用较为廉价的氨水
B.可以推测VO2Cl溶解度大于NH4VO3
C.焙烧非磁性产品所得的固体产物加酸溶解时,应加入过量盐酸使其溶解完全
D.将磁性产品加入稀硝酸溶解,取上层清液再加入KSCN溶液后未见红色,则磁性产品中一定不含铁元素
2.钒元素在酸性溶液中有多种存在形式,其中VO2+为蓝色,VO为淡黄色,VO具有较强的氧化性,Fe2+、SO等能把VO还原为VO2+。向VOSO4溶液中滴加酸性KMnO4溶液,溶液颜色由蓝色变为淡黄色。下列说法不正确的是( )
A.在酸性溶液中氧化性:MnO>VO
B.FeI2溶液与足量酸性(VO2)2SO4溶液发生反应的离子方程式:Fe2++VO+2H+===Fe3++VO2++H2O
C.向VOSO4溶液中滴加酸性KMnO4溶液反应的化学方程式为10VOSO4+2H2O+2KMnO4===5(VO2)2SO4+2MnSO4+2H2SO4+K2SO4
D.向含1 mol VO的酸性溶液中滴加1.25 mol FeSO4的溶液完全反应,转移电子为1 mol
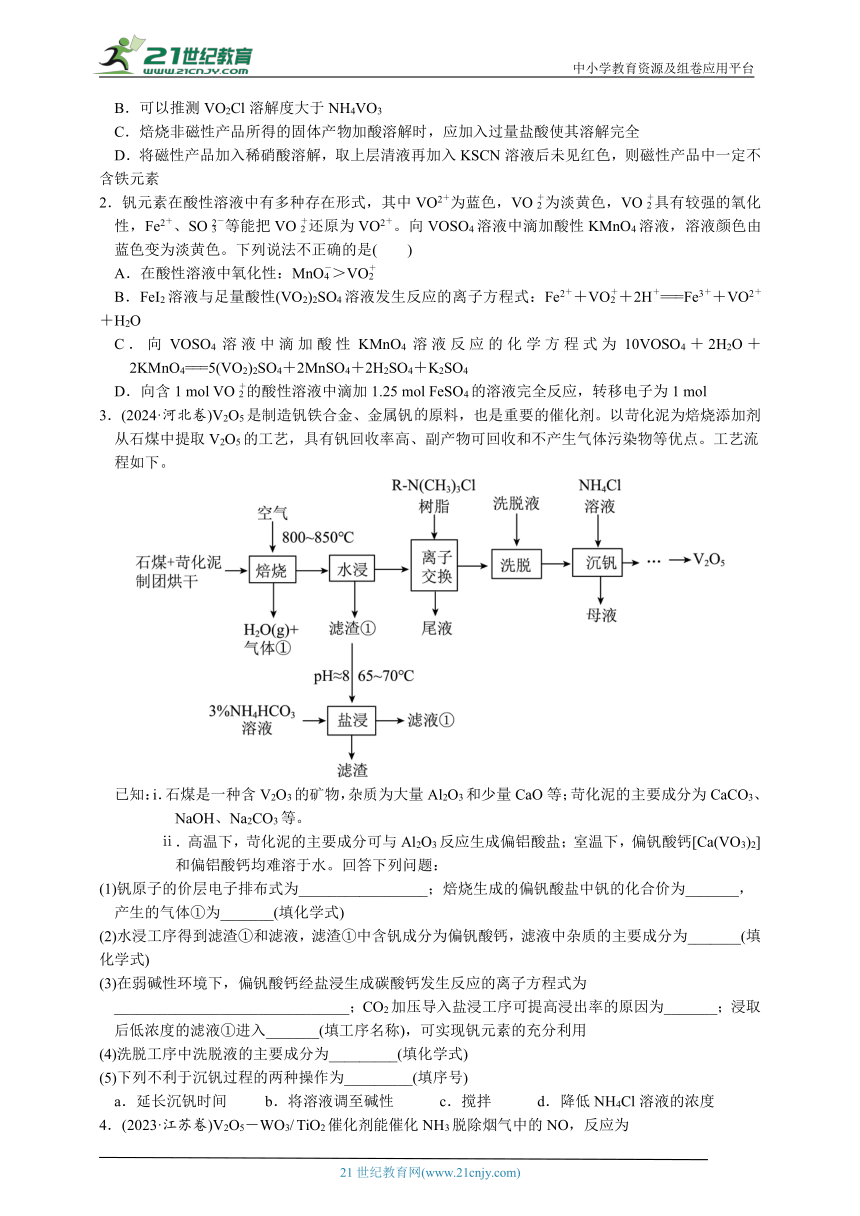
3.(2024·河北卷)V2O5是制造钒铁合金、金属钒原料,也是重要的催化剂。以苛化泥为焙烧添加剂从石煤中提取V2O5的工艺,具有钒回收率高、副产物可回收和不产生气体污染物等优点。工艺流程如下。
已知:i.石煤是一种含V2O3的矿物,杂质为大量Al2O3和少量CaO等;苛化泥的主要成分为CaCO3、NaOH、Na2CO3等。
ⅱ.高温下,苛化泥的主要成分可与Al2O3反应生成偏铝酸盐;室温下,偏钒酸钙[Ca(VO3)2]和偏铝酸钙均难溶于水。回答下列问题:
(1)钒原子的价层电子排布式为_________________;焙烧生成的偏钒酸盐中钒的化合价为_______,产生的气体①为_______(填化学式)
(2)水浸工序得到滤渣①和滤液,滤渣①中含钒成分为偏钒酸钙,滤液中杂质的主要成分为_______(填化学式)
(3)在弱碱性环境下,偏钒酸钙经盐浸生成碳酸钙发生反应的离子方程式为_______________________________;CO2加压导入盐浸工序可提高浸出率的原因为_______;浸取后低浓度的滤液①进入_______(填工序名称),可实现钒元素的充分利用
(4)洗脱工序中洗脱液的主要成分为_________(填化学式)
(5)下列不利于沉钒过程的两种操作为_________(填序号)
a.延长沉钒时间 b.将溶液调至碱性 c.搅拌 d.降低NH4Cl溶液的浓度
4.(2023·江苏卷)V2O5-WO3/ TiO2催化剂能催化NH3脱除烟气中的NO,反应为
4NH3(g)+O2(g)+4NO(g)===4N2(g)+6H2O(g) H=-1632.4kJ·mol-1
(1)催化剂的制备。将预先制备的一定量的WO3/ TiO2粉末置于80℃的水中,在搅拌下加入一定量的NH4VO3溶液,经蒸发、焙烧等工序得到颗粒状V2O5-WO3/ TiO2催化剂。在水溶液中VO水解为H3VO4沉淀的离子方程式为_____________________;反应选用NH4VO3溶液而不选用NaVO3溶液的原因是__________________
(2)催化剂的应用。将一定物质的量浓度的NO、O2、NH3(其余为N2)气体匀速通过装有V2O5-WO3/ TiO2催化剂
的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在320~360℃范围内,NO转化率随温度变化不明显的原因是____________________________________;反应温度高于380℃,NO转化率下降,除因为进入反应器的NO被还原的量减少外,还有____________________________________(用化学方程式表示)
(3)废催化剂的回收。回收V2O5-WO3/ TiO2废催化剂并制备NH4VO3的过程可表示为
①酸浸时,加料完成后,以一定速率搅拌反应。提高钒元素浸出率的方法还有___________
②通过萃取可分离钒和钨,在得到的钒酸中含有H4V4O12。已知H4V4O12具有八元环结构,其结构式可表示为___________
③向pH=8的NaVO3溶液中加入过量的NH4Cl溶液,生成NH4VO3沉淀。已知:Ksp(NH4VO3)=1.7×10-3,加过量NH4Cl溶液的目的是___________
5.(2020 全国卷Ⅰ)钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿制备NH4VO3。回答下列问题:
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 Fe3+ Fe2+ Al3+ Mn2+
开始沉淀pH 1.9 7.0 3.0 8.1
完全沉淀pH 3.2 9.0 4.7 10.1
(1)“酸浸氧化”需要加热,其原因是______________________________________________
(2)“酸浸氧化”中,VO+和VO2+被氧化成VO,同时还有________离子被氧化。写出VO+转化为VO反应的离子方程式____________________________________________________
(3)“中和沉淀”中,钒水解并沉淀为V2O5· xH2O,随滤液②可除去金属离子K+、Mg2+、Na+、________,以及部分的________
(4)“沉淀转溶”中,V2O5· xH2O转化为钒酸盐溶解。滤渣③的主要成分是______________
(5)“调pH”中有沉淀产生,生成沉淀反应的化学方程式是____________________________
(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是____________________
6.(2016·全国III卷)以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 V2O5 V2O4 K2SO4 SiO2 Fe2O3 Al2O3
质量分数/% 2.2~2.9 2.8~3.1 22~28 60~65 1~2 <1
以下是一种废钒催化剂回收工艺路线:
回答下列问题:
(1)“酸浸”时V2O5转化为VO,反应的离子方程式为____________,同时V2O4转化成VO2+。“废渣1”的主要成分是________
(2)“氧化”中欲使3 mol的VO2+变为VO,则需要氧化剂KClO3至少为________mol
(3)“中和”作用之一是使钒以V4O形式存在于溶液中。“废渣2”中含有________
(4)“离子交换”和“洗脱”可简单表示为:4ROH+V4OR4V4O12+4OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈________性(填“酸”、“碱”或“中”)
(5)“流出液”中阳离子最多的是________
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式__________________________
7.氧钒(Ⅳ)碱式碳酸铵晶体的化学式为(NH4)5[(VO)6(CO3)4(OH)9]·10H2O,实验室以V2O5为原料制备该晶体的流程如图所示:
(1)N2H4的电子式是__________,若“还原”过程中其他产物均绿色环保,写出该过程中发生反应的化学方程式:_____________________________________________________________
(2)“转化”可在如图所示装置中进行(已知VO2+能被O2氧化)
①仪器M的名称是__________。使装置A中制气反应停止的操作是_____________________。
②在装置C中VOCl2转化为产品,实验操作的顺序为打开活塞a→______→______→_____(填序号)。
Ⅰ.取下P(如图所示),在锥形瓶口塞上无孔橡胶塞
Ⅱ.将锥形瓶置于干燥器中,静置后抽滤
Ⅲ.打开旋塞b,加入VOCl2溶液,持续搅拌一段时间,使反应完全
(3)“转化”后得到紫红色晶体,抽滤,并用饱和NH4HCO3溶液洗涤3次,用无水乙醇洗涤2次,再用无水乙醚洗涤2次,抽干。用饱和NH4HCO3溶液洗涤除去的阴离子主要是__________(填离子符号),用无水乙醚洗涤的目的是__________
(4)称取m g产品于锥形瓶中,先将产品中的钒元素转化为VO,消除其他干扰,再用c mol·L-1
(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为V mL(已知滴定反应为
VO+Fe2++2H+===VO2++Fe3++H2O),则产品中钒元素的质量分数为__________(列出计算式即可)
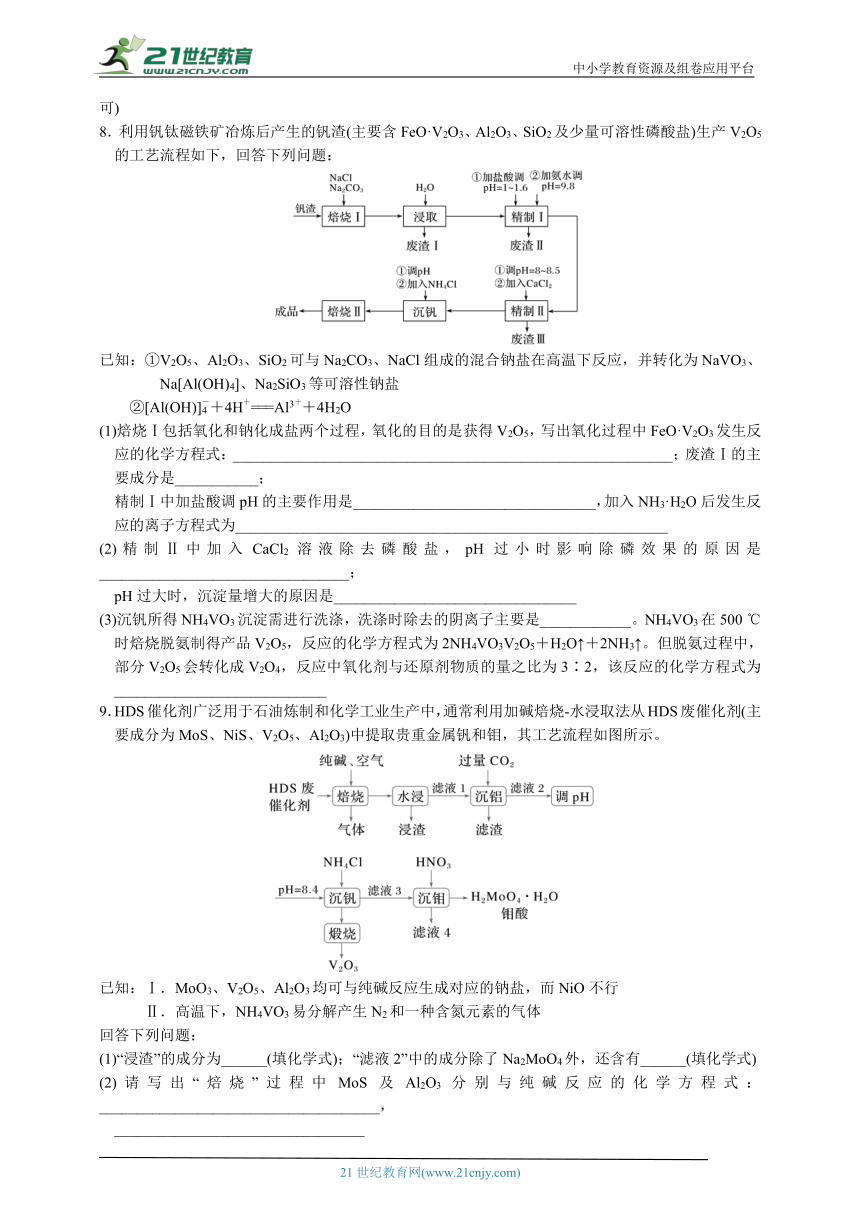
8.利用钒钛磁铁矿冶炼后产生的钒渣(主要含FeO·V2O3、Al2O3、SiO2及少量可溶性磷酸盐)生产V2O5的工艺流程如下,回答下列问题:
已知:①V2O5、Al2O3、SiO2可与Na2CO3、NaCl组成的混合钠盐在高温下反应,并转化为NaVO3、Na[Al(OH)4]、Na2SiO3等可溶性钠盐
②[Al(OH)]+4H+===Al3++4H2O
(1)焙烧Ⅰ包括氧化和钠化成盐两个过程,氧化的目的是获得V2O5,写出氧化过程中FeO·V2O3发生反应的化学方程式:__________________________________________________________;废渣Ⅰ的主要成分是___________;
精制Ⅰ中加盐酸调pH的主要作用是________________________________,加入NH3·H2O后发生反应的离子方程式为_________________________________________________________
(2)精制Ⅱ中加入CaCl2溶液除去磷酸盐,pH过小时影响除磷效果的原因是_________________________________;
pH过大时,沉淀量增大的原因是________________________________
(3)沉钒所得NH4VO3沉淀需进行洗涤,洗涤时除去的阴离子主要是____________。NH4VO3在500 ℃时焙烧脱氨制得产品V2O5,反应的化学方程式为2NH4VO3V2O5+H2O↑+2NH3↑。但脱氨过程中,部分V2O5会转化成V2O4,反应中氧化剂与还原剂物质的量之比为3∶2,该反应的化学方程式为____________________________
9.HDS催化剂广泛用于石油炼制和化学工业生产中,通常利用加碱焙烧-水浸取法从HDS废催化剂(主要成分为MoS、NiS、V2O5、Al2O3)中提取贵重金属钒和钼,其工艺流程如图所示。
已知:Ⅰ.MoO3、V2O5、Al2O3均可与纯碱反应生成对应的钠盐,而NiO不行
Ⅱ.高温下,NH4VO3易分解产生N2和一种含氮元素的气体
回答下列问题:
(1)“浸渣”的成分为______(填化学式);“滤液2”中的成分除了Na2MoO4外,还含有______(填化学式)
(2)请写出“焙烧”过程中MoS及Al2O3分别与纯碱反应的化学方程式:_____________________________________,
_________________________________
(3)“沉钒”时提钒率随初始钒的浓度及氯化铵的加入量的关系如图所示,则选择的初始钒的浓度和NH4Cl的加入量分别为_________、_______________
(4)“沉钒”时生成NH4VO3沉淀,则“煅烧”后生成氧化产物和还原产物的物质的量之比为________________。
10.五氧化二钒广泛用于冶金、化工等行业,主要用于冶炼钒铁、用作冶金添加剂,占五氧化二钒总消耗量的80%以上,其次是用作有机化工的催化剂。为了增加V2O5的利用率我们从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2和Fe2O3等)中回收V2O5的一种生产工艺流程示意图如下:
(1)①中废渣的主要成分是______________________________
①中V2O5发生反应的离子方程式为______________________
(2)②、③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):
R2(SO4) (水层)+2nHA(有机层)2RAn(有机层)+nH2SO4(水层)
②中萃取时必须加入适量碱,其原因是___________________________________________;实验室进行萃取操作使用的玻璃仪器为________________________
(3)实验室用的原料中V2O5占6%(原料中的所有钒已换算成V2O5)。取100 g该废钒催化剂按工业生产的步骤进行实验当加入100 mL 0.1 mol·L-1的KClO3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该实验中钒的回收率是________[M(V2O5)=182 g/mol]
(4)25 ℃时取样进行试验分析,得到钒沉淀率和溶液pH之间的关系如下表:
pH 1.3 1.4 1.5 1.6 1.7 1.8 1.9 2.0
钒沉淀率/% 88.1 94.8 96.5 98.0 98.8 98.6 96.4 93.1
试判断在实际生产时,⑤中加入氨水调节溶液的最佳pH为________;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则此时溶液中c(Fe2+)≤________。已知:25 ℃时Ksp[Fe(OH)3]=2.6×10-39
11.五氧化二钒(V2O5)在冶金、催化剂、磁性材料等领域有重要作用。实验室以含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、有机化合物等)来制备V2O5的一种工艺流程如下:
已知:含钒离子在溶液中的主要存在形式与溶液pH的关系:
溶液pH <4.0 6.0~8.0 8.0~10.0
钒元素主要存在形式 VO VO V2O
请回答下列问题:
(1)含钒废料中的有机化合物主要在___________工序中除去
(2)“焙烧”产物之一是Mg(VO3)2,写出它在“酸浸”(溶液pH<2)过程中发生反应的化学方程式_______________________________________
(3)常温时,若“调pH净化Ⅰ”工序中最终溶液pH=7,通过计算判断,此时Cu2+是否已经沉淀完全{已知离子浓度<1.0×10-5 mol·L-1认为沉淀完全;Ksp[Cu(OH)2]=2.2×10-20}__________________________________
(4)“净化Ⅱ”时若加入过量的(NH4)2CO3,可能导致的后果为___________________
(5)“滤渣2”中含有Mg2(OH)2CO3,写出生成Mg2(OH)2CO3的离子方程式______________________
(6)“煅烧”时,除生成V2O5外,还生成了参与大气循环的气体,写出煅烧时的化学方程式_________________
【钒及其化合物】答案
1.B。解析:赤泥进行碱浸,氧化铝溶解生成偏铝酸盐,再通入二氧化碳得到氢氧化铝沉淀;滤渣1经系列操作得到V2O5,可知滤渣1中含有Fe2O3、V2O5及少量稀土金属氧化物,进行还原、磁选,磁性产品中含有Fe等,非磁性产品含有V元素,在空气中焙烧后用盐酸溶解,钒在溶液中主要以VO和VO的形式存在,再加入氯化铵转化为NH4VO3,焙烧得到V2O5。氨水不能溶解氧化铝,故A错误;用盐酸溶解后的溶液中含有VO、VO、Cl-,加入氯化铵会生成NH4VO3沉淀,反应向生成更难溶的物质进行,可以推测VO2Cl溶解度大于NH4VO3,故B正确;溶液中存在平衡VO+H2OVO+2H+,盐酸过量平衡逆向移动,会抑制NH4VO3的生成,不能加入过量的盐酸,故C错误;加入的硝酸不足,Fe元素被硝酸氧化可能生成亚铁离子,亚铁离子遇KSCN溶液无明显现象,故D错误。
2.B。解析:向VOSO4溶液中滴加酸性KMnO4溶液,溶液颜色由蓝色变为淡黄色,说明MnO将VO2+氧化为VO,从而得出氧化性:MnO>VO,故A正确;碘离子的还原性强于亚铁离子且加入足量酸性(VO2)2SO4溶液,碘离子应参与氧化还原反应,故B错误;向含1 mol VO的酸性溶液中滴加含1.25 mol Fe2+的溶液发生反应:Fe2++VO+2H+===Fe3++VO2++H2O,则VO的量不足,所以转移电子为1 mol,故D正确。
3.(1)3d34s2 +5 CO2
(2)NaAlO2
(3)HCO+OH-+Ca(VO3)2CaCO3+H2O+2VO
提高溶液中浓度,促使偏钒酸钙转化为碳酸钙,释放VO 离子交换
(4)NaCl
(5)bd
解析:石煤和苛化泥通入空气进行焙烧,反应生成NaVO3、Ca(VO3)2、NaAlO2、Ca(AlO2)2、CaO和 CO2等,水浸可分离焙烧后的可溶性物质(如NaVO3)和不溶性物质[Ca(VO3)2、Ca(AlO2)2等],过滤后滤液进行离子交换、洗脱,用于富集和提纯VO,加入氯化铵溶液沉钒,生成NH4VO3,经一系列处理后得到V2O3;滤渣①在pH≈8,65~70℃的条件下加入3% NH4HCO3溶液进行盐浸,滤渣①中含有钒元素,通过盐浸,使滤渣①中的钒元素进入滤液①中,再将滤液①回流到离子交换工序,进行VO的富集。
(1)钒是23号元素,其价层电子排布式为3d34s2;焙烧过程中,氧气被还原,V2O3被氧化生成VO,偏钒酸盐中钒的化合价为+5价;CaCO3在800℃以上开始分解,生成的气体①为CO2。
(2)由已知信息可知,高温下,苛化泥的主要成分与Al2O3反应生成偏铝酸钠和偏铝酸钙,偏铝酸钠溶于水,偏铝酸钙难溶于水,所以滤液中杂质的主要成分是NaAlO2。
(3)在弱碱性环境下,Ca(VO3)2与HCO和OH-反应生成CaCO3、VO和H2O,离子方程式为:
HCO+OH-+Ca(VO3)2CaCO3+H2O+2VO; CO2加压导入盐浸工序可提高浸出率,因为C可提高溶液中HCO浓度,促使偏钒酸钙转化为碳酸钙,释放VO;滤液①中含有VO、NH等,且浓度较低,若要利用其中的钒元素,需要通过离子交换进行分离、富集,故滤液①应进入离子交换工序。
(4)由离子交换工序中树脂的组成可知,洗脱液中应含有Cl-,考虑到水浸所得溶液中含有Na+,为避免引人其他杂质离子,且NaCl廉价易得,故洗脱液的主要成分应为NaCl。
(5)a.延长沉钒时间,能使反应更加完全,有利于沉钒,a不符合题意;b.NH4Cl呈弱酸性,如果将溶液调至碱性,OH-与NH反应,不利于生成NH4VO3,b符合题意;c.搅拌能使反应物更好接触,提高反应速率,使反应更加充分,有利于沉钒,c不符合题意;d.降低NH4Cl溶液的浓度,不利于生成NH4VO3,d符合题意;故选bd。
4.(1)VO+2H2OH3VO4↓+OH-
NH4VO3发生双水解VO+NH+H2OH3VO4↓+NH3,NH有利于VO水解
(2)此温度范围内,催化剂活性已达最佳,对反应速率影响不明显,故NO转化率基本不变
NH3+5O24NO+6H2O N2+O22NO
(3)①适当增加酸的浓度、升高温度、延长酸浸时间等
②
③增加铵根离子浓度,促进平衡向析出沉淀的方向移动,提高NH4VO3的含量
解析:(1)在水溶液中VO水解为H3VO4沉淀的离子方程式为VO+2H2OH3VO4↓+OH-,反应选用NH4VO3溶液在于NH4VO3发生双水解VO+NH+H2OH3VO4↓+NH3,NH有利于VO水解。
(2)反应温度在320~360℃范围内,NO转化率随温度变化不明显的原因是此温度范围内,催化剂活性已达最佳,对反应速率影响不明显,故NO转化率基本不变。反应温度高于380℃,NO转化率下降,有可能体系产生了NO,如NH3+5O24NO+6H2O N2+O22NO等。
(3)提高钒元素浸出率的方法还有适当增加酸的浓度、升高温度、延长酸浸时间等,已知H4V4O12具有八元环结构,且V连有五根共价键,结构式可表示为。NH4VO3饱和溶液中存在溶解平衡NH4VO3(s)NH(aq)+VO(aq),加过量NH4Cl溶液有利于增加铵根离子浓度,促进平衡向析出沉淀的方向移动,提高NH4VO3的含量。
5.(1)加快酸浸氧化反应速率(促进氧化完全)
(2) Fe2+ VO++MnO2+2H+===VO+Mn2++H2O
(3) Mn2+ Fe3+、Al3+
(4)Fe(OH)3
(5)NaAlO2+HCl+H2O===NaCl+Al(OH)3↓
(6)利用同离子效应,促进NH4VO3尽可能析出完全
解析:(1)“酸浸氧化”过程中钒矿粉、MnO2和30% H2SO4发生反应,常温下反应速率较小,加热的目的是加快酸浸氧化反应速率。
(2)Fe3O4与稀硫酸反应:Fe3O4+8H+===2Fe3++Fe2++4H2O,“酸浸氧化”过程中,Fe2+具有还原性,也能被MnO2氧化生成Fe3+。VO+被氧化为VO,MnO2则被还原为Mn2+,溶液呈酸性,结合守恒规律,写出离子方程式:VO++MnO2+2H+===VO+Mn2++H2O。
(3)由表中数据可知,Mn2+开始沉淀的pH为8.1,Al3+开始沉淀的pH为3.0,沉淀完全的pH为4.7,Fe3+沉淀完全的pH为3.2。“中和沉淀”中调节pH=3.0~3.1,钒水解并沉淀为V2O5·xH2O,此时Mn2+不沉淀,Al3+部分沉淀,Fe3+几乎沉淀完全,故随滤液②除去的金属离子有K+、Mg2+、Na+、Mn2+及部分Al3+、Fe3+。
(4)滤饼②中含V2O5·xH2O、Fe(OH)3和少量Al(OH)3,“沉淀转溶”中,加入NaOH溶液,调节pH>13,V2O5·xH2O转化为钒酸盐溶解,Al(OH)3转化为NaAlO2,故滤渣③的主要成分是Fe(OH)3。
(5)滤液③中含有NaAlO2、NaVO3,“调pH”中加入HCl,调节pH=8.5,此时NaAlO2+HCl+H2O===Al(OH)3↓+NaCl。
(6)NH4VO3存在沉淀溶解平衡:NH4VO3(s)NH(aq)+VO(aq),“沉钒”中加入过量NH4Cl,增大c(NH),有利于NH4VO3结晶析出(同离子效应的应用)。
6.(1)V2O2+2H+===2VO+H2O SiO2
(2)0.5 (3)Fe(OH)3和Al(OH)3
(4)碱
(5)K+
(6)2NH4VO3V2O5+H2O+2NH3↑
解析:(1)“酸浸”时V2O5转化为VO,V2O5、VO中V元素均显+5价,V元素化合价不变,则该反应是非氧化还原反应,结合溶液的酸碱性及元素守恒写出离子方程式:V2O5+2H+===2VO+H2O。废钒催化剂中除SiO2外,其余物质均与稀硫酸反应生成易溶于水的盐,则“废渣1”的主要成分是二氧化硅。(2)“氧化”中使3 mol的VO2+变为VO,转移电子的物质的量为3 mol×(5-4)=3 mol;氧化剂KClO3被还原为KCl,Cl元素由+5价降低到-1价,根据电子守恒可知,需要KClO3的物质的量至少为=0.5 mol。(3)由图可知,加入KOH中和后产生废渣2,而“中和”作用之一是使钒以V4O形式存在于溶液中,后续操作中未进行除杂操作,显然该过程中还生成Fe(OH)3和Al(OH)3沉淀,从而除去Fe3+、Al3+,故“废渣2”中含有Fe(OH)3和Al(OH)3。(4)“离子交换”和“洗脱”可简单表示为4ROH+V4OR4V4O12+4OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,应增加溶液中c(OH-),使平衡逆向移动,故淋洗液应该呈碱性。(5)“氧化”和“中和”操作中分别加入KClO3、KOH,而“离子交换”过程中,消耗V4O同时生成OH-,而阳离子未参与离子交换,故“流出液”中阳离子最多的是K+。(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,“煅烧”过程中生成V2O5,考虑铵盐的不稳定性,还应生成NH3和H2O,结合元素守恒写出化学方程式:2NH4VO3V2O5+H2O+2NH3↑。
7.(1) 2V2O5+N2H4+8HCl4VOCl2+N2↑+6H2O
(2)①分液漏斗 关闭旋塞a ②Ⅲ Ⅰ Ⅱ
(3)Cl- 除去晶体表面的乙醇
(4)×100%
解析:(2)②VO2+能被O2氧化,先打开旋塞a,通入一段时间CO2排尽装置中的空气,然后再打开旋塞b,加入VOCl2溶液,持续搅拌一段时间,使反应完全。为防止空气进入,反应结束后取下P,在锥形瓶口塞上无孔橡胶塞,然后在干燥器中静置后抽滤。(3)用饱和NH4HCO3溶液洗涤可除去产物表面的Cl-,用无水乙醇洗涤除去产物表面的水,用无水乙醚(更易挥发)洗涤除去产物表面残留的乙醇。(4)由滴定反应可得关系式V~VO~Fe2+~(NH4)2Fe(SO4)2,n(V)=cV×10-3mol,故产品中钒元素的质量分数为×100%。
8.(1)4FeO·V2O3+5O22Fe2O3+4V2O5 Fe2O3 除Si并将[Al(OH)]转化为Al3+
Al3+ +3NH3·H2O===Al(OH)3↓+3NH、H++NH3·H2O===H2O+NH
(2)形成溶解度较大的酸式盐(或形成溶解度较大的磷酸氢钙或磷酸二氢钙) 产生了Ca(OH)2沉淀
(3)Cl- 3V2O5+2NH33V2O4+N2+3H2O
解析:(1)氧化过程FeO·V2O3生成对应的金属氧化物Fe2O3和V2O5,化学方程式为4FeO·V2O3+5O22Fe2O3+4V2O5;经过氧化和钠化后,V2O5、Al2O3、SiO2均转化为可溶性盐,Fe2O3成为滤渣;精制Ⅰ中加盐酸调pH是为了和SiO反应生成硅酸沉淀,并将[Al(OH)]转化为Al3+;加入NH3·H2O后与Al3+发生反应生成Al(OH)3沉淀,还可以中和酸,反应的化学方程式为Al3++3NH3·H2O===Al(OH)3↓+3NH、H++NH3·H2O===H2O+NH。
(2)精制Ⅱ中加入CaCl2溶液生成磷酸钙沉淀,除去磷酸盐,pH过小时易形成溶解度较大的酸式盐;pH过大时易形成Ca(OH)2沉淀。
(3)沉钒时加入试剂NH4Cl,因此所得NH4VO3沉淀含有的阴离子主要为Cl-;脱氨过程中,部分V2O5会转化成V2O4,且反应中氧化剂与还原剂物质的量之比为3∶2,则V2O5为氧化剂,NH3为还原剂,还原产物为V2O4,氧化产物为N2,则氧化还原方程式为3V2O5+2NH33V2O4+N2+3H2O。
9.(1)NiO NaVO3、NaHCO3
(2)2MoS+2Na2CO3+5O22Na2MoO4+2CO2+2SO2 Al2O3+Na2CO32NaAlO2+CO2↑
(3)20 g·L-1 10 g·L-1
(4)2∶3
解析:(1)硫化物焙烧时生成氧化物和二氧化硫,由于NiO不能与碳酸钠反应,故“水浸”时以“浸渣”的形式沉淀出来,而MoO3、V2O5、Al2O3与纯碱反应生成Na2MoO4、NaVO3和NaAlO2,通入过量CO2生成沉淀Al(OH)3和NaHCO3,故“滤液2”中的成分除了Na2MoO4外,还含有NaVO3、NaHCO3。(4)由信息和流程及氧化还原反应原理可知,NH4VO3沉淀煅烧时分解产生V2O3、N2和NH3,故反应的化学方程式为6NH4VO33V2O3+2N2↑+2NH3↑+9H2O,氧化产物为N2,还原产物为V2O3,故比值为2∶3。
10.(1)SiO2 V2O5+4H++SO===2VO2++ SO+2H2O
(2)加入碱,中和H2SO4,使平衡正向移动 分液漏斗、烧杯
(3)91.0%
(4)1.7 2.6×10-3 mol/L
解析:(1)上述分析可知滤渣A为SiO2,从流程图可以看出,在酸性条件下,V2O5转化为VO2+,SO能被V2O5氧化生成SO,根据氧化还原反应的规律配平该离子反应方程式为:V2O5+SO+4H+===2VO2++SO+2H2O;(2)反萃取时,分析平衡R2(SO4) (水层)+2nHA(有机层)??2RAn(有机层)+nH2SO4(水层),为提高②中萃取百分率,则加入碱中和硫酸,可以使平衡正移,多次连续萃取。萃取分液操作时,用到的玻璃仪器有分液漏斗和烧杯;(3)根据氧化还原规律可知,当加入100 mL 0.1 mol/L的KClO3溶液时,溶液中的钒恰好被完全处理的离子方程式为:ClO+6VO2++3H2O===6VO+6H++Cl-,再结合V2O5+SO+4H+===2VO2++SO+2H2O,从而得出关系式:3V2O5~6VO2+~ClO,因n(ClO)=0.1 mol/L×0.1 L=0.01 mol,所以n(V2O5)=3×0.01 mol=0.03 mol因此该实验中钒的回收率是×100%=91.0 %;(4)从沉淀率和pH关系找出最佳沉淀率。若钒沉淀率为93.1%时,不产生Fe(OH)3沉淀,此时溶液pH=2,计算氢氧根离子浓度,结合溶度积常数计算溶液中铁离子的浓度。由表中数据可知,pH=1.7时钒的沉淀率最大为98.8%,故加入氨水调节溶液的最佳pH为1.7。若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,此时溶液pH=2,c(OH-)=10-12 mol/L,Ksp[Fe(OH)3]=2.6×10-39=c(Fe3+)c3(OH-),c(Fe3+)==2.6×10-3(mol/L)。
11.(1)焙烧
(2)Mg(VO3)2+2H2SO4===(VO2)2SO4+MgSO4+2H2O
(3)Cu2+沉淀完全,c(Cu2+)== mol·L-1=2.2×10-6mol·L-1<1.0×10-5 mol·L-1
(4)会生成NH4VO3沉淀,降低钒的利用率
(5)2Mg2++3CO+2H2O===Mg2(OH)2CO3↓+2HCO
(6)4NH4VO3+3O22V2O5+8H2O+2N2
解析:含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、有机化合物等)加入足量碳酸镁粉末焙烧,除去有机化合物,并将V2O3氧化为V2O5,之后加入硫酸酸溶,金属元素进入溶液,然后加入适量氨水调节pH可生成氢氧化物除去Fe3+、Cu2+、Al3+,过滤后滤液中含有VO、NH、Mg2+等离子,根据后续产物可知净化Ⅱ加入碳酸铵主要是除去Mg2+,过滤后滤液中再加入足量碳酸铵得到NH4VO3沉淀,空气中煅烧可生成V2O5,以此解答该题。
(1)焙烧过程中有机化合物会被氧化为CO2、H2O等,从而除去有机化合物;(2)溶液pH<2,根据题目所给信息可知酸浸后生成(VO2)2SO4,结合元素守恒可得化学方程式为Mg(VO3)2+2H2SO4===(VO2)2SO4+MgSO4+2H2O;(3)溶液pH=7,则c(OH-)=1.0×10-7 mol·L-1,此时溶液中c(Cu2+)== mol·L-1=2.2×10-6 mol·L-1<1.0×10-5 mol·L-1,所以Cu2+沉淀完全;(4)加入过量的(NH4)2CO3,铵根离子浓度过大,且溶液碱性增强,会生成NH4VO3沉淀,降低钒的利用率;(5)“滤渣2”中含有Mg2(OH)2CO3,说明部分Mg2+和CO发生双水解反应,但由于CO浓度较大,溶液碱性较强,所以CO的水解不彻底,有HCO生成,则离子方程式为2Mg2++3CO+2H2O===Mg2(OH)2CO3↓+2HCO;(6)根据元素守恒,煅烧NH4VO3时产生的参与大气循环的气体应为N2,结合元素守恒和电荷守恒可得化学方程式为4NH4VO3+3O22V2O5+8H2O+2N2。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
钒及其化合物
【核心知识梳理】
1.钒的原子结构——23V
电子排布式 1s22s22p63s23p63d34s2
简化电子排布式 [Ar]3d34s2
电子排布图(轨道表示式)
价层电子排布式 3d34s2
周期表中的位置 第四周期第ⅤB族
常见化合价 +3、+4、+5
2.钒(V)
(1)物理性质:银白色金属,熔点高,有延展性,质坚硬,无磁性
(2)化学性质:常温下不活泼,在空气中不被氧化,不能与除HF以外的非氧化性酸及碱发生作用,能溶于浓硫酸、硝酸等氧化性酸溶液中
3.五氧化二钒(V2O5)
(1)五氧化二钒既能溶于强碱,又能溶于强酸,属于两性氧化物,但以酸性为主
V2O5+6NaOH===2Na3VO4+3H2O
V2O5+H2SO4===(VO2)2SO4+H2O
(2)V2O5中V的化合价为+5,有较强的氧化性:V2O5+6HCl(浓)===2VOCl2+Cl2+3H2O
(3)1 800 ℃发生分解反应:2V2O52V2O4+O2↑
4.钒的氧化物:钒能分别以+2、+3、+4、+5价与氧结合,形成四种氧化物:一氧化钒、三氧化二钒、二氧化钒、五氧化二钒
5.VO2+、VO:在酸性介质中,VO具有强氧化性
VO+Fe2++2H+===VO2++Fe3++H2O
2VO+H2C2O4+2H+===2VO2++2CO2↑+2H2O
6.钒盐
五价钒盐包括VO(偏钒酸盐)、VO(正钒酸盐),如:偏钒酸铵、偏钒酸钠、偏钒酸钾、正钒酸钠;四价钒盐:硫酸氧钒、草酸氧钒。不同价态的钒离子有不同的颜色:VO颜色为浅黄色,VO2+颜色为蓝色,V3+为绿色,V2+为紫色
7.钒酸盐
偏钒酸盐(NH4VO3)、正钒酸盐(Na3VO4)等在加热条件下不稳定,2NH4VO3V2O5+2NH3↑+H2O
【巩固练习】
1.钒是一种熔点高、硬度大、无磁性的金属,广泛应用于钢铁、航空航天、能源等领域。工业上利用冶炼铝生成的固体废料——赤泥(主要成分为Fe2O3、Al2O3、V2O5及少量稀土金属氧化物)提取金属钒,其工艺流程图如下,下列说法正确的是( )
已知:钒有多种价态,其中+5价最稳定。钒在溶液中主要以VO和VO的形式存在,且存在平衡VO+H2OVO+2H+
A.工业生产中,碱浸步骤可选用较为廉价的氨水
B.可以推测VO2Cl溶解度大于NH4VO3
C.焙烧非磁性产品所得的固体产物加酸溶解时,应加入过量盐酸使其溶解完全
D.将磁性产品加入稀硝酸溶解,取上层清液再加入KSCN溶液后未见红色,则磁性产品中一定不含铁元素
2.钒元素在酸性溶液中有多种存在形式,其中VO2+为蓝色,VO为淡黄色,VO具有较强的氧化性,Fe2+、SO等能把VO还原为VO2+。向VOSO4溶液中滴加酸性KMnO4溶液,溶液颜色由蓝色变为淡黄色。下列说法不正确的是( )
A.在酸性溶液中氧化性:MnO>VO
B.FeI2溶液与足量酸性(VO2)2SO4溶液发生反应的离子方程式:Fe2++VO+2H+===Fe3++VO2++H2O
C.向VOSO4溶液中滴加酸性KMnO4溶液反应的化学方程式为10VOSO4+2H2O+2KMnO4===5(VO2)2SO4+2MnSO4+2H2SO4+K2SO4
D.向含1 mol VO的酸性溶液中滴加1.25 mol FeSO4的溶液完全反应,转移电子为1 mol
3.(2024·河北卷)V2O5是制造钒铁合金、金属钒原料,也是重要的催化剂。以苛化泥为焙烧添加剂从石煤中提取V2O5的工艺,具有钒回收率高、副产物可回收和不产生气体污染物等优点。工艺流程如下。
已知:i.石煤是一种含V2O3的矿物,杂质为大量Al2O3和少量CaO等;苛化泥的主要成分为CaCO3、NaOH、Na2CO3等。
ⅱ.高温下,苛化泥的主要成分可与Al2O3反应生成偏铝酸盐;室温下,偏钒酸钙[Ca(VO3)2]和偏铝酸钙均难溶于水。回答下列问题:
(1)钒原子的价层电子排布式为_________________;焙烧生成的偏钒酸盐中钒的化合价为_______,产生的气体①为_______(填化学式)
(2)水浸工序得到滤渣①和滤液,滤渣①中含钒成分为偏钒酸钙,滤液中杂质的主要成分为_______(填化学式)
(3)在弱碱性环境下,偏钒酸钙经盐浸生成碳酸钙发生反应的离子方程式为_______________________________;CO2加压导入盐浸工序可提高浸出率的原因为_______;浸取后低浓度的滤液①进入_______(填工序名称),可实现钒元素的充分利用
(4)洗脱工序中洗脱液的主要成分为_________(填化学式)
(5)下列不利于沉钒过程的两种操作为_________(填序号)
a.延长沉钒时间 b.将溶液调至碱性 c.搅拌 d.降低NH4Cl溶液的浓度
4.(2023·江苏卷)V2O5-WO3/ TiO2催化剂能催化NH3脱除烟气中的NO,反应为
4NH3(g)+O2(g)+4NO(g)===4N2(g)+6H2O(g) H=-1632.4kJ·mol-1
(1)催化剂的制备。将预先制备的一定量的WO3/ TiO2粉末置于80℃的水中,在搅拌下加入一定量的NH4VO3溶液,经蒸发、焙烧等工序得到颗粒状V2O5-WO3/ TiO2催化剂。在水溶液中VO水解为H3VO4沉淀的离子方程式为_____________________;反应选用NH4VO3溶液而不选用NaVO3溶液的原因是__________________
(2)催化剂的应用。将一定物质的量浓度的NO、O2、NH3(其余为N2)气体匀速通过装有V2O5-WO3/ TiO2催化剂
的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在320~360℃范围内,NO转化率随温度变化不明显的原因是____________________________________;反应温度高于380℃,NO转化率下降,除因为进入反应器的NO被还原的量减少外,还有____________________________________(用化学方程式表示)
(3)废催化剂的回收。回收V2O5-WO3/ TiO2废催化剂并制备NH4VO3的过程可表示为
①酸浸时,加料完成后,以一定速率搅拌反应。提高钒元素浸出率的方法还有___________
②通过萃取可分离钒和钨,在得到的钒酸中含有H4V4O12。已知H4V4O12具有八元环结构,其结构式可表示为___________
③向pH=8的NaVO3溶液中加入过量的NH4Cl溶液,生成NH4VO3沉淀。已知:Ksp(NH4VO3)=1.7×10-3,加过量NH4Cl溶液的目的是___________
5.(2020 全国卷Ⅰ)钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿制备NH4VO3。回答下列问题:
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 Fe3+ Fe2+ Al3+ Mn2+
开始沉淀pH 1.9 7.0 3.0 8.1
完全沉淀pH 3.2 9.0 4.7 10.1
(1)“酸浸氧化”需要加热,其原因是______________________________________________
(2)“酸浸氧化”中,VO+和VO2+被氧化成VO,同时还有________离子被氧化。写出VO+转化为VO反应的离子方程式____________________________________________________
(3)“中和沉淀”中,钒水解并沉淀为V2O5· xH2O,随滤液②可除去金属离子K+、Mg2+、Na+、________,以及部分的________
(4)“沉淀转溶”中,V2O5· xH2O转化为钒酸盐溶解。滤渣③的主要成分是______________
(5)“调pH”中有沉淀产生,生成沉淀反应的化学方程式是____________________________
(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是____________________
6.(2016·全国III卷)以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 V2O5 V2O4 K2SO4 SiO2 Fe2O3 Al2O3
质量分数/% 2.2~2.9 2.8~3.1 22~28 60~65 1~2 <1
以下是一种废钒催化剂回收工艺路线:
回答下列问题:
(1)“酸浸”时V2O5转化为VO,反应的离子方程式为____________,同时V2O4转化成VO2+。“废渣1”的主要成分是________
(2)“氧化”中欲使3 mol的VO2+变为VO,则需要氧化剂KClO3至少为________mol
(3)“中和”作用之一是使钒以V4O形式存在于溶液中。“废渣2”中含有________
(4)“离子交换”和“洗脱”可简单表示为:4ROH+V4OR4V4O12+4OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈________性(填“酸”、“碱”或“中”)
(5)“流出液”中阳离子最多的是________
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式__________________________
7.氧钒(Ⅳ)碱式碳酸铵晶体的化学式为(NH4)5[(VO)6(CO3)4(OH)9]·10H2O,实验室以V2O5为原料制备该晶体的流程如图所示:
(1)N2H4的电子式是__________,若“还原”过程中其他产物均绿色环保,写出该过程中发生反应的化学方程式:_____________________________________________________________
(2)“转化”可在如图所示装置中进行(已知VO2+能被O2氧化)
①仪器M的名称是__________。使装置A中制气反应停止的操作是_____________________。
②在装置C中VOCl2转化为产品,实验操作的顺序为打开活塞a→______→______→_____(填序号)。
Ⅰ.取下P(如图所示),在锥形瓶口塞上无孔橡胶塞
Ⅱ.将锥形瓶置于干燥器中,静置后抽滤
Ⅲ.打开旋塞b,加入VOCl2溶液,持续搅拌一段时间,使反应完全
(3)“转化”后得到紫红色晶体,抽滤,并用饱和NH4HCO3溶液洗涤3次,用无水乙醇洗涤2次,再用无水乙醚洗涤2次,抽干。用饱和NH4HCO3溶液洗涤除去的阴离子主要是__________(填离子符号),用无水乙醚洗涤的目的是__________
(4)称取m g产品于锥形瓶中,先将产品中的钒元素转化为VO,消除其他干扰,再用c mol·L-1
(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为V mL(已知滴定反应为
VO+Fe2++2H+===VO2++Fe3++H2O),则产品中钒元素的质量分数为__________(列出计算式即可)
8.利用钒钛磁铁矿冶炼后产生的钒渣(主要含FeO·V2O3、Al2O3、SiO2及少量可溶性磷酸盐)生产V2O5的工艺流程如下,回答下列问题:
已知:①V2O5、Al2O3、SiO2可与Na2CO3、NaCl组成的混合钠盐在高温下反应,并转化为NaVO3、Na[Al(OH)4]、Na2SiO3等可溶性钠盐
②[Al(OH)]+4H+===Al3++4H2O
(1)焙烧Ⅰ包括氧化和钠化成盐两个过程,氧化的目的是获得V2O5,写出氧化过程中FeO·V2O3发生反应的化学方程式:__________________________________________________________;废渣Ⅰ的主要成分是___________;
精制Ⅰ中加盐酸调pH的主要作用是________________________________,加入NH3·H2O后发生反应的离子方程式为_________________________________________________________
(2)精制Ⅱ中加入CaCl2溶液除去磷酸盐,pH过小时影响除磷效果的原因是_________________________________;
pH过大时,沉淀量增大的原因是________________________________
(3)沉钒所得NH4VO3沉淀需进行洗涤,洗涤时除去的阴离子主要是____________。NH4VO3在500 ℃时焙烧脱氨制得产品V2O5,反应的化学方程式为2NH4VO3V2O5+H2O↑+2NH3↑。但脱氨过程中,部分V2O5会转化成V2O4,反应中氧化剂与还原剂物质的量之比为3∶2,该反应的化学方程式为____________________________
9.HDS催化剂广泛用于石油炼制和化学工业生产中,通常利用加碱焙烧-水浸取法从HDS废催化剂(主要成分为MoS、NiS、V2O5、Al2O3)中提取贵重金属钒和钼,其工艺流程如图所示。
已知:Ⅰ.MoO3、V2O5、Al2O3均可与纯碱反应生成对应的钠盐,而NiO不行
Ⅱ.高温下,NH4VO3易分解产生N2和一种含氮元素的气体
回答下列问题:
(1)“浸渣”的成分为______(填化学式);“滤液2”中的成分除了Na2MoO4外,还含有______(填化学式)
(2)请写出“焙烧”过程中MoS及Al2O3分别与纯碱反应的化学方程式:_____________________________________,
_________________________________
(3)“沉钒”时提钒率随初始钒的浓度及氯化铵的加入量的关系如图所示,则选择的初始钒的浓度和NH4Cl的加入量分别为_________、_______________
(4)“沉钒”时生成NH4VO3沉淀,则“煅烧”后生成氧化产物和还原产物的物质的量之比为________________。
10.五氧化二钒广泛用于冶金、化工等行业,主要用于冶炼钒铁、用作冶金添加剂,占五氧化二钒总消耗量的80%以上,其次是用作有机化工的催化剂。为了增加V2O5的利用率我们从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2和Fe2O3等)中回收V2O5的一种生产工艺流程示意图如下:
(1)①中废渣的主要成分是______________________________
①中V2O5发生反应的离子方程式为______________________
(2)②、③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):
R2(SO4) (水层)+2nHA(有机层)2RAn(有机层)+nH2SO4(水层)
②中萃取时必须加入适量碱,其原因是___________________________________________;实验室进行萃取操作使用的玻璃仪器为________________________
(3)实验室用的原料中V2O5占6%(原料中的所有钒已换算成V2O5)。取100 g该废钒催化剂按工业生产的步骤进行实验当加入100 mL 0.1 mol·L-1的KClO3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该实验中钒的回收率是________[M(V2O5)=182 g/mol]
(4)25 ℃时取样进行试验分析,得到钒沉淀率和溶液pH之间的关系如下表:
pH 1.3 1.4 1.5 1.6 1.7 1.8 1.9 2.0
钒沉淀率/% 88.1 94.8 96.5 98.0 98.8 98.6 96.4 93.1
试判断在实际生产时,⑤中加入氨水调节溶液的最佳pH为________;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则此时溶液中c(Fe2+)≤________。已知:25 ℃时Ksp[Fe(OH)3]=2.6×10-39
11.五氧化二钒(V2O5)在冶金、催化剂、磁性材料等领域有重要作用。实验室以含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、有机化合物等)来制备V2O5的一种工艺流程如下:
已知:含钒离子在溶液中的主要存在形式与溶液pH的关系:
溶液pH <4.0 6.0~8.0 8.0~10.0
钒元素主要存在形式 VO VO V2O
请回答下列问题:
(1)含钒废料中的有机化合物主要在___________工序中除去
(2)“焙烧”产物之一是Mg(VO3)2,写出它在“酸浸”(溶液pH<2)过程中发生反应的化学方程式_______________________________________
(3)常温时,若“调pH净化Ⅰ”工序中最终溶液pH=7,通过计算判断,此时Cu2+是否已经沉淀完全{已知离子浓度<1.0×10-5 mol·L-1认为沉淀完全;Ksp[Cu(OH)2]=2.2×10-20}__________________________________
(4)“净化Ⅱ”时若加入过量的(NH4)2CO3,可能导致的后果为___________________
(5)“滤渣2”中含有Mg2(OH)2CO3,写出生成Mg2(OH)2CO3的离子方程式______________________
(6)“煅烧”时,除生成V2O5外,还生成了参与大气循环的气体,写出煅烧时的化学方程式_________________
【钒及其化合物】答案
1.B。解析:赤泥进行碱浸,氧化铝溶解生成偏铝酸盐,再通入二氧化碳得到氢氧化铝沉淀;滤渣1经系列操作得到V2O5,可知滤渣1中含有Fe2O3、V2O5及少量稀土金属氧化物,进行还原、磁选,磁性产品中含有Fe等,非磁性产品含有V元素,在空气中焙烧后用盐酸溶解,钒在溶液中主要以VO和VO的形式存在,再加入氯化铵转化为NH4VO3,焙烧得到V2O5。氨水不能溶解氧化铝,故A错误;用盐酸溶解后的溶液中含有VO、VO、Cl-,加入氯化铵会生成NH4VO3沉淀,反应向生成更难溶的物质进行,可以推测VO2Cl溶解度大于NH4VO3,故B正确;溶液中存在平衡VO+H2OVO+2H+,盐酸过量平衡逆向移动,会抑制NH4VO3的生成,不能加入过量的盐酸,故C错误;加入的硝酸不足,Fe元素被硝酸氧化可能生成亚铁离子,亚铁离子遇KSCN溶液无明显现象,故D错误。
2.B。解析:向VOSO4溶液中滴加酸性KMnO4溶液,溶液颜色由蓝色变为淡黄色,说明MnO将VO2+氧化为VO,从而得出氧化性:MnO>VO,故A正确;碘离子的还原性强于亚铁离子且加入足量酸性(VO2)2SO4溶液,碘离子应参与氧化还原反应,故B错误;向含1 mol VO的酸性溶液中滴加含1.25 mol Fe2+的溶液发生反应:Fe2++VO+2H+===Fe3++VO2++H2O,则VO的量不足,所以转移电子为1 mol,故D正确。
3.(1)3d34s2 +5 CO2
(2)NaAlO2
(3)HCO+OH-+Ca(VO3)2CaCO3+H2O+2VO
提高溶液中浓度,促使偏钒酸钙转化为碳酸钙,释放VO 离子交换
(4)NaCl
(5)bd
解析:石煤和苛化泥通入空气进行焙烧,反应生成NaVO3、Ca(VO3)2、NaAlO2、Ca(AlO2)2、CaO和 CO2等,水浸可分离焙烧后的可溶性物质(如NaVO3)和不溶性物质[Ca(VO3)2、Ca(AlO2)2等],过滤后滤液进行离子交换、洗脱,用于富集和提纯VO,加入氯化铵溶液沉钒,生成NH4VO3,经一系列处理后得到V2O3;滤渣①在pH≈8,65~70℃的条件下加入3% NH4HCO3溶液进行盐浸,滤渣①中含有钒元素,通过盐浸,使滤渣①中的钒元素进入滤液①中,再将滤液①回流到离子交换工序,进行VO的富集。
(1)钒是23号元素,其价层电子排布式为3d34s2;焙烧过程中,氧气被还原,V2O3被氧化生成VO,偏钒酸盐中钒的化合价为+5价;CaCO3在800℃以上开始分解,生成的气体①为CO2。
(2)由已知信息可知,高温下,苛化泥的主要成分与Al2O3反应生成偏铝酸钠和偏铝酸钙,偏铝酸钠溶于水,偏铝酸钙难溶于水,所以滤液中杂质的主要成分是NaAlO2。
(3)在弱碱性环境下,Ca(VO3)2与HCO和OH-反应生成CaCO3、VO和H2O,离子方程式为:
HCO+OH-+Ca(VO3)2CaCO3+H2O+2VO; CO2加压导入盐浸工序可提高浸出率,因为C可提高溶液中HCO浓度,促使偏钒酸钙转化为碳酸钙,释放VO;滤液①中含有VO、NH等,且浓度较低,若要利用其中的钒元素,需要通过离子交换进行分离、富集,故滤液①应进入离子交换工序。
(4)由离子交换工序中树脂的组成可知,洗脱液中应含有Cl-,考虑到水浸所得溶液中含有Na+,为避免引人其他杂质离子,且NaCl廉价易得,故洗脱液的主要成分应为NaCl。
(5)a.延长沉钒时间,能使反应更加完全,有利于沉钒,a不符合题意;b.NH4Cl呈弱酸性,如果将溶液调至碱性,OH-与NH反应,不利于生成NH4VO3,b符合题意;c.搅拌能使反应物更好接触,提高反应速率,使反应更加充分,有利于沉钒,c不符合题意;d.降低NH4Cl溶液的浓度,不利于生成NH4VO3,d符合题意;故选bd。
4.(1)VO+2H2OH3VO4↓+OH-
NH4VO3发生双水解VO+NH+H2OH3VO4↓+NH3,NH有利于VO水解
(2)此温度范围内,催化剂活性已达最佳,对反应速率影响不明显,故NO转化率基本不变
NH3+5O24NO+6H2O N2+O22NO
(3)①适当增加酸的浓度、升高温度、延长酸浸时间等
②
③增加铵根离子浓度,促进平衡向析出沉淀的方向移动,提高NH4VO3的含量
解析:(1)在水溶液中VO水解为H3VO4沉淀的离子方程式为VO+2H2OH3VO4↓+OH-,反应选用NH4VO3溶液在于NH4VO3发生双水解VO+NH+H2OH3VO4↓+NH3,NH有利于VO水解。
(2)反应温度在320~360℃范围内,NO转化率随温度变化不明显的原因是此温度范围内,催化剂活性已达最佳,对反应速率影响不明显,故NO转化率基本不变。反应温度高于380℃,NO转化率下降,有可能体系产生了NO,如NH3+5O24NO+6H2O N2+O22NO等。
(3)提高钒元素浸出率的方法还有适当增加酸的浓度、升高温度、延长酸浸时间等,已知H4V4O12具有八元环结构,且V连有五根共价键,结构式可表示为。NH4VO3饱和溶液中存在溶解平衡NH4VO3(s)NH(aq)+VO(aq),加过量NH4Cl溶液有利于增加铵根离子浓度,促进平衡向析出沉淀的方向移动,提高NH4VO3的含量。
5.(1)加快酸浸氧化反应速率(促进氧化完全)
(2) Fe2+ VO++MnO2+2H+===VO+Mn2++H2O
(3) Mn2+ Fe3+、Al3+
(4)Fe(OH)3
(5)NaAlO2+HCl+H2O===NaCl+Al(OH)3↓
(6)利用同离子效应,促进NH4VO3尽可能析出完全
解析:(1)“酸浸氧化”过程中钒矿粉、MnO2和30% H2SO4发生反应,常温下反应速率较小,加热的目的是加快酸浸氧化反应速率。
(2)Fe3O4与稀硫酸反应:Fe3O4+8H+===2Fe3++Fe2++4H2O,“酸浸氧化”过程中,Fe2+具有还原性,也能被MnO2氧化生成Fe3+。VO+被氧化为VO,MnO2则被还原为Mn2+,溶液呈酸性,结合守恒规律,写出离子方程式:VO++MnO2+2H+===VO+Mn2++H2O。
(3)由表中数据可知,Mn2+开始沉淀的pH为8.1,Al3+开始沉淀的pH为3.0,沉淀完全的pH为4.7,Fe3+沉淀完全的pH为3.2。“中和沉淀”中调节pH=3.0~3.1,钒水解并沉淀为V2O5·xH2O,此时Mn2+不沉淀,Al3+部分沉淀,Fe3+几乎沉淀完全,故随滤液②除去的金属离子有K+、Mg2+、Na+、Mn2+及部分Al3+、Fe3+。
(4)滤饼②中含V2O5·xH2O、Fe(OH)3和少量Al(OH)3,“沉淀转溶”中,加入NaOH溶液,调节pH>13,V2O5·xH2O转化为钒酸盐溶解,Al(OH)3转化为NaAlO2,故滤渣③的主要成分是Fe(OH)3。
(5)滤液③中含有NaAlO2、NaVO3,“调pH”中加入HCl,调节pH=8.5,此时NaAlO2+HCl+H2O===Al(OH)3↓+NaCl。
(6)NH4VO3存在沉淀溶解平衡:NH4VO3(s)NH(aq)+VO(aq),“沉钒”中加入过量NH4Cl,增大c(NH),有利于NH4VO3结晶析出(同离子效应的应用)。
6.(1)V2O2+2H+===2VO+H2O SiO2
(2)0.5 (3)Fe(OH)3和Al(OH)3
(4)碱
(5)K+
(6)2NH4VO3V2O5+H2O+2NH3↑
解析:(1)“酸浸”时V2O5转化为VO,V2O5、VO中V元素均显+5价,V元素化合价不变,则该反应是非氧化还原反应,结合溶液的酸碱性及元素守恒写出离子方程式:V2O5+2H+===2VO+H2O。废钒催化剂中除SiO2外,其余物质均与稀硫酸反应生成易溶于水的盐,则“废渣1”的主要成分是二氧化硅。(2)“氧化”中使3 mol的VO2+变为VO,转移电子的物质的量为3 mol×(5-4)=3 mol;氧化剂KClO3被还原为KCl,Cl元素由+5价降低到-1价,根据电子守恒可知,需要KClO3的物质的量至少为=0.5 mol。(3)由图可知,加入KOH中和后产生废渣2,而“中和”作用之一是使钒以V4O形式存在于溶液中,后续操作中未进行除杂操作,显然该过程中还生成Fe(OH)3和Al(OH)3沉淀,从而除去Fe3+、Al3+,故“废渣2”中含有Fe(OH)3和Al(OH)3。(4)“离子交换”和“洗脱”可简单表示为4ROH+V4OR4V4O12+4OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,应增加溶液中c(OH-),使平衡逆向移动,故淋洗液应该呈碱性。(5)“氧化”和“中和”操作中分别加入KClO3、KOH,而“离子交换”过程中,消耗V4O同时生成OH-,而阳离子未参与离子交换,故“流出液”中阳离子最多的是K+。(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,“煅烧”过程中生成V2O5,考虑铵盐的不稳定性,还应生成NH3和H2O,结合元素守恒写出化学方程式:2NH4VO3V2O5+H2O+2NH3↑。
7.(1) 2V2O5+N2H4+8HCl4VOCl2+N2↑+6H2O
(2)①分液漏斗 关闭旋塞a ②Ⅲ Ⅰ Ⅱ
(3)Cl- 除去晶体表面的乙醇
(4)×100%
解析:(2)②VO2+能被O2氧化,先打开旋塞a,通入一段时间CO2排尽装置中的空气,然后再打开旋塞b,加入VOCl2溶液,持续搅拌一段时间,使反应完全。为防止空气进入,反应结束后取下P,在锥形瓶口塞上无孔橡胶塞,然后在干燥器中静置后抽滤。(3)用饱和NH4HCO3溶液洗涤可除去产物表面的Cl-,用无水乙醇洗涤除去产物表面的水,用无水乙醚(更易挥发)洗涤除去产物表面残留的乙醇。(4)由滴定反应可得关系式V~VO~Fe2+~(NH4)2Fe(SO4)2,n(V)=cV×10-3mol,故产品中钒元素的质量分数为×100%。
8.(1)4FeO·V2O3+5O22Fe2O3+4V2O5 Fe2O3 除Si并将[Al(OH)]转化为Al3+
Al3+ +3NH3·H2O===Al(OH)3↓+3NH、H++NH3·H2O===H2O+NH
(2)形成溶解度较大的酸式盐(或形成溶解度较大的磷酸氢钙或磷酸二氢钙) 产生了Ca(OH)2沉淀
(3)Cl- 3V2O5+2NH33V2O4+N2+3H2O
解析:(1)氧化过程FeO·V2O3生成对应的金属氧化物Fe2O3和V2O5,化学方程式为4FeO·V2O3+5O22Fe2O3+4V2O5;经过氧化和钠化后,V2O5、Al2O3、SiO2均转化为可溶性盐,Fe2O3成为滤渣;精制Ⅰ中加盐酸调pH是为了和SiO反应生成硅酸沉淀,并将[Al(OH)]转化为Al3+;加入NH3·H2O后与Al3+发生反应生成Al(OH)3沉淀,还可以中和酸,反应的化学方程式为Al3++3NH3·H2O===Al(OH)3↓+3NH、H++NH3·H2O===H2O+NH。
(2)精制Ⅱ中加入CaCl2溶液生成磷酸钙沉淀,除去磷酸盐,pH过小时易形成溶解度较大的酸式盐;pH过大时易形成Ca(OH)2沉淀。
(3)沉钒时加入试剂NH4Cl,因此所得NH4VO3沉淀含有的阴离子主要为Cl-;脱氨过程中,部分V2O5会转化成V2O4,且反应中氧化剂与还原剂物质的量之比为3∶2,则V2O5为氧化剂,NH3为还原剂,还原产物为V2O4,氧化产物为N2,则氧化还原方程式为3V2O5+2NH33V2O4+N2+3H2O。
9.(1)NiO NaVO3、NaHCO3
(2)2MoS+2Na2CO3+5O22Na2MoO4+2CO2+2SO2 Al2O3+Na2CO32NaAlO2+CO2↑
(3)20 g·L-1 10 g·L-1
(4)2∶3
解析:(1)硫化物焙烧时生成氧化物和二氧化硫,由于NiO不能与碳酸钠反应,故“水浸”时以“浸渣”的形式沉淀出来,而MoO3、V2O5、Al2O3与纯碱反应生成Na2MoO4、NaVO3和NaAlO2,通入过量CO2生成沉淀Al(OH)3和NaHCO3,故“滤液2”中的成分除了Na2MoO4外,还含有NaVO3、NaHCO3。(4)由信息和流程及氧化还原反应原理可知,NH4VO3沉淀煅烧时分解产生V2O3、N2和NH3,故反应的化学方程式为6NH4VO33V2O3+2N2↑+2NH3↑+9H2O,氧化产物为N2,还原产物为V2O3,故比值为2∶3。
10.(1)SiO2 V2O5+4H++SO===2VO2++ SO+2H2O
(2)加入碱,中和H2SO4,使平衡正向移动 分液漏斗、烧杯
(3)91.0%
(4)1.7 2.6×10-3 mol/L
解析:(1)上述分析可知滤渣A为SiO2,从流程图可以看出,在酸性条件下,V2O5转化为VO2+,SO能被V2O5氧化生成SO,根据氧化还原反应的规律配平该离子反应方程式为:V2O5+SO+4H+===2VO2++SO+2H2O;(2)反萃取时,分析平衡R2(SO4) (水层)+2nHA(有机层)??2RAn(有机层)+nH2SO4(水层),为提高②中萃取百分率,则加入碱中和硫酸,可以使平衡正移,多次连续萃取。萃取分液操作时,用到的玻璃仪器有分液漏斗和烧杯;(3)根据氧化还原规律可知,当加入100 mL 0.1 mol/L的KClO3溶液时,溶液中的钒恰好被完全处理的离子方程式为:ClO+6VO2++3H2O===6VO+6H++Cl-,再结合V2O5+SO+4H+===2VO2++SO+2H2O,从而得出关系式:3V2O5~6VO2+~ClO,因n(ClO)=0.1 mol/L×0.1 L=0.01 mol,所以n(V2O5)=3×0.01 mol=0.03 mol因此该实验中钒的回收率是×100%=91.0 %;(4)从沉淀率和pH关系找出最佳沉淀率。若钒沉淀率为93.1%时,不产生Fe(OH)3沉淀,此时溶液pH=2,计算氢氧根离子浓度,结合溶度积常数计算溶液中铁离子的浓度。由表中数据可知,pH=1.7时钒的沉淀率最大为98.8%,故加入氨水调节溶液的最佳pH为1.7。若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,此时溶液pH=2,c(OH-)=10-12 mol/L,Ksp[Fe(OH)3]=2.6×10-39=c(Fe3+)c3(OH-),c(Fe3+)==2.6×10-3(mol/L)。
11.(1)焙烧
(2)Mg(VO3)2+2H2SO4===(VO2)2SO4+MgSO4+2H2O
(3)Cu2+沉淀完全,c(Cu2+)== mol·L-1=2.2×10-6mol·L-1<1.0×10-5 mol·L-1
(4)会生成NH4VO3沉淀,降低钒的利用率
(5)2Mg2++3CO+2H2O===Mg2(OH)2CO3↓+2HCO
(6)4NH4VO3+3O22V2O5+8H2O+2N2
解析:含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、有机化合物等)加入足量碳酸镁粉末焙烧,除去有机化合物,并将V2O3氧化为V2O5,之后加入硫酸酸溶,金属元素进入溶液,然后加入适量氨水调节pH可生成氢氧化物除去Fe3+、Cu2+、Al3+,过滤后滤液中含有VO、NH、Mg2+等离子,根据后续产物可知净化Ⅱ加入碳酸铵主要是除去Mg2+,过滤后滤液中再加入足量碳酸铵得到NH4VO3沉淀,空气中煅烧可生成V2O5,以此解答该题。
(1)焙烧过程中有机化合物会被氧化为CO2、H2O等,从而除去有机化合物;(2)溶液pH<2,根据题目所给信息可知酸浸后生成(VO2)2SO4,结合元素守恒可得化学方程式为Mg(VO3)2+2H2SO4===(VO2)2SO4+MgSO4+2H2O;(3)溶液pH=7,则c(OH-)=1.0×10-7 mol·L-1,此时溶液中c(Cu2+)== mol·L-1=2.2×10-6 mol·L-1<1.0×10-5 mol·L-1,所以Cu2+沉淀完全;(4)加入过量的(NH4)2CO3,铵根离子浓度过大,且溶液碱性增强,会生成NH4VO3沉淀,降低钒的利用率;(5)“滤渣2”中含有Mg2(OH)2CO3,说明部分Mg2+和CO发生双水解反应,但由于CO浓度较大,溶液碱性较强,所以CO的水解不彻底,有HCO生成,则离子方程式为2Mg2++3CO+2H2O===Mg2(OH)2CO3↓+2HCO;(6)根据元素守恒,煅烧NH4VO3时产生的参与大气循环的气体应为N2,结合元素守恒和电荷守恒可得化学方程式为4NH4VO3+3O22V2O5+8H2O+2N2。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
