专题十一 第十五讲 过渡金属——钛及其化合物(含解析)2026届高中化学大一轮复习讲义
文档属性
| 名称 | 专题十一 第十五讲 过渡金属——钛及其化合物(含解析)2026届高中化学大一轮复习讲义 |  | |
| 格式 | doc | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-28 22:05:19 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
钛及其化合物
【核心知识梳理】
1.钛的原子结构——22Ti
电子排布式 1s22s22p63s23p63d24s2
简化电子排布式 [Ar]3d64s2
电子排布图(轨道表示式)
价层电子排布式 3d24s2
周期表中的位置 第四周期第ⅣB族
常见化合价 +3、+4
2.钛
(1)常温时下,钛不与酸反应,但能溶于浓、热的盐酸和硫酸中
2Ti+6HCl(浓)2TiCl3+3H2↑
2Ti+3H2SO4(浓)2Ti2(SO4)3+3H2↑
(2)钛易溶于氢氟酸或含有氟离子的酸中:Ti+6HFH2TiF6+2H2↑
3.二氧化钛:二氧化钛在自然界以金红石为最重要,不溶于水
(1)两性氧化物,以酸性为主,不溶于稀酸,但能溶于氢氟酸和热的浓硫酸中
TiO2+H2SO4(浓)2TiOSO4+H2O
TiO2+2NaOH===Na2TiO3+H2O
TiO2+6HF(浓)H2[TiF6]+2H2O
(2)加热条件下与Cl2、C发生反应:TiO2+2Cl2+2CTiCl4+2CO
4.氢氧化钛[Ti(OH)4]——两性氢氧化物,不溶于水,可能溶于酸、碱,高温煅烧可生成TiO2
5.四氯化钛(TiCl4):四氯化钛是钛的一种重要卤化物,以它为原料,可以制备一系列钛化合物和金属钛
(1)在水中或潮湿空气中都极易水解将它暴露在空气中会发烟:TiCl4+2H2O===TiO2↓+4HCl
(2)Mg作还原剂可制备金属钛:TiCl4+2MgTi+4HCl
6.钛(Ⅳ)的配位化合物
钛(Ⅳ)能够与许多配合剂形成配合物,如[TiF6]2-、[TiCl6]2-、[TiO(H2O2)]2+ 等,其中与H2O2的配合物较重要。利用这个反应可进行钛的比色分析,加入氨水则生成黄色的过氧钛酸H4TiO6沉淀,这是定性检出钛的灵敏方法
【巩固练习】
1.如今环境保护越来越受重视,某化工集团为减少环境污染,提高资源的利用率,将钛厂、氯碱厂、甲醇厂进行联合生产。其主要生产工艺如下(FeTiO3中Ti为+4价),下列叙述正确的是( )
A.该流程中只有“电解”“氯化”涉及氧化还原反应
B.“合成”反应中氧化剂与还原剂的物质的量之比为1∶1
C.“氯化”时反应方程式为7Cl2+2FeTiO3+6C===2FeCl3+2TiCl4+6CO(条件省略)
D.上述流程中“Mg,Ar”可用“Mg,CO2”代替
2.某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:Ksp[Al(OH)3]=1.0×10 34,Ksp[Fe(OH)3]=4.0×10 38。已知:“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO和一种阳离子,该离子会水解,下列说法不正确的是( )
A.“酸浸”时TiO2发生反应的离子方程式为TiO2+2H+===TiO2++H2O
B.“结晶”时温度需控制在70℃以上,温度过低TiO2·xH2O产率降低
C.为使滤渣2沉淀完全,需“调pH"最小为4.3
D.MgCl2溶液制备MgCl2·6H2O需要在HCl的气氛下蒸发浓缩
3.用TiOSO4溶液生产纳米TiO2的工艺流程如下,下列说法错误的是( )
A.在实验室中进行“操作Ⅰ”,需要的玻璃仪器有烧杯、玻璃棒、漏斗
B.“沉钛”时反应的离子方程式为TiO2++2NH3·H2O===TiO(OH)2↓+2NH
C.回收“滤液”中的(NH4)2SO4,应采用蒸发结晶法
D.纳米TiO2形成分散系时,具有较好的光线散射能力
4.(2022 湖南卷)钛(Ti)及其合金是理想的高强度、低密度结构材料。以钛渣(主要成分为TiO2,含少量V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:
已知“降温收尘”后,粗中含有的几种物质的沸点:
物质 TiCl4 VOCl3 SiCl4 AlCl3
沸点/℃ 136 127 57 180
回答下列问题:
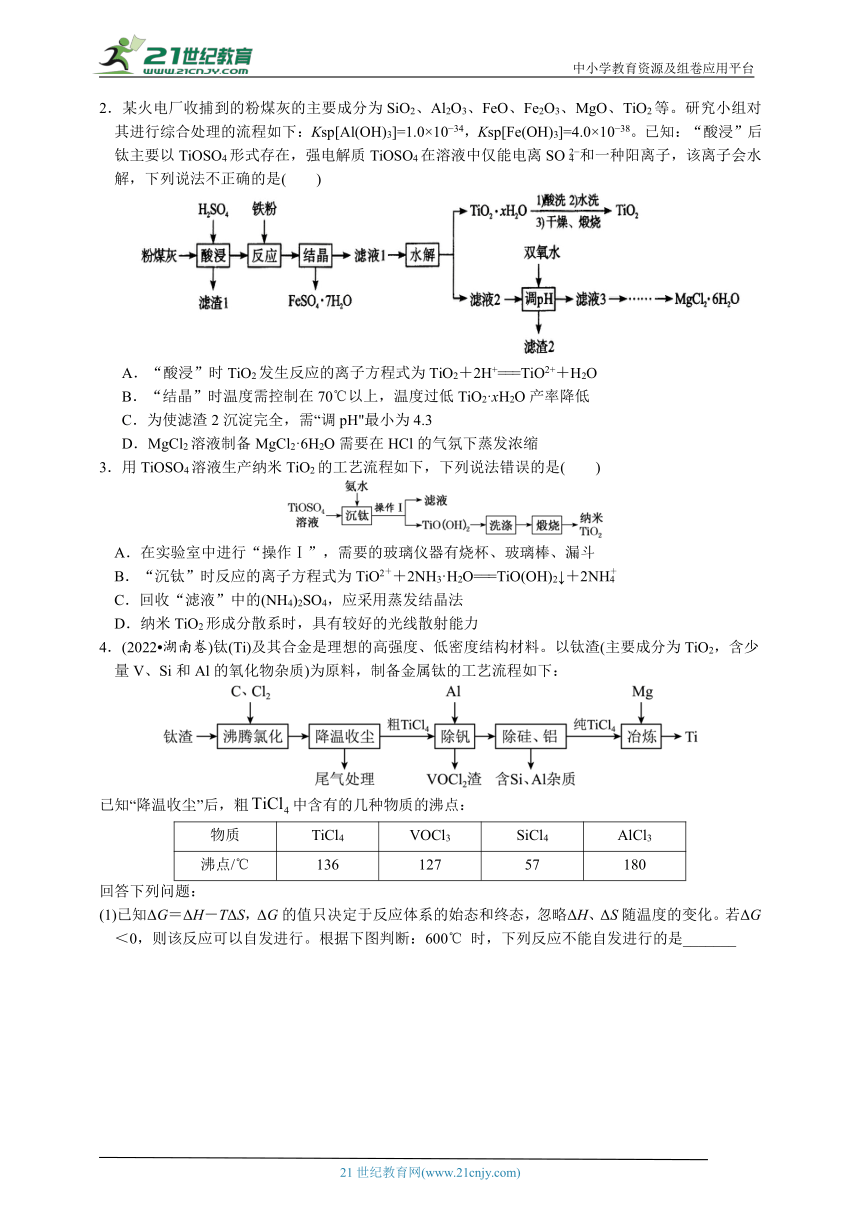
(1)已知ΔG=ΔH-TΔS,ΔG的值只决定于反应体系的始态和终态,忽略ΔH、ΔS随温度的变化。若ΔG<0,则该反应可以自发进行。根据下图判断:600℃ 时,下列反应不能自发进行的是_______
A.C(s)+O2(g)===CO2(g) B.2C(s)+O2(g)===2CO(g)
C.TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g) D.TiO2(s)+C(s)+2Cl2(g)===TiCl4(g)+CO2(g)
(2)TiO2与C、Cl2,在600℃ 的沸腾炉中充分反应后,混合气体中各组分的分压如下表:
物质 TiCl4 CO CO2 Cl2
分压/MPa 4.59×10-2 1.84×10-2 3.70×10-2 5.98×10-9
①该温度下,TiO2与C、Cl2反应的总化学方程式为____________________________
②随着温度升高,尾气中CO的含量升高,原因是_______
(3)“除钒”过程中的化学方程式为__________________________________;“除硅、铝”过程中,分离TiCl4中含Si、Al杂质的方法是_______
(4)“除钒”和“除硅、铝”的顺序_______(填“能”或“不能”)交换,理由是_________________________
(5)下列金属冶炼方法与本工艺流程中加入Mg冶炼Ti的方法相似的是_________________________
A.高炉炼铁 B.电解熔融氯化钠制钠 C.铝热反应制锰 D.氧化汞分解制汞
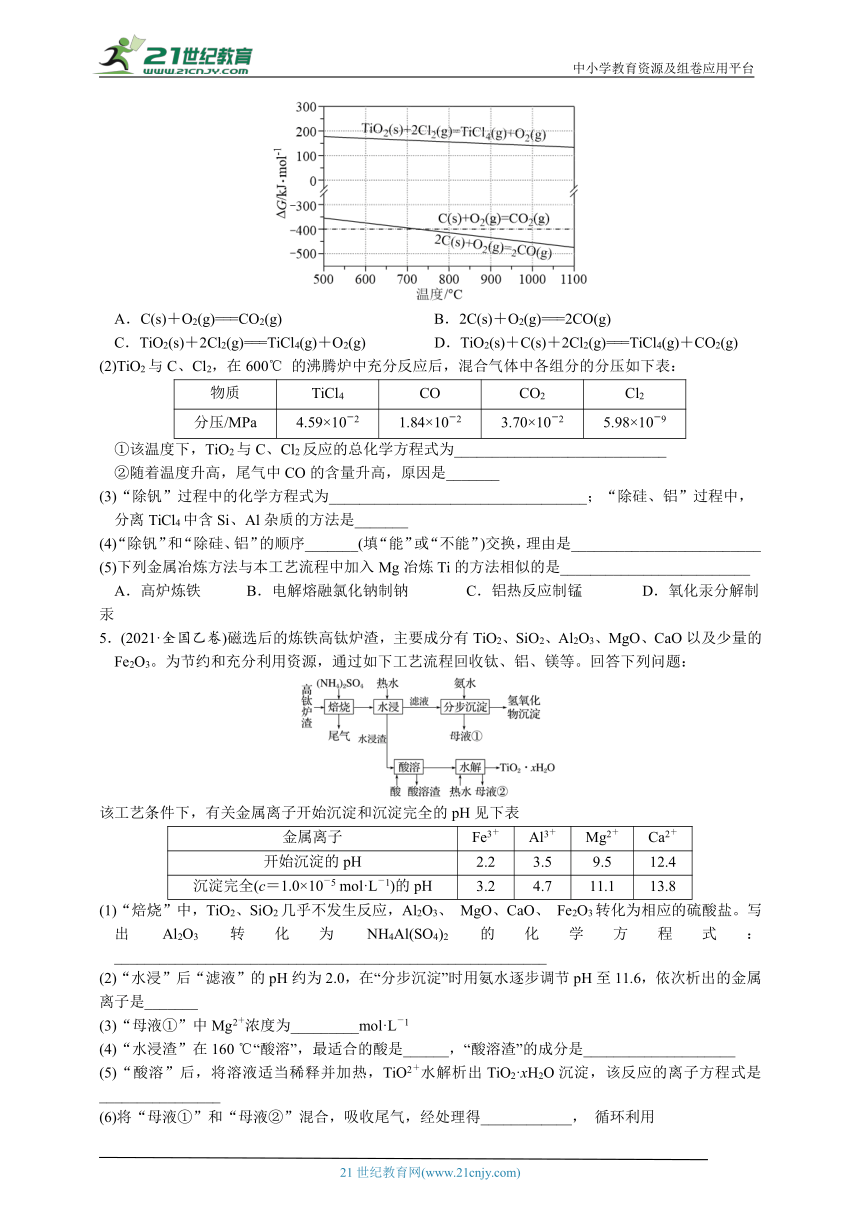
5.(2021·全国乙卷)磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。回答下列问题:
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
金属离子 Fe3+ Al3+ Mg2+ Ca2+
开始沉淀的pH 2.2 3.5 9.5 12.4
沉淀完全(c=1.0×10-5 mol·L-1)的pH 3.2 4.7 11.1 13.8
(1)“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、 MgO、CaO、 Fe2O3转化为相应的硫酸盐。写出Al2O3转化为NH4Al(SO4)2的化学方程式:_________________________________________________________
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是_______
(3)“母液①”中Mg2+浓度为_________mol·L-1
(4)“水浸渣”在160 ℃“酸溶”,最适合的酸是______,“酸溶渣”的成分是____________________
(5)“酸溶”后,将溶液适当稀释并加热,TiO2+水解析出TiO2·xH2O沉淀,该反应的离子方程式是________________
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得____________, 循环利用
6.(2017·全国I卷)Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备。工艺流程如下:
回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为____________
(2)“酸浸”后,钛主要以TiOCl形式存在,写出相应反应的离子方程式____________________________
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ 30 35 40 45 50
TiO2·xH2O转化率/% 92 95 97 93 88
分析40 ℃时TiO2·xH2O转化率最高的原因________________________
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为________
(5)若“滤液②”中c(Mg2+)=0.02 mol·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol·L-1,此时是否有Mg3(PO4)2沉淀生成?________(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式__________
7.(2017·北京卷)TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
资料:TiCl4及所含杂质氯化物的性质
化合物 SiCl4 TiCl4 AlCl3 FeCl3 MgCl2
沸点/℃ 58 136 181(升华) 316 1412
熔点/℃ 69 25 193 304 714
在TiCl4中的溶解性 互溶 —— 微溶 难溶
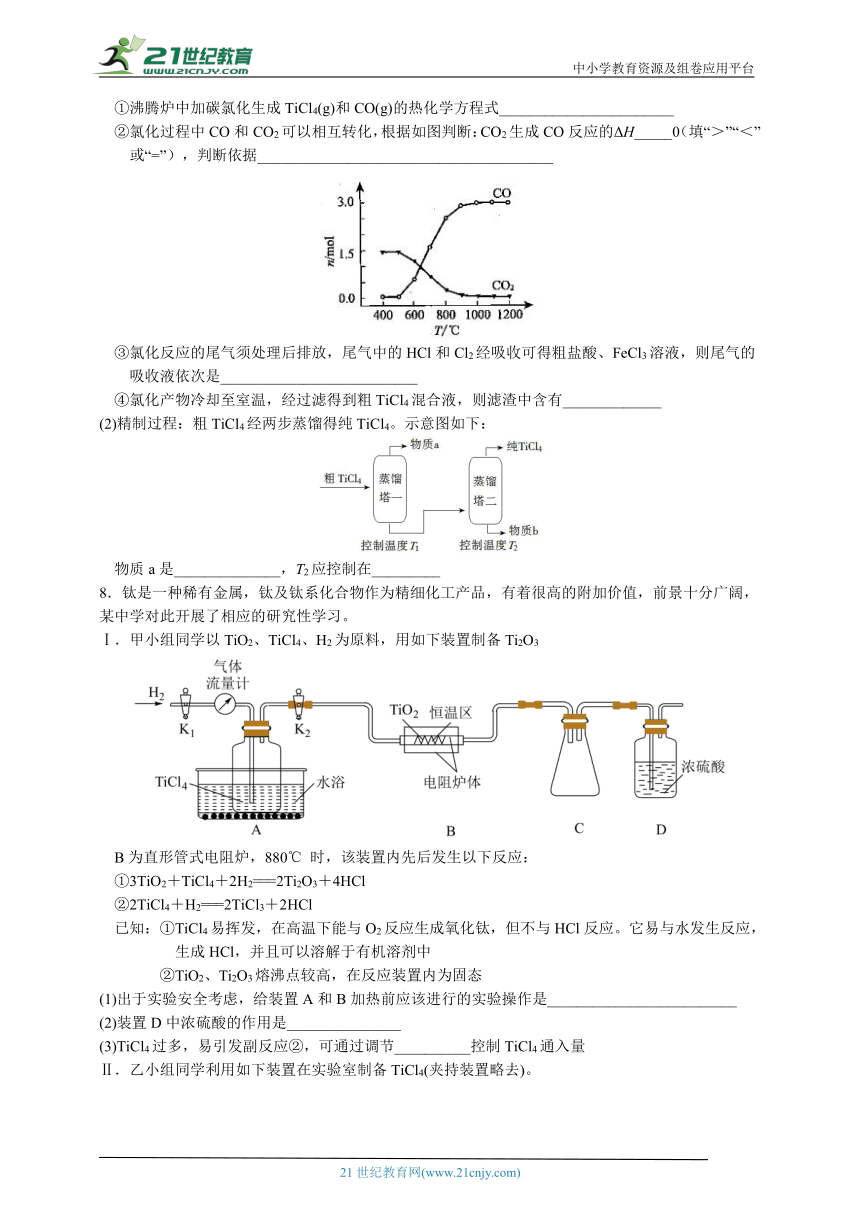
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH2=-220.9 kJ·mol-1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式_______________________
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据_______________________________________
③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________
④氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
物质a是______________,T2应控制在_________
8.钛是一种稀有金属,钛及钛系化合物作为精细化工产品,有着很高的附加价值,前景十分广阔,某中学对此开展了相应的研究性学习。
Ⅰ.甲小组同学以TiO2、TiCl4、H2为原料,用如下装置制备Ti2O3
B为直形管式电阻炉,880℃ 时,该装置内先后发生以下反应:
①3TiO2+TiCl4+2H2===2Ti2O3+4HCl
②2TiCl4+H2===2TiCl3+2HCl
已知:①TiCl4易挥发,在高温下能与O2反应生成氧化钛,但不与HCl反应。它易与水发生反应,生成HCl,并且可以溶解于有机溶剂中
②TiO2、Ti2O3熔沸点较高,在反应装置内为固态
(1)出于实验安全考虑,给装置A和B加热前应该进行的实验操作是_________________________
(2)装置D中浓硫酸的作用是_______________
(3)TiCl4过多,易引发副反应②,可通过调节__________控制TiCl4通入量
Ⅱ.乙小组同学利用如下装置在实验室制备TiCl4(夹持装置略去)。
(4)装置C中除生成TiCl4外,还生成一种气态不成盐氧化物,该反应的化学方程式为______________________
(5)利用如图装置测定所得TiCl4的纯度:取1.0 g产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待TiCl4充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,测定生成的Cl-的含量。滴加几滴0.10 mol·L-1 K2CrO4溶液作指示剂,用0.5000 mol·L-1 AgNO3 标准溶液滴定至终点,消耗标准溶液40.00 mL
已知:常温下,AgCl比Ag2CrO4 优先沉淀,Ag2CrO4 为砖红色沉淀,TiCl4+(n+2)H2O===TiO2·nH2O↓+4HCl
①安全漏斗的作用是______________________
②Cl-刚好完全沉淀时观察到的现象是_________________________________
③产品的纯度为______%
9.废SCR催化剂(含TiO2、V2O5、WO3等)的回收对环境保护和资源循环利用意义重大。通过如下工艺流程可以回收其中的钛、钒、钨等。
已知:①TiO2、V2O5和WO3都能与NaOH溶液反应,分别生成不溶性的Na2TiO3和可溶性的NaVO3、Na2WO4
②Ksp(CaWO4)=9×10-9。
回答下列问题:
(1)基态23V原子的价层电子轨道表示式为__________________
(2)“球磨”的目的是_____________________________________________
(3)“碱浸”后通过_________(填操作名称)可以实现钛与钒、钨分离
(4)“酸浸”后钛主要以TiO2+形式存在,“热水解”反应的离子方程式为__________________________________
(5)“煅烧”NH4VO3的化学方程式为_____________________________________________
(6)“沉钨”中析出CaWO4时,需要加入过量CaCl2,其目的是___________________________
(7)向20 mL 0.3 mol·L-1 Na2WO4的滤液中加入等体积的CaCl2溶液(忽略混合过程中的体积变化),欲使WO浓度小于1×10-6 mol·L-1,则CaCl2溶液的最小浓度为_________mol·L-1
10.TiO2和CaTiO3都是光电转化材料。某研究小组利用钛铁矿(主要成分为FeTiO3,还含有少量SiO2等杂质)来制备TiO2和CaTiO3,并利用黄钾铁矾[KFe3(SO4)2(OH)6]回收铁的工艺流程如图1所示,回答下列问题:
(1)“氧化酸解”的实验中,控制反应温度为150 ℃,不同氧化剂对钛铁矿酸解率的影响如图2所示。50 min时,要求酸解率大于85%,所选氧化剂应为___________________________;采用H2O2作氧化剂时,其效率低的原因可能是__________________________________
(2)向“氧化酸解”的滤液①中加入尿素[CO(NH2)2],TiO2+转化为TiO2,写出相应反应的离子方程式:___________________________________________________________,使用尿素而不直接通入NH3的原因是_________________________________________________________
(3)写出“高温煅烧”中由TiO2制备CaTiO3的化学方程式:___________________________________________
(4)Fe3+恰好沉淀完全时,溶液中c(Fe3+)=1.0×10-5 mol·L-1,计算此时溶液的pH=________________
[Fe(OH)3的Ksp=1.0×10-39、水的Kw=1.0×10-14]
(5)黄钾铁矾沉淀为晶体,含水量很少。回收Fe3+时,不采用加入氨水调节pH的方法制取Fe(OH)3的原因是_____________________________________________________________________________
11.金属钛在航天、潜海和医疗方面应用广泛。以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含少量Fe2O3]为原料制备钛的工艺流程如图所示
(1)步骤②、③、④中,均需进行的操作是________(填操作名称)
(2)滤液1中钛元素以TiO2+形式存在,步骤①中生成TiO2+的化学方程式为_______________________________,
硫酸质量分数对钛、铁浸出率的影响如图所示,据此判断,酸浸时所加硫酸的质量分数应为_______(填范围)
(3)请结合离子方程式解释步骤④中加热水的原因:________________________________________________
(4)电解法制备Ti的装置是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。Ti在________(填“阳极”或“阴极”)生成,________(填“能”或“不能”)将熔融CaO换成石灰乳
12.钛酸锰(MnTiO3)纳米材料是一种多用途催化剂。工业上用红钛锰矿(主要成分有MnTiO3,还含有少量FeO、Fe2O3、SiO2等杂质)来制备MnTiO3,其工艺流程如图所示:
已知:①红钛锰矿“酸溶”后Ti元素主要以TiO2+的形式存在; ②H2TiO3不溶于无机酸和碱,不溶于水
③在空气中加热无水MnCl2分解放出HCl,生成Mn3O4
回答下列问题:
(1)“粉碎”的目的是__________________________________
(2)“酸溶”中发生的主要反应化学方程式为____________________________________
(3)为了更好地把滤渣2分离出来,除搅拌外,还需要________(填操作名称)
(4)“氧化”的氧化剂选用的是高锰酸钾,而不选择通常人们认可的绿色氧化剂“双氧水”,除了高锰酸钾氧化性强、反应快之外,还可能的原因是_____________(写出一条即可)。
(5)“沉锰”的条件一般控制在45 ℃以下的原因是_______________________________
(6)TiO2+的水解率受温度和H+浓度的影响如图所示,TiO2+最适宜的水解条件是________________
(7)测定所得MnCl2·xH2O晶体中结晶水的含量。取29.70 g样品加热分解,热重曲线(TG)如图所示。所得氯化锰晶体x的值是________
13.钛合金是航天航空工业的重要材料。由钛铁矿(主要成分为钛酸亚铁,化学式为FeTiO3)制备Ti等产品的一种工艺流程示意图如下,回答下列问题:
已知:①TiO2+易水解,只能存在于强酸性溶液中
②25 ℃时TiO(OH)2溶度积Ksp=1×10-29
③常温下,难溶电解质溶解度与pH关系如图
(1)写出钛铁矿酸浸时反应的离子方程式:__________________________
(2)操作Ⅱ包含的具体操作方法有_____________________________________________________
(3)向“富含 TiO2+溶液”中加入Na2CO3粉末的作用是__________________________________________,TiO2+水解的离子方程式为________________________,当溶液pH=________时,TiO(OH)2已沉淀完全
(4)加入铁屑将Fe3+转化为Fe2+的原因是________________________________________________
14.金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料。以钛铁矿(主要成分为钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如图所示,回答下列问题:
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为_____________________________________________
(2)上述生产流程中加入铁屑的目的是_________________________________________,此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子,常温下,其对应氢氧化物的Ksp如表所示
氢氧化物 Fe(OH)2 TiO(OH)2 Mg(OH)2
Ksp 8.0×10-16 1.0×10-29 1.8×10-11
①常温下,若所得溶液中Mg2+的物质的量浓度为0.001 8 mol·L-1,当溶液的pH等于______时,Mg(OH)2开始沉淀
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为______________________________________________
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的化学方程式为____________________________。Mg还原TiCl4过程必须在1 070 K的温度下进行,你认为还应该控制的反应条件是______________,除去所得金属钛中少量的金属镁可用的试剂是________
15.钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示
(1)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为______________________
(2)物质A为________(填化学式),“一系列操作”为__________________________________________________
(3)“水解”步骤中生成TiO2·xH2O,为提高TiO2·xH2O的产率,可采取的措施有________________________、________________________(写出两条)
(4)“电解”是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。阴极的电极反应式为_________________________;
若制得金属Ti 9.60 g,阳极产生气体________mL(标准状况下)
(5)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,写出反应的离子方程式__________;若反应后的溶液中c(Fe2+)=2×10-6 mol·L-1,则溶液中c(CO)=________mol·L-1(已知:常温下FeCO3饱和溶液浓度为4.5×10-6 mol·L-1)
16.钛白粉(TiO2)广泛应用于涂料、化妆品、食品以及医药等行业。利用黑钛矿石[主要成分为(Mg0.5Fe0.5)Ti2O5,含有少量Al2Ca(SiO4)2]制备TiO2,工艺流程如下,回答下列问题:
已知:TiOSO4易溶于水,在热水中易水解生成H2TiO3
(1)(Mg0.5Fe0.5)Ti2O5中钛元素的化合价为________,实验“焙烧”所需的容器名称是________,“滤渣”的主要成分是________(填化学式)
(2)制取H2TiO3的化学方程式为___________________________
(3)矿石粒度对TiO2的提取率影响如图,原因是_____________________
(4)相关的金属难溶化合物在不同pH下的溶解度(s,mol·L-1)如图所示,步骤④应该控制的pH范围是_______
A.1~2 B.2~3 C.5~6 D.10~11
(5)常用硫酸铁铵[NH4Fe(SO4)2]滴定法测定钛白粉的纯度,其步骤为:用足量酸溶解a g二氧化钛样品,用铝粉做还原剂,过滤、洗涤,将滤液定容为100 mL,取20.00 mL,以NH4SCN作指示剂,用标准硫酸铁铵溶液滴定至终点,反应原理为:Ti3++Fe3+===Ti4++Fe2+
①滴定终点的现象为__________________________
②滴定终点时消耗b mol· L-1 NH4Fe(SO4)2溶液V mL,则TiO2纯度为________(写表达式)
17.钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下,请回答下列问题:
(1)铁在元素周期表中的位置为_________________________________
(2)写出TiO2+水解的离子方程式:__________________________________________________,加入过量铁粉
的作用是①__________________________________;②________________________________________
(3)操作1的实验步骤为____________、____________、过滤
(4)副产品主要成分的化学式为_________________________________________
(5)写出TiO2转化成TiCl4的化学方程式:__________________________________________________
18.金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀,而被广泛用作高新科技材料,并被誉为“未来金属”,但在高温时钛化合能力极强,可以与氧、碳、氮及其他元素化合。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,同时获得副产品甲的工业生产流程如下:
回答下列问题:
(1)已知反应①钛铁矿和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成。则该反应属于____________(填“氧化还原反应”或“非氧化还原反应”),写出该反应的化学方程式______________________________________
(2)写出上述反应②、③的化学方程式________________________________________
(3)反应④要在氩气氛围中进行的理由是______________________________,最终所得到的金属钛中会混有少量杂质,可加入__________溶解后除去
(4)用熔融法直接电解TiO2也能制取金属钛,该反应的化学方程式为_________________________
(5)如果取钛铁矿m吨,杂质的百分含量为w,最终生产出钛n吨(不考虑损耗),则m、n、w三者之间的数学关系是_________________(已知Ti的相对原子质量为48)
【钛及其化合物】答案
1.C。解析:由氢气合成甲醇的过程中也涉及氧化还原反应,A项错误;根据CO+2H2―→CH3OH可以看出,氧化剂和还原剂的物质的量之比为1∶2,B项错误;根据工艺图不难看出“氯化”即氯气、钛铁矿和焦炭反应得到四氯化钛、一氧化碳和氯化铁的过程,C项正确;二氧化碳和镁会发生反应,因此不能用二氧化碳来作保护气,D项错误。
2.B。解析:粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等,加入硫酸酸浸过滤得到滤渣1和滤液,氧化铝溶解生成硫酸铝,氧化亚铁溶解生成硫酸亚铁,氧化铁溶解生成硫酸铁,氧化镁溶解生成硫酸镁,“酸浸”后钛主要以TiOSO4形式存在,滤渣为二氧化硅,加入铁粉还原铁离子生成亚铁离子,结晶析出硫酸亚铁晶体,过滤,得到滤液1含硫酸铝、硫酸镁、TiOSO4、少量硫酸亚铁,水解过滤,TiOSO4生成TiO2·xH2O,经酸洗水洗干燥和灼烧后得到TiO2,滤液2中含硫酸铝和硫酸镁、少量硫酸亚铁,加入过氧化氢氧化亚铁离子为铁离子,调节溶液pH使铝离子和铁离子全部沉淀,过滤得到滤渣2为氢氧化铁和氢氧化铝沉淀,滤液3含硫酸镁,最终获取MgCl2·6H2O。A.根据题干信息知“酸浸”后TiO2反应生成TiOSO4,TiOSO4电离产发生SO和TiO2+,则反应的离子方程式为TiO2+2H+= =TiO2++H2O,故A正确;B.“结晶”需控制在70℃左右,温度过高会导致TiO2+提前水解混入硫酸亚铁晶体,降低TiO2·xH2O的产量,故B错误;C.调节溶液pH目的是铝离子、铁离子沉淀完全除去,因Ksp[Al(OH)3]=1.0×10 34,Ksp[Fe(OH)3]=4.0×10 38,阴阳离子比相同,Ksp[Al(OH)3]>Ksp[Fe(OH)3],则铝离子沉淀完全对应溶液pH最小,结合溶度积常数计算,c3(OH )=,c(OH )=10 9.6mol/L,c(H+)=,pH=4.3,故C正确;D.用MgCl2溶液制备MgCl2·6H2O,需要蒸发浓缩、冷却结晶、过滤洗涤、干燥等;因为加热蒸发促进氯化镁水解,为抑制氯化镁水解应在HCl的气氛下蒸发浓缩,故D正确。
3.C。解析:根据流程,沉钛时的反应为TiO2++2NH3·H2O===TiO(OH)2↓+2NH,滤液的主要成分为硫酸铵,操作Ⅰ为过滤,需要的玻璃仪器为烧杯、玻璃棒和漏斗,故A、B正确;硫酸铵溶解度随温度的变化较大,用加热浓缩、冷却结晶的方法,故C错误;纳米TiO2形成分散系时,形成胶体,胶体具有较好的光线散射能力,故D正确。
4.(1)C
(2)①5TiO2+6C+10Cl25TiCl4+2CO+4CO2
②随着温度升高,CO2与C发生反应C+CO22CO
(3)3VOCl3+Al===3VOCl2+AlCl3 蒸馏
(4)不能 若先“除硅、铝”再“除钒”,“除钒”时需要加入Al,又引入Al杂质
(5)AC
解析:钛渣中加入C、Cl2进行沸腾氯化,转化为相应的氯化物,降温收尘后得到粗TiCl4,加入单质Al除钒,再除硅、铝得到纯TiCl4,加入Mg还原得到Ti。
(1)记①C(s)+O2(g)===CO2(g),②2C(s)+O2(g)===2CO(g),③TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g),
④TiO2(s)+C(s)+2Cl2(g)===TiCl4(g)+CO2(g);
A.由图可知,600℃时C(s)+O2(g)===CO2(g)的ΔG<0,反应自发进行,故A不符合题意;
B.由图可知,600℃时2C(s)+O2(g)===2CO(g)的ΔG<0,反应自发进行,故B不符合题意;
C.由图可知,600℃时TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g)的ΔG>0,反应不能自发进行,故C符合题意;
D.根据盖斯定律,TiO2(s)+C(s)+2Cl2(g)===TiCl4(g)+CO2(g)可由①+③得到,则600℃时其ΔG<0,反应自发进行,故D不符合题意;故选C;
(2)①根据表中数据可知,该温度下C主要生成CO和CO2,根据相同条件下气体的压强之比是物质的量之比可知TiCl4、CO和CO2的物质的量之比约是5:2:4,所以TiO2与C、Cl2反应的总化学方程式为5TiO2+6C+10Cl25TiCl4+2CO+4CO2,故答案为:5TiO2+6C+10Cl25TiCl4+2CO+4CO2;
②随着温度升高,CO2与C发生反应C+CO22CO,导致CO含量升高,故答案为:随着温度升高,CO2与C发生反应C+CO22CO;
(3)“降温收尘”后钒元素主要以VOCl3形式存在,加入Al得到VOCl2渣,根据得失电子守恒和元素守恒配平方程式为3VOCl3+Al===3VOCl2+AlCl3;AlCl3、SiCl4与TiCl4沸点差异较大,“除硅、铝"过程中可采用蒸馏方法分离AlCl3、SiCl4,故答案为:3VOCl3+Al===3VOCl2+AlCl3;蒸馏;
(4)若先“除硅、铝”再“除钒”,“除钒”时需要加入Al,又引入Al杂质,因此“除钒”和“除硅、铝”的顺序不能交换,故答案为:不能;若先“除硅、铝”再“除钒”,“除钒”时需要加入Al,又引入Al杂质;
(5)本工艺中加入Mg冶炼Ti的方法为热还原法;A.高炉炼铁的原理是用还原剂将铁矿石中铁的氧化物还原成金属铁,属于热还原法,故A符合题意;B.电解熔融氯化钠制取金属钠的原理是电解法,故B不符合题意;C.铝热反应制锰是利用Al作还原剂,将锰从其化合物中还原出来,为热还原法,故C符合题意;D.Hg为不活泼金属,可以直接用加热分解氧化汞的方法制备汞,故D不符合题意;故答案选AC,故答案:AC。
5.(1)Al2O3+4(NH4)2SO42NH4Al(SO4)2+6NH3↑+3H2O↑
(2)Fe3+、Al3+、Mg2+
(3)1.0×10-6
(4)硫酸 SiO2、CaSO4
(5)TiO2++(x+1)H2OTiO2·xH2O↓+2H+
(6)(NH4)2SO4
解析:(1)氧化铝转化为硫酸铝铵发生的反应为氧化铝、硫酸铵在高温条件下反应生成硫酸铝铵、氨气和水,反应的化学方程式为Al2O3+4(NH4)2SO42NH4Al(SO4)2+6NH3↑+3H2O↑。(2)由题给开始沉淀和完全沉淀的pH可知,将pH约为2.0的滤液加入氨水调节溶液pH为11.6时,铁离子首先沉淀,然后是铝离子、镁离子,钙离子没有沉淀。(3)由镁离子完全沉淀时,溶液pH为11.1可知,氢氧化镁的溶度积为1×10-5×(1×10-2.9)2=1×10-10.8,当溶液pH为11.6时,溶液中镁离子的浓度为mol·L-1=1×10-6 mol·L-1。(4)增大溶液中硫酸根离子的浓度,有利于使微溶的硫酸钙转化为沉淀,为了使微溶的硫酸钙完全沉淀,减少TiOSO4溶液中含有的硫酸钙的量,应加入浓硫酸加热到160 ℃酸溶;由分析可知,二氧化硅和硫酸钙与硫酸不反应,则酸溶渣的主要成分为二氧化硅和硫酸钙。(5)酸溶后将TiOSO4溶液适当稀释并加热,能使TiOSO4完全水解生成TiO2·xH2O沉淀和硫酸,反应的离子方程式为TiO2++(x+1)H2OTiO2·xH2O↓+2H+。(6)由分析可知,尾气为氨气,母液①为硫酸铵、母液②为硫酸,将母液①和母液②混合后吸收氨气得到硫酸铵溶液,可以循环使用。
6.(1)100 ℃、2 h,90 ℃、5 h
(2)FeTiO3+4H++4Cl-===Fe2++TiOCl+2H2O
(3)低于40 ℃,TiO2·xH2O转化反应速率随温度升高而增加;超过40 ℃,双氧水分解与氨气逸出导致TiO2·xH2O转化反应速率下降
(4)4
(5)Fe3+恰好沉淀完全时,c(PO)= mol·L-1=1.3×10-17 mol·L-1,c3(Mg2+)·c2(PO)值为0.013×(1.3×10-17)2=1.7×10-40<Ksp[Mg3(PO4)2],因此不会生成Mg3(PO4)2沉淀
(6)2FePO4+Li2CO3+H2C2O42LiFePO4+3CO2↑+H2O
解析:(1)根据图像分析,当铁的浸出率为70%时,所采用的实验条件为100 ℃、2 h,90 ℃、5 h。
(2)“酸浸”时,发生反应的离子方程式为FeTiO3+4H++4Cl-===Fe2++TiOCl+2H2O。
(3)当温度低于40 ℃时,H2O2、NH3·H2O不易分解,但是温度低,反应速率慢,TiO2·xH2O转化率低;当温度高于40 ℃时,H2O2分解,NH3逸出,反应物浓度降低,反应速率下降,TiO2·xH2O的转化率低。
(4)设Li2Ti5O15中过氧键的数目为x,则非过氧键氧原子数目为15-2x,根据化合物中各元素正、负化合价代数和为零可得:2x+2×(15-2x)=1×2+4×5,解得:x=4。
(5)根据Ksp(FePO4)=1.3×10-22及Fe3+恰好完全沉淀时溶液中c(Fe3+)=1.0×10-5 mol·L-1,可得c(PO)= mol·L-1=1.3×10-17 mol·L-1。c(Mg2+)= mol·L-1=0.01 mol·L-1,则c3(Mg2+)·c2(PO)=0.013×(1.3×10-17)2=1.69×10-40≈1.7×10-40<Ksp[Mg3(PO4)2]=1.0×10-24,因此不会生成Mg3(PO4)2沉淀。
(6)煅烧过程中,Fe元素化合价由+3降至+2,被还原,则H2C2O4应作还原剂,其氧化产物为CO2,反应的化学方程式为2FePO4+Li2CO3+H2C2O42LiFePO4+3CO2↑+H2O。
7.(1)①TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g) ΔH=-45.5 kJ·mol-1
②> 随温度升高,CO含量增大,说明生成CO的反应是吸热反应
③H2O、FeCl2溶液、NaOH溶液
④MgCl2、AlCl3、FeCl3
(2)SiCl4 高于136℃,低于181℃
解析:(1)①生成TiCl4和CO的反应方程式为TiO2+2Cl2+2C===TiCl4+2CO,根据盖斯定律,两式相加,得到TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g) ΔH=ΔH1+ΔH2=(-220.9 kJ·mol-1)+(+175.4 kJ·mo-1)=-45.5 kJ·mol-1 。②根据图像,随着温度的升高,CO的浓度增加,CO2浓度降低,说明升高温度,平衡向正反应方向移动,即ΔH>0。③除去氯气中混有HCl一般采用将气体通过饱和食盐水,结合操作目的,因此先通过饱和食盐水,然后在通入FeCl2溶液中,最后用氢氧化钠溶液吸收剩余的Cl2。④资料中已经给出“TiCl4及所含杂质氯化物的性质”一览表,因此氯化过程中生成的MgCl2、AlCl3、FeCl3只有少量溶解在液态TiCl4中,而SiCl4完全溶解在TiCl4中,因此过滤得到粗TiCl4混合液时滤渣中含有上述难溶物和微溶物。(2)根据资料,SiCl4的沸点最低,先蒸馏出来,因此物质a为SiCl4,根据流程目的,为了得到纯净的TiCl4,后续温度需控制在稍微大于136℃,但小于181℃。
8.(1)先通H2排出装置内的空气
(2)防止空气中的水进入装置
(3)A中水浴的温度
(4)TiO2+2C+2Cl2TiCl4+2CO
(5)吸收产生的HCl气体,防止HCl的逸出,影响测定结果的准确性 出现砖红色沉淀 95
解析:I:实验中应先通一段时间氢气后,排除装置内空气;然后打开装置B的加热开关,TiO2、TiCl4、H2反应生成Ti2O3,反应完毕后,关闭装置B的加热开关,待冷却后再关闭K1、K2;C装置的作用是收集冷凝的TiCl4并防止倒吸,D中浓硫酸防止空气中水蒸气进入装置。
Ⅱ.本实验利用Cl2与TiO2反应制备TiCl4,A为制备Cl2的装置,C、D分别为制备、收集TiCl4的装置,因TiCl4易与水发生水解反应,要求制备和收集过程无水,故在C前、D后都要加干燥装置,所以B、E中盛放试剂为浓硫酸;F中盛放NaOH溶液,目的是除去未反应的Cl2。
(1)根据分析,给装置A和B加热前应该进行的实验操作是:先通H2排出装置内的空气;
(2)根据分析,装置D中浓硫酸的作用是:防止空气中的水进入装置;
(3)TiCl4的过多,容易引发副反应②,可通过调节装置A中水浴的温度,控制TiCl4的汽化量,达到调整TiCl4的通入量;
(4)根据元素守恒可知一种气态不成盐氧化物为CO,则该反应的化学方程式为:TiO2+2C+2Cl2TiCl4+2CO;
(5)①安全漏斗的作用是:吸收产生的HCl气体,防止HCl的逸出,影响测定结果的准确性;②根据题给信息可知,Cl-刚好完全沉淀时,再多滴加硝酸银反应将生成Ag2CrO4砖红色沉淀,因此观察到的现象是出现砖红色沉淀;③根据元素守恒关系:,,产品的纯度为
9.(1)
(2)增大接触面积,提高“碱浸”反应速率
(3)过滤
(4)TiO2++(x+1)H2OTiO2·xH2O↓+2H+
(5)2NH4VO3V2O5+2NH3↑+H2O↑
(6)利用同离子效应,促进CaWO4尽可能析出完全
(7)0.318
解析:
(1)基态23V原子的价层电子排布式为3d34s2,则价层电子轨道表示式为。
(3)由已知①知,“碱浸”后得到可溶性的NaVO3、Na2WO4和不溶性的Na2TiO3,则可以通过过滤实现钛与钒、钨分离。
(4)由流程图知,“热水解”时TiO2+转化为TiO2·xH2O,离子方程式为TiO2++(x+1)H2OTiO2·xH2O↓+2H+。(5)“煅烧”NH4VO3得到V2O5,V元素化合价不变,发生非氧化还原反应,根据原子守恒配平化学方程式为2NH4VO3V2O5+2NH3↑+H2O↑。
(6)“沉钨”时析出CaWO4的反应为Ca2++WO===CaWO4↓,加入过量CaCl2,可增大Ca2+浓度,促进CaWO4尽可能析出完全。
(7)根据Ca2++WO===CaWO4↓知,生成CaWO4沉淀需要20 mL 0.3 mol·L-1 CaCl2溶液,欲使WO浓度小于1×10-6 mol·L-1,则溶液中c(Ca2)> mol·L-1=9×10-3 mol·L-1,则加入的CaCl2溶液的最小浓度为0.3 mol·L-1+9×10-3 mol·L-1×2=0.318 mol·L-1。
10.(1)KClO3 在温度较高时H2O2易分解[或产物中的Fe3+可以催化H2O2的分解(其他合理答案也可,如H2O2氧化能力弱)]
(2)TiO2++CO(NH2)2+2H2OTiO2+CO2↑+2NH 避免将溶液中Fe3+沉淀
(3)TiO2+CaCl2·2H2OCaTiO3+2HCl↑+H2O↑
(4)2.7
(5)Fe(OH)3为絮状沉淀,不容易分离
解析:(1)根据题目要求结合图像,在50 min时酸解率大于85%的氧化剂有KMnO4和KClO3,但KMnO4作氧化剂引入了Mn2+,对后续的物质分离会造成干扰,故选用KClO3作氧化剂。(2)由TiO2+转化为TiO2可知,Ti元素的化合价并没有发生改变,该反应为非氧化还原反应,在酸性环境中,C、N元素的产物为CO2、NH;由于Fe3+开始沉淀需要的pH很小,直接通入NH3会使溶液pH快速增大,容易使Fe3+沉淀,所以使用尿素而不直接通入NH3,可以避免溶液中Fe3+沉淀。(3)由信息可知制备CaTiO3的反应为非氧化还原反应,根据元素守恒,剩余产物为HCl、H2O。(4)根据Fe(OH)3的Ksp=1.0×10-39和溶液中c(Fe3+)=1.0×10-5 mol·L-1可知,溶液中OH-的浓度为 mol·L-1≈1.0×10-11.3 mol·L-1,c(H+)===10-2.7 mol·L-1,所以pH为2.7。(5)氢氧化铁为絮状沉淀,不易于从溶液中分离,所以不采用加入氨水调节pH的方法制取Fe(OH)3。
11.(1)过滤
(2)FeTiO3+2H2SO4FeSO4+TiOSO4+2H2O 80%~85%
(3)TiO2++2H2OH2TiO3+2H+,水解反应是吸热反应,用热水促进平衡向正反应方向移动
(4)阴极 不能
解析:(1)步骤②、③、④中,均需进行的操作是过滤;(2)反应物为钛铁矿,生成物为FeSO4、TiOSO4及H2O,化学方程式为FeTiO3+2H2SO4FeSO4+TiOSO4+2H2O;根据图像可知硫酸质量分数在80%~85%之间时浸出率最大;(3)TiO2+在水溶液中发生水解TiO2++2H2O??H2TiO3+2H+,水解反应是吸热反应,用热水促进平衡向正反应方向移动,生成H2TiO3; (4)由TiO2生成Ti,Ti元素化合价降低发生还原反应,电解池中阴极得电子发生还原反应;若换成石灰乳,石灰乳中有水,阴极将产生氢气,无法得到金属钛,所以不能将熔融CaO换成石灰乳。
12.(1)增大接触面积,加快反应速度,提高浸取率
(2)MnTiO3+2H2SO4===MnSO4+TiOSO4+2H2O
(3)加热(或电泳)
(4)根据反应过程中颜色变化可以判断Fe2+是否氧化完全(或Fe2+、Fe3+存在时,加速H2O2分解,导致原料利用率太低,答案合理即可)
(5)升温可以加快反应速度,但超过45 ℃,NH4HCO3易分解,所以控制在45 ℃以下可以提高原料利用率(转化率)
(6)温度105 ℃,H+浓度0.90 g·L-1
(7)4
解析:(5)沉锰的反应为:MnSO4+2NH4HCO3===(NH4)2SO4+MnCO3↓+CO2↑+H2O,“沉锰”的条件一般控制在45 ℃以下的原因是升温可以加快反应速度,但超过45 ℃,NH4HCO3易分解,所以控制在45 ℃以下可以提高原料利用率(转化率)。
(7)由题中信息,在空气中加热无水MnCl2分解放出HCl,生成Mn3O4。200 ℃时,失去全部结晶水,∶=1∶x,x=4,所得氯化锰晶体x的值是4。
13.(1)FeTiO3+4H+===TiO2++Fe2++2H2O
(2)蒸发浓缩、冷却结晶、过滤
(3)调节溶液pH,促进TiO2+水解 TiO2++2H2OTiO(OH)2↓+2H+ 2.5
(4)避免Fe3+和TiO2+同时沉淀
解析:(1)钛铁矿酸浸时,发生反应的离子方程式为FeTiO3+4H+===TiO2++Fe2++2H2O。(2)向含有TiO2+、Fe2+、Fe3+等的酸性溶液中加入适量的Fe屑,发生反应:2Fe3++Fe===3Fe2+,然后将溶液蒸发浓缩、冷却结晶就会产生FeSO4·7H2O,然后将晶体过滤出来,就得到了绿矾。(3)滤液中含有大量的TiO2+,向该溶液中加入Na2CO3粉末,调整溶液的酸碱性,促进TiO2+的水解,由图像可知当溶液的pH=2.5 时,TiO(OH)2已经完全沉淀。(4)若不加入铁屑,就会同时产生TiO(OH)2和Fe(OH)3导致制取的物质纯度不高,所以加入铁屑将Fe3+转化为Fe2+,避免Fe3+和TiO2+同时沉淀。
14.(1)FeTiO3 FeTiO3+2H2SO4(浓)===TiOSO4+FeSO4+2H2O
(2)防止Fe2+被氧化 ①10 ②TiO2++2H2O===TiO(OH)2↓+2H+(或TiO2++2H2O===H2TiO3↓+2H+)
(3)TiO2+2C+2Cl2TiCl4+2CO 隔绝空气 稀盐酸
解析:(1)由2R+C2Fe+2TiO2+CO2↑,根据原子守恒,可推知钛酸亚铁的化学式为FeTiO3。钛酸亚铁和浓H2SO4反应,生成TiOSO4,无气体生成,元素Ti的化合价不变,说明发生非氧化还原反应,则产物中还有FeSO4,故该反应的化学方程式为FeTiO3+2H2SO4(浓)===TiOSO4+FeSO4+2H2O。(2)钛铁矿和浓硫酸反应的产物之一是FeSO4,加入铁屑,可防止Fe2+被氧化。①根据Ksp[Mg(OH)2]=c(Mg2+)·c2(OH-)=1.8×10-11,c(OH-)== mol·L-1=10-4mol·L-1,则c(H+)== mol·L-1=10-10 mol·L-1,pH=-lg10-10=10。②根据题表提供的Ksp数据知,三种物质组成类型相同且TiO(OH)2的溶度积常数最小,则加水稀释,立即析出的白色沉淀为TiO(OH)2,TiO2+的水解方程式为TiO2++2H2O===TiO(OH)2↓+2H+或TiO2++2H2O===H2TiO3↓+2H+。(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的化学方程式为TiO2+2C+2Cl2TiCl4+2CO;为防止空气中的氧气与反应物发生反应,应隔绝空气加热。可用稀盐酸除去钛中混有的镁。
15.(1)FeTiO3+2H2SO4TiOSO4+FeSO4+2H2O
(2)Fe 蒸发浓缩、冷却结晶、过滤
(3)加水稀释反应物 加碱中和生成的酸、加热等
(4)TiO2+4e-===Ti+2O2- 4 480
(5)Fe2++2HCO===FeCO3↓+CO2↑+H2O 1×10-5
解析:(1)因钛铁矿主要成分为FeTiO3,且滤液1中钛元素以TiO2+形式存在,所以其主要反应化学方程式为FeTiO3+2H2SO4TiOSO4+FeSO4+2H2O。(2)该流程中还有副产物FeSO4·7H2O,故需将溶浸产物中的Fe3+除去,物质A为Fe,“一系列操作”包括蒸发浓缩、冷却结晶、过滤。(3) “水解”反应为TiO2++(x+1)H2O===TiO2·xH2O↓+2H+,根据平衡移动原理,为提高TiO2·xH2O的产率可以加水稀释反应物、加碱中和生成的酸、加热等。(4)“电解”过程中阴极反应:TiO2+4e-===Ti+2O2-,阳极反应:2O2--4e-===O2↑,若制得金属Ti 9.60 g,则n(Ti)=n(O2)=0.2 mol,V(O2)=4 480 mL(标准状况下)。(5)由题意知该反应化学方程式为:Fe2++2HCO===FeCO3↓+CO2↑+H2O;由常温下FeCO3饱和溶液浓度为4.5×10-6 mol·L-1,Ksp(FeCO3)=2.025×10-11 mol2·L-2,则c(CO)==1.013×10-5 (mol·L-1)。
16.(1)+4 坩埚 CaSO4、CaSiO3
(2)TiOSO4+2H2OH2TiO3↓+H2SO4
(3)矿石粒度越小,反应物接触面积越大,反应速率越快
(4)B
(5)①当滴入最后一滴硫酸铁铵时,溶液变成红色,且30 s内不变回原色 ②%
解析:(1)设Ti的化合价为+x,(Mg0.5Fe0.5)Ti2O5化合价代数和等于0,(2×0.5+2×0.5)+2x-2×5=0,x=4;灼烧固体用坩埚;黑钛矿石[主要成分为(Mg0.5Fe0.5)Ti2O5,含有少量Al2Ca(SiO4)2]加入NH4HSO4焙烧后,加水过滤,沉淀中含有CaSO4 和CaSiO3;(2)由TiOSO4水解制备H2TiO3,反应方程式为:TiOSO4+2H2OH2TiO3↓+H2SO4;(3)由图中变量结合影响反应的速率、转化率的因素,矿石粒度对TiO2的提取率影响,原因是矿石粒度越小,反应物接触面积越大,反应速率越快;(4)由图读出:金属难溶化合物在不同pH下的溶解度(s,mol·L-1),步骤④应该控制的pH范围是:钛酸沉淀pH大于2,而氢氧化铝不沉淀,pH小于3,故选B;(5)①铁离子过量时,反应结束,故终点现象为:当滴入最后一滴硫酸铁铵时,溶液变成红色,且30 s内不变回原色;②由TiO2~Fe3+关系式,n(TiO2)=n(Fe3+)=b mol· L-1×V×10-3 L×100 mL/20 mL=5bV×10-3 mol,TiO2纯度为5bV×10-3 mol×80 g·mol-1/a g×100%=%。
17.(1)第四周期第Ⅷ族
(2)TiO2++2H2OH2TiO3↓+2H+ 防止Fe2+被氧化为Fe3+ 消耗多余的硫酸
(3)蒸发浓缩 冷却结晶
(4)FeSO4·7H2O(写成FeSO4也可)
(5)2Cl2+TiO2+2CTiCl4+2CO
解析:(1)Fe在元素周期表中位于第四周期第Ⅷ族。(2)根据题意可知,TiO2+水解时,结合水电离出的OH-生成H2TiO3。由于Fe2+易被氧化,故加入过量铁粉可以防止Fe2+被氧化为Fe3+;加入的过量铁粉还可以消耗溶解钛铁矿时多余的硫酸。(3)经过操作1得到含TiO2+的滤液和副产品,则操作1为蒸发浓缩、冷却结晶、过滤。(4)依据流程图及原子守恒可知副产品为硫酸亚铁晶体。(5)该反应中氯气作氧化剂,焦炭作还原剂,根据焦炭过量可以确定产物中有CO,根据得失电子守恒和原子守恒配平化学方程式即可。
18.(1)非氧化还原反应 FeTiO3+2H2SO4===TiOSO4+FeSO4+2H2O
(2)H2TiO3TiO2+H2O、TiO2+2Cl2+2CTiCl4+2CO
(3)Ti在高温下化合能力极强,在氩气氛围中可防止其与O2、N2等化合 稀盐酸
(4)TiO2(熔融)Ti+O2↑
(5)6m=19n+6mw
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
钛及其化合物
【核心知识梳理】
1.钛的原子结构——22Ti
电子排布式 1s22s22p63s23p63d24s2
简化电子排布式 [Ar]3d64s2
电子排布图(轨道表示式)
价层电子排布式 3d24s2
周期表中的位置 第四周期第ⅣB族
常见化合价 +3、+4
2.钛
(1)常温时下,钛不与酸反应,但能溶于浓、热的盐酸和硫酸中
2Ti+6HCl(浓)2TiCl3+3H2↑
2Ti+3H2SO4(浓)2Ti2(SO4)3+3H2↑
(2)钛易溶于氢氟酸或含有氟离子的酸中:Ti+6HFH2TiF6+2H2↑
3.二氧化钛:二氧化钛在自然界以金红石为最重要,不溶于水
(1)两性氧化物,以酸性为主,不溶于稀酸,但能溶于氢氟酸和热的浓硫酸中
TiO2+H2SO4(浓)2TiOSO4+H2O
TiO2+2NaOH===Na2TiO3+H2O
TiO2+6HF(浓)H2[TiF6]+2H2O
(2)加热条件下与Cl2、C发生反应:TiO2+2Cl2+2CTiCl4+2CO
4.氢氧化钛[Ti(OH)4]——两性氢氧化物,不溶于水,可能溶于酸、碱,高温煅烧可生成TiO2
5.四氯化钛(TiCl4):四氯化钛是钛的一种重要卤化物,以它为原料,可以制备一系列钛化合物和金属钛
(1)在水中或潮湿空气中都极易水解将它暴露在空气中会发烟:TiCl4+2H2O===TiO2↓+4HCl
(2)Mg作还原剂可制备金属钛:TiCl4+2MgTi+4HCl
6.钛(Ⅳ)的配位化合物
钛(Ⅳ)能够与许多配合剂形成配合物,如[TiF6]2-、[TiCl6]2-、[TiO(H2O2)]2+ 等,其中与H2O2的配合物较重要。利用这个反应可进行钛的比色分析,加入氨水则生成黄色的过氧钛酸H4TiO6沉淀,这是定性检出钛的灵敏方法
【巩固练习】
1.如今环境保护越来越受重视,某化工集团为减少环境污染,提高资源的利用率,将钛厂、氯碱厂、甲醇厂进行联合生产。其主要生产工艺如下(FeTiO3中Ti为+4价),下列叙述正确的是( )
A.该流程中只有“电解”“氯化”涉及氧化还原反应
B.“合成”反应中氧化剂与还原剂的物质的量之比为1∶1
C.“氯化”时反应方程式为7Cl2+2FeTiO3+6C===2FeCl3+2TiCl4+6CO(条件省略)
D.上述流程中“Mg,Ar”可用“Mg,CO2”代替
2.某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:Ksp[Al(OH)3]=1.0×10 34,Ksp[Fe(OH)3]=4.0×10 38。已知:“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO和一种阳离子,该离子会水解,下列说法不正确的是( )
A.“酸浸”时TiO2发生反应的离子方程式为TiO2+2H+===TiO2++H2O
B.“结晶”时温度需控制在70℃以上,温度过低TiO2·xH2O产率降低
C.为使滤渣2沉淀完全,需“调pH"最小为4.3
D.MgCl2溶液制备MgCl2·6H2O需要在HCl的气氛下蒸发浓缩
3.用TiOSO4溶液生产纳米TiO2的工艺流程如下,下列说法错误的是( )
A.在实验室中进行“操作Ⅰ”,需要的玻璃仪器有烧杯、玻璃棒、漏斗
B.“沉钛”时反应的离子方程式为TiO2++2NH3·H2O===TiO(OH)2↓+2NH
C.回收“滤液”中的(NH4)2SO4,应采用蒸发结晶法
D.纳米TiO2形成分散系时,具有较好的光线散射能力
4.(2022 湖南卷)钛(Ti)及其合金是理想的高强度、低密度结构材料。以钛渣(主要成分为TiO2,含少量V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:
已知“降温收尘”后,粗中含有的几种物质的沸点:
物质 TiCl4 VOCl3 SiCl4 AlCl3
沸点/℃ 136 127 57 180
回答下列问题:
(1)已知ΔG=ΔH-TΔS,ΔG的值只决定于反应体系的始态和终态,忽略ΔH、ΔS随温度的变化。若ΔG<0,则该反应可以自发进行。根据下图判断:600℃ 时,下列反应不能自发进行的是_______
A.C(s)+O2(g)===CO2(g) B.2C(s)+O2(g)===2CO(g)
C.TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g) D.TiO2(s)+C(s)+2Cl2(g)===TiCl4(g)+CO2(g)
(2)TiO2与C、Cl2,在600℃ 的沸腾炉中充分反应后,混合气体中各组分的分压如下表:
物质 TiCl4 CO CO2 Cl2
分压/MPa 4.59×10-2 1.84×10-2 3.70×10-2 5.98×10-9
①该温度下,TiO2与C、Cl2反应的总化学方程式为____________________________
②随着温度升高,尾气中CO的含量升高,原因是_______
(3)“除钒”过程中的化学方程式为__________________________________;“除硅、铝”过程中,分离TiCl4中含Si、Al杂质的方法是_______
(4)“除钒”和“除硅、铝”的顺序_______(填“能”或“不能”)交换,理由是_________________________
(5)下列金属冶炼方法与本工艺流程中加入Mg冶炼Ti的方法相似的是_________________________
A.高炉炼铁 B.电解熔融氯化钠制钠 C.铝热反应制锰 D.氧化汞分解制汞
5.(2021·全国乙卷)磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。回答下列问题:
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
金属离子 Fe3+ Al3+ Mg2+ Ca2+
开始沉淀的pH 2.2 3.5 9.5 12.4
沉淀完全(c=1.0×10-5 mol·L-1)的pH 3.2 4.7 11.1 13.8
(1)“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、 MgO、CaO、 Fe2O3转化为相应的硫酸盐。写出Al2O3转化为NH4Al(SO4)2的化学方程式:_________________________________________________________
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是_______
(3)“母液①”中Mg2+浓度为_________mol·L-1
(4)“水浸渣”在160 ℃“酸溶”,最适合的酸是______,“酸溶渣”的成分是____________________
(5)“酸溶”后,将溶液适当稀释并加热,TiO2+水解析出TiO2·xH2O沉淀,该反应的离子方程式是________________
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得____________, 循环利用
6.(2017·全国I卷)Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备。工艺流程如下:
回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为____________
(2)“酸浸”后,钛主要以TiOCl形式存在,写出相应反应的离子方程式____________________________
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ 30 35 40 45 50
TiO2·xH2O转化率/% 92 95 97 93 88
分析40 ℃时TiO2·xH2O转化率最高的原因________________________
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为________
(5)若“滤液②”中c(Mg2+)=0.02 mol·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol·L-1,此时是否有Mg3(PO4)2沉淀生成?________(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式__________
7.(2017·北京卷)TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
资料:TiCl4及所含杂质氯化物的性质
化合物 SiCl4 TiCl4 AlCl3 FeCl3 MgCl2
沸点/℃ 58 136 181(升华) 316 1412
熔点/℃ 69 25 193 304 714
在TiCl4中的溶解性 互溶 —— 微溶 难溶
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH2=-220.9 kJ·mol-1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式_______________________
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据_______________________________________
③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________
④氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
物质a是______________,T2应控制在_________
8.钛是一种稀有金属,钛及钛系化合物作为精细化工产品,有着很高的附加价值,前景十分广阔,某中学对此开展了相应的研究性学习。
Ⅰ.甲小组同学以TiO2、TiCl4、H2为原料,用如下装置制备Ti2O3
B为直形管式电阻炉,880℃ 时,该装置内先后发生以下反应:
①3TiO2+TiCl4+2H2===2Ti2O3+4HCl
②2TiCl4+H2===2TiCl3+2HCl
已知:①TiCl4易挥发,在高温下能与O2反应生成氧化钛,但不与HCl反应。它易与水发生反应,生成HCl,并且可以溶解于有机溶剂中
②TiO2、Ti2O3熔沸点较高,在反应装置内为固态
(1)出于实验安全考虑,给装置A和B加热前应该进行的实验操作是_________________________
(2)装置D中浓硫酸的作用是_______________
(3)TiCl4过多,易引发副反应②,可通过调节__________控制TiCl4通入量
Ⅱ.乙小组同学利用如下装置在实验室制备TiCl4(夹持装置略去)。
(4)装置C中除生成TiCl4外,还生成一种气态不成盐氧化物,该反应的化学方程式为______________________
(5)利用如图装置测定所得TiCl4的纯度:取1.0 g产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待TiCl4充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,测定生成的Cl-的含量。滴加几滴0.10 mol·L-1 K2CrO4溶液作指示剂,用0.5000 mol·L-1 AgNO3 标准溶液滴定至终点,消耗标准溶液40.00 mL
已知:常温下,AgCl比Ag2CrO4 优先沉淀,Ag2CrO4 为砖红色沉淀,TiCl4+(n+2)H2O===TiO2·nH2O↓+4HCl
①安全漏斗的作用是______________________
②Cl-刚好完全沉淀时观察到的现象是_________________________________
③产品的纯度为______%
9.废SCR催化剂(含TiO2、V2O5、WO3等)的回收对环境保护和资源循环利用意义重大。通过如下工艺流程可以回收其中的钛、钒、钨等。
已知:①TiO2、V2O5和WO3都能与NaOH溶液反应,分别生成不溶性的Na2TiO3和可溶性的NaVO3、Na2WO4
②Ksp(CaWO4)=9×10-9。
回答下列问题:
(1)基态23V原子的价层电子轨道表示式为__________________
(2)“球磨”的目的是_____________________________________________
(3)“碱浸”后通过_________(填操作名称)可以实现钛与钒、钨分离
(4)“酸浸”后钛主要以TiO2+形式存在,“热水解”反应的离子方程式为__________________________________
(5)“煅烧”NH4VO3的化学方程式为_____________________________________________
(6)“沉钨”中析出CaWO4时,需要加入过量CaCl2,其目的是___________________________
(7)向20 mL 0.3 mol·L-1 Na2WO4的滤液中加入等体积的CaCl2溶液(忽略混合过程中的体积变化),欲使WO浓度小于1×10-6 mol·L-1,则CaCl2溶液的最小浓度为_________mol·L-1
10.TiO2和CaTiO3都是光电转化材料。某研究小组利用钛铁矿(主要成分为FeTiO3,还含有少量SiO2等杂质)来制备TiO2和CaTiO3,并利用黄钾铁矾[KFe3(SO4)2(OH)6]回收铁的工艺流程如图1所示,回答下列问题:
(1)“氧化酸解”的实验中,控制反应温度为150 ℃,不同氧化剂对钛铁矿酸解率的影响如图2所示。50 min时,要求酸解率大于85%,所选氧化剂应为___________________________;采用H2O2作氧化剂时,其效率低的原因可能是__________________________________
(2)向“氧化酸解”的滤液①中加入尿素[CO(NH2)2],TiO2+转化为TiO2,写出相应反应的离子方程式:___________________________________________________________,使用尿素而不直接通入NH3的原因是_________________________________________________________
(3)写出“高温煅烧”中由TiO2制备CaTiO3的化学方程式:___________________________________________
(4)Fe3+恰好沉淀完全时,溶液中c(Fe3+)=1.0×10-5 mol·L-1,计算此时溶液的pH=________________
[Fe(OH)3的Ksp=1.0×10-39、水的Kw=1.0×10-14]
(5)黄钾铁矾沉淀为晶体,含水量很少。回收Fe3+时,不采用加入氨水调节pH的方法制取Fe(OH)3的原因是_____________________________________________________________________________
11.金属钛在航天、潜海和医疗方面应用广泛。以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含少量Fe2O3]为原料制备钛的工艺流程如图所示
(1)步骤②、③、④中,均需进行的操作是________(填操作名称)
(2)滤液1中钛元素以TiO2+形式存在,步骤①中生成TiO2+的化学方程式为_______________________________,
硫酸质量分数对钛、铁浸出率的影响如图所示,据此判断,酸浸时所加硫酸的质量分数应为_______(填范围)
(3)请结合离子方程式解释步骤④中加热水的原因:________________________________________________
(4)电解法制备Ti的装置是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。Ti在________(填“阳极”或“阴极”)生成,________(填“能”或“不能”)将熔融CaO换成石灰乳
12.钛酸锰(MnTiO3)纳米材料是一种多用途催化剂。工业上用红钛锰矿(主要成分有MnTiO3,还含有少量FeO、Fe2O3、SiO2等杂质)来制备MnTiO3,其工艺流程如图所示:
已知:①红钛锰矿“酸溶”后Ti元素主要以TiO2+的形式存在; ②H2TiO3不溶于无机酸和碱,不溶于水
③在空气中加热无水MnCl2分解放出HCl,生成Mn3O4
回答下列问题:
(1)“粉碎”的目的是__________________________________
(2)“酸溶”中发生的主要反应化学方程式为____________________________________
(3)为了更好地把滤渣2分离出来,除搅拌外,还需要________(填操作名称)
(4)“氧化”的氧化剂选用的是高锰酸钾,而不选择通常人们认可的绿色氧化剂“双氧水”,除了高锰酸钾氧化性强、反应快之外,还可能的原因是_____________(写出一条即可)。
(5)“沉锰”的条件一般控制在45 ℃以下的原因是_______________________________
(6)TiO2+的水解率受温度和H+浓度的影响如图所示,TiO2+最适宜的水解条件是________________
(7)测定所得MnCl2·xH2O晶体中结晶水的含量。取29.70 g样品加热分解,热重曲线(TG)如图所示。所得氯化锰晶体x的值是________
13.钛合金是航天航空工业的重要材料。由钛铁矿(主要成分为钛酸亚铁,化学式为FeTiO3)制备Ti等产品的一种工艺流程示意图如下,回答下列问题:
已知:①TiO2+易水解,只能存在于强酸性溶液中
②25 ℃时TiO(OH)2溶度积Ksp=1×10-29
③常温下,难溶电解质溶解度与pH关系如图
(1)写出钛铁矿酸浸时反应的离子方程式:__________________________
(2)操作Ⅱ包含的具体操作方法有_____________________________________________________
(3)向“富含 TiO2+溶液”中加入Na2CO3粉末的作用是__________________________________________,TiO2+水解的离子方程式为________________________,当溶液pH=________时,TiO(OH)2已沉淀完全
(4)加入铁屑将Fe3+转化为Fe2+的原因是________________________________________________
14.金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料。以钛铁矿(主要成分为钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如图所示,回答下列问题:
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为_____________________________________________
(2)上述生产流程中加入铁屑的目的是_________________________________________,此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子,常温下,其对应氢氧化物的Ksp如表所示
氢氧化物 Fe(OH)2 TiO(OH)2 Mg(OH)2
Ksp 8.0×10-16 1.0×10-29 1.8×10-11
①常温下,若所得溶液中Mg2+的物质的量浓度为0.001 8 mol·L-1,当溶液的pH等于______时,Mg(OH)2开始沉淀
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为______________________________________________
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的化学方程式为____________________________。Mg还原TiCl4过程必须在1 070 K的温度下进行,你认为还应该控制的反应条件是______________,除去所得金属钛中少量的金属镁可用的试剂是________
15.钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示
(1)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为______________________
(2)物质A为________(填化学式),“一系列操作”为__________________________________________________
(3)“水解”步骤中生成TiO2·xH2O,为提高TiO2·xH2O的产率,可采取的措施有________________________、________________________(写出两条)
(4)“电解”是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。阴极的电极反应式为_________________________;
若制得金属Ti 9.60 g,阳极产生气体________mL(标准状况下)
(5)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,写出反应的离子方程式__________;若反应后的溶液中c(Fe2+)=2×10-6 mol·L-1,则溶液中c(CO)=________mol·L-1(已知:常温下FeCO3饱和溶液浓度为4.5×10-6 mol·L-1)
16.钛白粉(TiO2)广泛应用于涂料、化妆品、食品以及医药等行业。利用黑钛矿石[主要成分为(Mg0.5Fe0.5)Ti2O5,含有少量Al2Ca(SiO4)2]制备TiO2,工艺流程如下,回答下列问题:
已知:TiOSO4易溶于水,在热水中易水解生成H2TiO3
(1)(Mg0.5Fe0.5)Ti2O5中钛元素的化合价为________,实验“焙烧”所需的容器名称是________,“滤渣”的主要成分是________(填化学式)
(2)制取H2TiO3的化学方程式为___________________________
(3)矿石粒度对TiO2的提取率影响如图,原因是_____________________
(4)相关的金属难溶化合物在不同pH下的溶解度(s,mol·L-1)如图所示,步骤④应该控制的pH范围是_______
A.1~2 B.2~3 C.5~6 D.10~11
(5)常用硫酸铁铵[NH4Fe(SO4)2]滴定法测定钛白粉的纯度,其步骤为:用足量酸溶解a g二氧化钛样品,用铝粉做还原剂,过滤、洗涤,将滤液定容为100 mL,取20.00 mL,以NH4SCN作指示剂,用标准硫酸铁铵溶液滴定至终点,反应原理为:Ti3++Fe3+===Ti4++Fe2+
①滴定终点的现象为__________________________
②滴定终点时消耗b mol· L-1 NH4Fe(SO4)2溶液V mL,则TiO2纯度为________(写表达式)
17.钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下,请回答下列问题:
(1)铁在元素周期表中的位置为_________________________________
(2)写出TiO2+水解的离子方程式:__________________________________________________,加入过量铁粉
的作用是①__________________________________;②________________________________________
(3)操作1的实验步骤为____________、____________、过滤
(4)副产品主要成分的化学式为_________________________________________
(5)写出TiO2转化成TiCl4的化学方程式:__________________________________________________
18.金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀,而被广泛用作高新科技材料,并被誉为“未来金属”,但在高温时钛化合能力极强,可以与氧、碳、氮及其他元素化合。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,同时获得副产品甲的工业生产流程如下:
回答下列问题:
(1)已知反应①钛铁矿和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成。则该反应属于____________(填“氧化还原反应”或“非氧化还原反应”),写出该反应的化学方程式______________________________________
(2)写出上述反应②、③的化学方程式________________________________________
(3)反应④要在氩气氛围中进行的理由是______________________________,最终所得到的金属钛中会混有少量杂质,可加入__________溶解后除去
(4)用熔融法直接电解TiO2也能制取金属钛,该反应的化学方程式为_________________________
(5)如果取钛铁矿m吨,杂质的百分含量为w,最终生产出钛n吨(不考虑损耗),则m、n、w三者之间的数学关系是_________________(已知Ti的相对原子质量为48)
【钛及其化合物】答案
1.C。解析:由氢气合成甲醇的过程中也涉及氧化还原反应,A项错误;根据CO+2H2―→CH3OH可以看出,氧化剂和还原剂的物质的量之比为1∶2,B项错误;根据工艺图不难看出“氯化”即氯气、钛铁矿和焦炭反应得到四氯化钛、一氧化碳和氯化铁的过程,C项正确;二氧化碳和镁会发生反应,因此不能用二氧化碳来作保护气,D项错误。
2.B。解析:粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等,加入硫酸酸浸过滤得到滤渣1和滤液,氧化铝溶解生成硫酸铝,氧化亚铁溶解生成硫酸亚铁,氧化铁溶解生成硫酸铁,氧化镁溶解生成硫酸镁,“酸浸”后钛主要以TiOSO4形式存在,滤渣为二氧化硅,加入铁粉还原铁离子生成亚铁离子,结晶析出硫酸亚铁晶体,过滤,得到滤液1含硫酸铝、硫酸镁、TiOSO4、少量硫酸亚铁,水解过滤,TiOSO4生成TiO2·xH2O,经酸洗水洗干燥和灼烧后得到TiO2,滤液2中含硫酸铝和硫酸镁、少量硫酸亚铁,加入过氧化氢氧化亚铁离子为铁离子,调节溶液pH使铝离子和铁离子全部沉淀,过滤得到滤渣2为氢氧化铁和氢氧化铝沉淀,滤液3含硫酸镁,最终获取MgCl2·6H2O。A.根据题干信息知“酸浸”后TiO2反应生成TiOSO4,TiOSO4电离产发生SO和TiO2+,则反应的离子方程式为TiO2+2H+= =TiO2++H2O,故A正确;B.“结晶”需控制在70℃左右,温度过高会导致TiO2+提前水解混入硫酸亚铁晶体,降低TiO2·xH2O的产量,故B错误;C.调节溶液pH目的是铝离子、铁离子沉淀完全除去,因Ksp[Al(OH)3]=1.0×10 34,Ksp[Fe(OH)3]=4.0×10 38,阴阳离子比相同,Ksp[Al(OH)3]>Ksp[Fe(OH)3],则铝离子沉淀完全对应溶液pH最小,结合溶度积常数计算,c3(OH )=,c(OH )=10 9.6mol/L,c(H+)=,pH=4.3,故C正确;D.用MgCl2溶液制备MgCl2·6H2O,需要蒸发浓缩、冷却结晶、过滤洗涤、干燥等;因为加热蒸发促进氯化镁水解,为抑制氯化镁水解应在HCl的气氛下蒸发浓缩,故D正确。
3.C。解析:根据流程,沉钛时的反应为TiO2++2NH3·H2O===TiO(OH)2↓+2NH,滤液的主要成分为硫酸铵,操作Ⅰ为过滤,需要的玻璃仪器为烧杯、玻璃棒和漏斗,故A、B正确;硫酸铵溶解度随温度的变化较大,用加热浓缩、冷却结晶的方法,故C错误;纳米TiO2形成分散系时,形成胶体,胶体具有较好的光线散射能力,故D正确。
4.(1)C
(2)①5TiO2+6C+10Cl25TiCl4+2CO+4CO2
②随着温度升高,CO2与C发生反应C+CO22CO
(3)3VOCl3+Al===3VOCl2+AlCl3 蒸馏
(4)不能 若先“除硅、铝”再“除钒”,“除钒”时需要加入Al,又引入Al杂质
(5)AC
解析:钛渣中加入C、Cl2进行沸腾氯化,转化为相应的氯化物,降温收尘后得到粗TiCl4,加入单质Al除钒,再除硅、铝得到纯TiCl4,加入Mg还原得到Ti。
(1)记①C(s)+O2(g)===CO2(g),②2C(s)+O2(g)===2CO(g),③TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g),
④TiO2(s)+C(s)+2Cl2(g)===TiCl4(g)+CO2(g);
A.由图可知,600℃时C(s)+O2(g)===CO2(g)的ΔG<0,反应自发进行,故A不符合题意;
B.由图可知,600℃时2C(s)+O2(g)===2CO(g)的ΔG<0,反应自发进行,故B不符合题意;
C.由图可知,600℃时TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g)的ΔG>0,反应不能自发进行,故C符合题意;
D.根据盖斯定律,TiO2(s)+C(s)+2Cl2(g)===TiCl4(g)+CO2(g)可由①+③得到,则600℃时其ΔG<0,反应自发进行,故D不符合题意;故选C;
(2)①根据表中数据可知,该温度下C主要生成CO和CO2,根据相同条件下气体的压强之比是物质的量之比可知TiCl4、CO和CO2的物质的量之比约是5:2:4,所以TiO2与C、Cl2反应的总化学方程式为5TiO2+6C+10Cl25TiCl4+2CO+4CO2,故答案为:5TiO2+6C+10Cl25TiCl4+2CO+4CO2;
②随着温度升高,CO2与C发生反应C+CO22CO,导致CO含量升高,故答案为:随着温度升高,CO2与C发生反应C+CO22CO;
(3)“降温收尘”后钒元素主要以VOCl3形式存在,加入Al得到VOCl2渣,根据得失电子守恒和元素守恒配平方程式为3VOCl3+Al===3VOCl2+AlCl3;AlCl3、SiCl4与TiCl4沸点差异较大,“除硅、铝"过程中可采用蒸馏方法分离AlCl3、SiCl4,故答案为:3VOCl3+Al===3VOCl2+AlCl3;蒸馏;
(4)若先“除硅、铝”再“除钒”,“除钒”时需要加入Al,又引入Al杂质,因此“除钒”和“除硅、铝”的顺序不能交换,故答案为:不能;若先“除硅、铝”再“除钒”,“除钒”时需要加入Al,又引入Al杂质;
(5)本工艺中加入Mg冶炼Ti的方法为热还原法;A.高炉炼铁的原理是用还原剂将铁矿石中铁的氧化物还原成金属铁,属于热还原法,故A符合题意;B.电解熔融氯化钠制取金属钠的原理是电解法,故B不符合题意;C.铝热反应制锰是利用Al作还原剂,将锰从其化合物中还原出来,为热还原法,故C符合题意;D.Hg为不活泼金属,可以直接用加热分解氧化汞的方法制备汞,故D不符合题意;故答案选AC,故答案:AC。
5.(1)Al2O3+4(NH4)2SO42NH4Al(SO4)2+6NH3↑+3H2O↑
(2)Fe3+、Al3+、Mg2+
(3)1.0×10-6
(4)硫酸 SiO2、CaSO4
(5)TiO2++(x+1)H2OTiO2·xH2O↓+2H+
(6)(NH4)2SO4
解析:(1)氧化铝转化为硫酸铝铵发生的反应为氧化铝、硫酸铵在高温条件下反应生成硫酸铝铵、氨气和水,反应的化学方程式为Al2O3+4(NH4)2SO42NH4Al(SO4)2+6NH3↑+3H2O↑。(2)由题给开始沉淀和完全沉淀的pH可知,将pH约为2.0的滤液加入氨水调节溶液pH为11.6时,铁离子首先沉淀,然后是铝离子、镁离子,钙离子没有沉淀。(3)由镁离子完全沉淀时,溶液pH为11.1可知,氢氧化镁的溶度积为1×10-5×(1×10-2.9)2=1×10-10.8,当溶液pH为11.6时,溶液中镁离子的浓度为mol·L-1=1×10-6 mol·L-1。(4)增大溶液中硫酸根离子的浓度,有利于使微溶的硫酸钙转化为沉淀,为了使微溶的硫酸钙完全沉淀,减少TiOSO4溶液中含有的硫酸钙的量,应加入浓硫酸加热到160 ℃酸溶;由分析可知,二氧化硅和硫酸钙与硫酸不反应,则酸溶渣的主要成分为二氧化硅和硫酸钙。(5)酸溶后将TiOSO4溶液适当稀释并加热,能使TiOSO4完全水解生成TiO2·xH2O沉淀和硫酸,反应的离子方程式为TiO2++(x+1)H2OTiO2·xH2O↓+2H+。(6)由分析可知,尾气为氨气,母液①为硫酸铵、母液②为硫酸,将母液①和母液②混合后吸收氨气得到硫酸铵溶液,可以循环使用。
6.(1)100 ℃、2 h,90 ℃、5 h
(2)FeTiO3+4H++4Cl-===Fe2++TiOCl+2H2O
(3)低于40 ℃,TiO2·xH2O转化反应速率随温度升高而增加;超过40 ℃,双氧水分解与氨气逸出导致TiO2·xH2O转化反应速率下降
(4)4
(5)Fe3+恰好沉淀完全时,c(PO)= mol·L-1=1.3×10-17 mol·L-1,c3(Mg2+)·c2(PO)值为0.013×(1.3×10-17)2=1.7×10-40<Ksp[Mg3(PO4)2],因此不会生成Mg3(PO4)2沉淀
(6)2FePO4+Li2CO3+H2C2O42LiFePO4+3CO2↑+H2O
解析:(1)根据图像分析,当铁的浸出率为70%时,所采用的实验条件为100 ℃、2 h,90 ℃、5 h。
(2)“酸浸”时,发生反应的离子方程式为FeTiO3+4H++4Cl-===Fe2++TiOCl+2H2O。
(3)当温度低于40 ℃时,H2O2、NH3·H2O不易分解,但是温度低,反应速率慢,TiO2·xH2O转化率低;当温度高于40 ℃时,H2O2分解,NH3逸出,反应物浓度降低,反应速率下降,TiO2·xH2O的转化率低。
(4)设Li2Ti5O15中过氧键的数目为x,则非过氧键氧原子数目为15-2x,根据化合物中各元素正、负化合价代数和为零可得:2x+2×(15-2x)=1×2+4×5,解得:x=4。
(5)根据Ksp(FePO4)=1.3×10-22及Fe3+恰好完全沉淀时溶液中c(Fe3+)=1.0×10-5 mol·L-1,可得c(PO)= mol·L-1=1.3×10-17 mol·L-1。c(Mg2+)= mol·L-1=0.01 mol·L-1,则c3(Mg2+)·c2(PO)=0.013×(1.3×10-17)2=1.69×10-40≈1.7×10-40<Ksp[Mg3(PO4)2]=1.0×10-24,因此不会生成Mg3(PO4)2沉淀。
(6)煅烧过程中,Fe元素化合价由+3降至+2,被还原,则H2C2O4应作还原剂,其氧化产物为CO2,反应的化学方程式为2FePO4+Li2CO3+H2C2O42LiFePO4+3CO2↑+H2O。
7.(1)①TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g) ΔH=-45.5 kJ·mol-1
②> 随温度升高,CO含量增大,说明生成CO的反应是吸热反应
③H2O、FeCl2溶液、NaOH溶液
④MgCl2、AlCl3、FeCl3
(2)SiCl4 高于136℃,低于181℃
解析:(1)①生成TiCl4和CO的反应方程式为TiO2+2Cl2+2C===TiCl4+2CO,根据盖斯定律,两式相加,得到TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g) ΔH=ΔH1+ΔH2=(-220.9 kJ·mol-1)+(+175.4 kJ·mo-1)=-45.5 kJ·mol-1 。②根据图像,随着温度的升高,CO的浓度增加,CO2浓度降低,说明升高温度,平衡向正反应方向移动,即ΔH>0。③除去氯气中混有HCl一般采用将气体通过饱和食盐水,结合操作目的,因此先通过饱和食盐水,然后在通入FeCl2溶液中,最后用氢氧化钠溶液吸收剩余的Cl2。④资料中已经给出“TiCl4及所含杂质氯化物的性质”一览表,因此氯化过程中生成的MgCl2、AlCl3、FeCl3只有少量溶解在液态TiCl4中,而SiCl4完全溶解在TiCl4中,因此过滤得到粗TiCl4混合液时滤渣中含有上述难溶物和微溶物。(2)根据资料,SiCl4的沸点最低,先蒸馏出来,因此物质a为SiCl4,根据流程目的,为了得到纯净的TiCl4,后续温度需控制在稍微大于136℃,但小于181℃。
8.(1)先通H2排出装置内的空气
(2)防止空气中的水进入装置
(3)A中水浴的温度
(4)TiO2+2C+2Cl2TiCl4+2CO
(5)吸收产生的HCl气体,防止HCl的逸出,影响测定结果的准确性 出现砖红色沉淀 95
解析:I:实验中应先通一段时间氢气后,排除装置内空气;然后打开装置B的加热开关,TiO2、TiCl4、H2反应生成Ti2O3,反应完毕后,关闭装置B的加热开关,待冷却后再关闭K1、K2;C装置的作用是收集冷凝的TiCl4并防止倒吸,D中浓硫酸防止空气中水蒸气进入装置。
Ⅱ.本实验利用Cl2与TiO2反应制备TiCl4,A为制备Cl2的装置,C、D分别为制备、收集TiCl4的装置,因TiCl4易与水发生水解反应,要求制备和收集过程无水,故在C前、D后都要加干燥装置,所以B、E中盛放试剂为浓硫酸;F中盛放NaOH溶液,目的是除去未反应的Cl2。
(1)根据分析,给装置A和B加热前应该进行的实验操作是:先通H2排出装置内的空气;
(2)根据分析,装置D中浓硫酸的作用是:防止空气中的水进入装置;
(3)TiCl4的过多,容易引发副反应②,可通过调节装置A中水浴的温度,控制TiCl4的汽化量,达到调整TiCl4的通入量;
(4)根据元素守恒可知一种气态不成盐氧化物为CO,则该反应的化学方程式为:TiO2+2C+2Cl2TiCl4+2CO;
(5)①安全漏斗的作用是:吸收产生的HCl气体,防止HCl的逸出,影响测定结果的准确性;②根据题给信息可知,Cl-刚好完全沉淀时,再多滴加硝酸银反应将生成Ag2CrO4砖红色沉淀,因此观察到的现象是出现砖红色沉淀;③根据元素守恒关系:,,产品的纯度为
9.(1)
(2)增大接触面积,提高“碱浸”反应速率
(3)过滤
(4)TiO2++(x+1)H2OTiO2·xH2O↓+2H+
(5)2NH4VO3V2O5+2NH3↑+H2O↑
(6)利用同离子效应,促进CaWO4尽可能析出完全
(7)0.318
解析:
(1)基态23V原子的价层电子排布式为3d34s2,则价层电子轨道表示式为。
(3)由已知①知,“碱浸”后得到可溶性的NaVO3、Na2WO4和不溶性的Na2TiO3,则可以通过过滤实现钛与钒、钨分离。
(4)由流程图知,“热水解”时TiO2+转化为TiO2·xH2O,离子方程式为TiO2++(x+1)H2OTiO2·xH2O↓+2H+。(5)“煅烧”NH4VO3得到V2O5,V元素化合价不变,发生非氧化还原反应,根据原子守恒配平化学方程式为2NH4VO3V2O5+2NH3↑+H2O↑。
(6)“沉钨”时析出CaWO4的反应为Ca2++WO===CaWO4↓,加入过量CaCl2,可增大Ca2+浓度,促进CaWO4尽可能析出完全。
(7)根据Ca2++WO===CaWO4↓知,生成CaWO4沉淀需要20 mL 0.3 mol·L-1 CaCl2溶液,欲使WO浓度小于1×10-6 mol·L-1,则溶液中c(Ca2)> mol·L-1=9×10-3 mol·L-1,则加入的CaCl2溶液的最小浓度为0.3 mol·L-1+9×10-3 mol·L-1×2=0.318 mol·L-1。
10.(1)KClO3 在温度较高时H2O2易分解[或产物中的Fe3+可以催化H2O2的分解(其他合理答案也可,如H2O2氧化能力弱)]
(2)TiO2++CO(NH2)2+2H2OTiO2+CO2↑+2NH 避免将溶液中Fe3+沉淀
(3)TiO2+CaCl2·2H2OCaTiO3+2HCl↑+H2O↑
(4)2.7
(5)Fe(OH)3为絮状沉淀,不容易分离
解析:(1)根据题目要求结合图像,在50 min时酸解率大于85%的氧化剂有KMnO4和KClO3,但KMnO4作氧化剂引入了Mn2+,对后续的物质分离会造成干扰,故选用KClO3作氧化剂。(2)由TiO2+转化为TiO2可知,Ti元素的化合价并没有发生改变,该反应为非氧化还原反应,在酸性环境中,C、N元素的产物为CO2、NH;由于Fe3+开始沉淀需要的pH很小,直接通入NH3会使溶液pH快速增大,容易使Fe3+沉淀,所以使用尿素而不直接通入NH3,可以避免溶液中Fe3+沉淀。(3)由信息可知制备CaTiO3的反应为非氧化还原反应,根据元素守恒,剩余产物为HCl、H2O。(4)根据Fe(OH)3的Ksp=1.0×10-39和溶液中c(Fe3+)=1.0×10-5 mol·L-1可知,溶液中OH-的浓度为 mol·L-1≈1.0×10-11.3 mol·L-1,c(H+)===10-2.7 mol·L-1,所以pH为2.7。(5)氢氧化铁为絮状沉淀,不易于从溶液中分离,所以不采用加入氨水调节pH的方法制取Fe(OH)3。
11.(1)过滤
(2)FeTiO3+2H2SO4FeSO4+TiOSO4+2H2O 80%~85%
(3)TiO2++2H2OH2TiO3+2H+,水解反应是吸热反应,用热水促进平衡向正反应方向移动
(4)阴极 不能
解析:(1)步骤②、③、④中,均需进行的操作是过滤;(2)反应物为钛铁矿,生成物为FeSO4、TiOSO4及H2O,化学方程式为FeTiO3+2H2SO4FeSO4+TiOSO4+2H2O;根据图像可知硫酸质量分数在80%~85%之间时浸出率最大;(3)TiO2+在水溶液中发生水解TiO2++2H2O??H2TiO3+2H+,水解反应是吸热反应,用热水促进平衡向正反应方向移动,生成H2TiO3; (4)由TiO2生成Ti,Ti元素化合价降低发生还原反应,电解池中阴极得电子发生还原反应;若换成石灰乳,石灰乳中有水,阴极将产生氢气,无法得到金属钛,所以不能将熔融CaO换成石灰乳。
12.(1)增大接触面积,加快反应速度,提高浸取率
(2)MnTiO3+2H2SO4===MnSO4+TiOSO4+2H2O
(3)加热(或电泳)
(4)根据反应过程中颜色变化可以判断Fe2+是否氧化完全(或Fe2+、Fe3+存在时,加速H2O2分解,导致原料利用率太低,答案合理即可)
(5)升温可以加快反应速度,但超过45 ℃,NH4HCO3易分解,所以控制在45 ℃以下可以提高原料利用率(转化率)
(6)温度105 ℃,H+浓度0.90 g·L-1
(7)4
解析:(5)沉锰的反应为:MnSO4+2NH4HCO3===(NH4)2SO4+MnCO3↓+CO2↑+H2O,“沉锰”的条件一般控制在45 ℃以下的原因是升温可以加快反应速度,但超过45 ℃,NH4HCO3易分解,所以控制在45 ℃以下可以提高原料利用率(转化率)。
(7)由题中信息,在空气中加热无水MnCl2分解放出HCl,生成Mn3O4。200 ℃时,失去全部结晶水,∶=1∶x,x=4,所得氯化锰晶体x的值是4。
13.(1)FeTiO3+4H+===TiO2++Fe2++2H2O
(2)蒸发浓缩、冷却结晶、过滤
(3)调节溶液pH,促进TiO2+水解 TiO2++2H2OTiO(OH)2↓+2H+ 2.5
(4)避免Fe3+和TiO2+同时沉淀
解析:(1)钛铁矿酸浸时,发生反应的离子方程式为FeTiO3+4H+===TiO2++Fe2++2H2O。(2)向含有TiO2+、Fe2+、Fe3+等的酸性溶液中加入适量的Fe屑,发生反应:2Fe3++Fe===3Fe2+,然后将溶液蒸发浓缩、冷却结晶就会产生FeSO4·7H2O,然后将晶体过滤出来,就得到了绿矾。(3)滤液中含有大量的TiO2+,向该溶液中加入Na2CO3粉末,调整溶液的酸碱性,促进TiO2+的水解,由图像可知当溶液的pH=2.5 时,TiO(OH)2已经完全沉淀。(4)若不加入铁屑,就会同时产生TiO(OH)2和Fe(OH)3导致制取的物质纯度不高,所以加入铁屑将Fe3+转化为Fe2+,避免Fe3+和TiO2+同时沉淀。
14.(1)FeTiO3 FeTiO3+2H2SO4(浓)===TiOSO4+FeSO4+2H2O
(2)防止Fe2+被氧化 ①10 ②TiO2++2H2O===TiO(OH)2↓+2H+(或TiO2++2H2O===H2TiO3↓+2H+)
(3)TiO2+2C+2Cl2TiCl4+2CO 隔绝空气 稀盐酸
解析:(1)由2R+C2Fe+2TiO2+CO2↑,根据原子守恒,可推知钛酸亚铁的化学式为FeTiO3。钛酸亚铁和浓H2SO4反应,生成TiOSO4,无气体生成,元素Ti的化合价不变,说明发生非氧化还原反应,则产物中还有FeSO4,故该反应的化学方程式为FeTiO3+2H2SO4(浓)===TiOSO4+FeSO4+2H2O。(2)钛铁矿和浓硫酸反应的产物之一是FeSO4,加入铁屑,可防止Fe2+被氧化。①根据Ksp[Mg(OH)2]=c(Mg2+)·c2(OH-)=1.8×10-11,c(OH-)== mol·L-1=10-4mol·L-1,则c(H+)== mol·L-1=10-10 mol·L-1,pH=-lg10-10=10。②根据题表提供的Ksp数据知,三种物质组成类型相同且TiO(OH)2的溶度积常数最小,则加水稀释,立即析出的白色沉淀为TiO(OH)2,TiO2+的水解方程式为TiO2++2H2O===TiO(OH)2↓+2H+或TiO2++2H2O===H2TiO3↓+2H+。(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的化学方程式为TiO2+2C+2Cl2TiCl4+2CO;为防止空气中的氧气与反应物发生反应,应隔绝空气加热。可用稀盐酸除去钛中混有的镁。
15.(1)FeTiO3+2H2SO4TiOSO4+FeSO4+2H2O
(2)Fe 蒸发浓缩、冷却结晶、过滤
(3)加水稀释反应物 加碱中和生成的酸、加热等
(4)TiO2+4e-===Ti+2O2- 4 480
(5)Fe2++2HCO===FeCO3↓+CO2↑+H2O 1×10-5
解析:(1)因钛铁矿主要成分为FeTiO3,且滤液1中钛元素以TiO2+形式存在,所以其主要反应化学方程式为FeTiO3+2H2SO4TiOSO4+FeSO4+2H2O。(2)该流程中还有副产物FeSO4·7H2O,故需将溶浸产物中的Fe3+除去,物质A为Fe,“一系列操作”包括蒸发浓缩、冷却结晶、过滤。(3) “水解”反应为TiO2++(x+1)H2O===TiO2·xH2O↓+2H+,根据平衡移动原理,为提高TiO2·xH2O的产率可以加水稀释反应物、加碱中和生成的酸、加热等。(4)“电解”过程中阴极反应:TiO2+4e-===Ti+2O2-,阳极反应:2O2--4e-===O2↑,若制得金属Ti 9.60 g,则n(Ti)=n(O2)=0.2 mol,V(O2)=4 480 mL(标准状况下)。(5)由题意知该反应化学方程式为:Fe2++2HCO===FeCO3↓+CO2↑+H2O;由常温下FeCO3饱和溶液浓度为4.5×10-6 mol·L-1,Ksp(FeCO3)=2.025×10-11 mol2·L-2,则c(CO)==1.013×10-5 (mol·L-1)。
16.(1)+4 坩埚 CaSO4、CaSiO3
(2)TiOSO4+2H2OH2TiO3↓+H2SO4
(3)矿石粒度越小,反应物接触面积越大,反应速率越快
(4)B
(5)①当滴入最后一滴硫酸铁铵时,溶液变成红色,且30 s内不变回原色 ②%
解析:(1)设Ti的化合价为+x,(Mg0.5Fe0.5)Ti2O5化合价代数和等于0,(2×0.5+2×0.5)+2x-2×5=0,x=4;灼烧固体用坩埚;黑钛矿石[主要成分为(Mg0.5Fe0.5)Ti2O5,含有少量Al2Ca(SiO4)2]加入NH4HSO4焙烧后,加水过滤,沉淀中含有CaSO4 和CaSiO3;(2)由TiOSO4水解制备H2TiO3,反应方程式为:TiOSO4+2H2OH2TiO3↓+H2SO4;(3)由图中变量结合影响反应的速率、转化率的因素,矿石粒度对TiO2的提取率影响,原因是矿石粒度越小,反应物接触面积越大,反应速率越快;(4)由图读出:金属难溶化合物在不同pH下的溶解度(s,mol·L-1),步骤④应该控制的pH范围是:钛酸沉淀pH大于2,而氢氧化铝不沉淀,pH小于3,故选B;(5)①铁离子过量时,反应结束,故终点现象为:当滴入最后一滴硫酸铁铵时,溶液变成红色,且30 s内不变回原色;②由TiO2~Fe3+关系式,n(TiO2)=n(Fe3+)=b mol· L-1×V×10-3 L×100 mL/20 mL=5bV×10-3 mol,TiO2纯度为5bV×10-3 mol×80 g·mol-1/a g×100%=%。
17.(1)第四周期第Ⅷ族
(2)TiO2++2H2OH2TiO3↓+2H+ 防止Fe2+被氧化为Fe3+ 消耗多余的硫酸
(3)蒸发浓缩 冷却结晶
(4)FeSO4·7H2O(写成FeSO4也可)
(5)2Cl2+TiO2+2CTiCl4+2CO
解析:(1)Fe在元素周期表中位于第四周期第Ⅷ族。(2)根据题意可知,TiO2+水解时,结合水电离出的OH-生成H2TiO3。由于Fe2+易被氧化,故加入过量铁粉可以防止Fe2+被氧化为Fe3+;加入的过量铁粉还可以消耗溶解钛铁矿时多余的硫酸。(3)经过操作1得到含TiO2+的滤液和副产品,则操作1为蒸发浓缩、冷却结晶、过滤。(4)依据流程图及原子守恒可知副产品为硫酸亚铁晶体。(5)该反应中氯气作氧化剂,焦炭作还原剂,根据焦炭过量可以确定产物中有CO,根据得失电子守恒和原子守恒配平化学方程式即可。
18.(1)非氧化还原反应 FeTiO3+2H2SO4===TiOSO4+FeSO4+2H2O
(2)H2TiO3TiO2+H2O、TiO2+2Cl2+2CTiCl4+2CO
(3)Ti在高温下化合能力极强,在氩气氛围中可防止其与O2、N2等化合 稀盐酸
(4)TiO2(熔融)Ti+O2↑
(5)6m=19n+6mw
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
