4.1.1原子结构、核素课件(20张)高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1.1原子结构、核素课件(20张)高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 64.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-28 22:30:39 | ||
图片预览








文档简介
(共20张PPT)
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
第一课时 原子结构 核素
科学史话
道尔顿模型(1803年):
原子是构成物质的基本粒子,它们是坚实的、不可再分的实心球。
科学史话
汤姆孙原子模型(1904年):原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成中性原子。
汤姆孙原子模型
科学史话
卢瑟福原子模型(1911年):在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。
科学史话
玻尔原子模型(1913年):电子在原子核外空间的一定轨道上绕核做高速圆周运动。
玻尔原子模型
科学史话
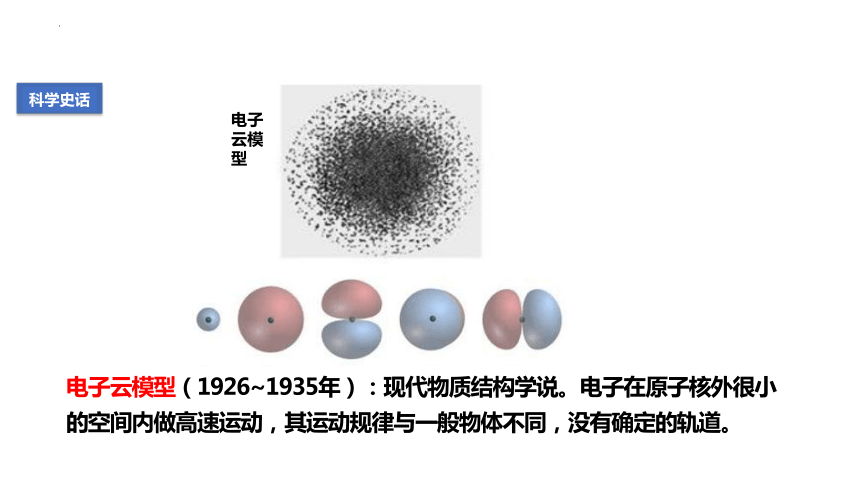
电子云模型(1926~1935年):现代物质结构学说。电子在原子核外很小的空间内做高速运动,其运动规律与一般物体不同,没有确定的轨道。
电子云模型
原子结构模型的演变历程
道尔顿模型(1803年):
坚实的、不可再分实心球
汤姆孙原子模型(1904年):
平均分布着正电荷的粒子,镶嵌着许多电子,中和了正电荷,从而形成中性原子。
卢瑟福原子模型(1911年):
中心有一个带正电荷的核,电子在它的周围沿着不同轨道运转,就像行星环绕太阳运转一样。
玻尔原子模型(1913年):
电子在原子核外空间的一定轨道上绕核做高速圆周运动。
电子云模型
电子云模型
现代物质结构学说
一、原子的构成
原子核
核外电子
质子
中子
原子
X
A
Z
(Z个)
(带正电)
(不带电)
(带负电)
①质量数(A)= 质子数(Z)+ 中子数(N)≈ 相对原子质量
②原子序数=核电荷数=质子数=核外电子数
质量数:原子核内核内所有质子和中子的相对质量取近似整数值相加所得的数值。
原子呈电中性
阳离子核外电子数 = 质子数 - 离子所带电荷数
阴离子核外电子数 = 质子数 + 离子所带电荷数
X
A
Z
m±
n
±c
元素化合价
微粒所带电荷数
原子个数
质子数
质量数
一、原子的构成
1.原子结构示意图
+11
2 8 1
原子核
质子数
或核电荷数
电子层
各层的电子数
二、原子的核外电子排布
二、原子的核外电子排布
2.电子层的表示方法
序数 1 2 3 4 5 6 7
符号 K L M N O P Q
离核距离: 近 ——→ 远
电子能量: 低 ——→ 高
3.核外电子排布规律
(1)能量最低原理
核外电子总是优先排布在能量最低的电子层里,然后再由里往外排布在能量逐步升高的电子层里,即按K→L→M→N……顺序排列。
二、原子的核外电子排布
3.核外电子排布规律
元素 各电子层的电子数
K L M N O P
2He(氦) 2
10Ne(氖) 2 8
18Ar(氩) 2 8 8
36Kr(氪) 2 8 18 8
54Xe(氙) 2 8 18 18 8
86Rn(氡) 2 8 18 32 18 8
① 各电子层最多容纳_______个电子
② 最外层电子数不超过_____个
(K层为最外层时不超过______个)
③ 次外层电子数不超过_____个
(当K层为次外层时不超过___个)
(当L层为次外层时不超过___个)
④ 倒数第三层电子数不超过______个
2n2
8
2
18
2
8
32
(2)电子层最多容纳的电子数
常见的10e-和18e-微粒
F-、O2-、N3-、OH-
HF、H2O、NH3、CH4
Na+、Mg2+、Al3+、、H3O+
(2)常见的18e-微粒
H2S
F2
K+、Ca2+
(1)常见的10e-微粒
周期表中有118种元素,是不是就只有118种原子呢?试分析下列三种原子结构的异同?它们是不是同一种元素?
请填写三种氢原子的原子符号:
氢元素的原子核 原子名称 原子符号
质子数(Z) 中子数(N)
1 0 氕
1 1 氘
1 2 氚
X
A
Z
质子数相同而中子数不同,它们是同一种元素。
或D
或T
二、核素、同位素
二、核素、同位素
元素:具有相同质子数(核电荷数)的一类原子的总称。
(2)核素:
把具有一定数目质子和一定数目中子的一种原子叫做核素,如、、就各为一种核素。
(1)同位素:
质子数相同而中子数不同的同一元素的不同原子,互称同位素(即同一元素的不同核素互称为同位素)。
(3)同素异形体:由同种元素形成的不同单质,互称为同素异形体。
如:氧气和臭氧、石墨和金刚石、红磷和白磷。
核组成
质子数
中子数
质量数
学 名
俗 称
1
1
1
1
1
0
2
3
2
氕
氘
氚
重氢
超重氢
H
1
1
H
2
1
H
3
1
(D)
(T)
统称为氢元素
单独称为核素
互称为同位素
三、元素、核素、同位素和同素异形体
同位素:
质子数相同而中子数不同的同一元素的不同原子,互称同位素(即同一元素的不同核素互称为同位素)。
(1)O2和O3互为同位素吗?H2O和D2O互为同位素吗?
(1)14C在考古中推断文物的年代;
(2)2H、3H制造氢弹的原料;
(3)235U核反应堆的燃料;
(4)12C相对原子质量的标准原子
(5)放射性同位素释放的射线可用于育种、治疗恶性肿瘤等。
2.同位素的应用
1.(2023·石家庄二中高一检测)下列关于电子排布的说法正确的是
A.氧离子(O2-)的核电荷数与最外层电子数相等
B.在多电子的原子中,能量高的电子通常在离核近的区域内运动
C.核外电子总是先排在能量高的电子层上
D.对于简单离子来说,最外层电子数一定为2或8
√
8
8
远
低
如H+最外层没有电子
2.太空探索器常用制成的核电池提供动力,该钚原子的中子数与核外电子数之差为
A.238 B.144 C.94 D.50
√
3.与Na+具有相同电子数和质子数的微粒是
A.OH- B.H2O
C.CH4 D.
√
238-94=144
94
10 11
电子数:10,质子数:9
电子数:10,质子数:10
电子数:10,质子数:10
电子数:10,质子数:11
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
第一课时 原子结构 核素
科学史话
道尔顿模型(1803年):
原子是构成物质的基本粒子,它们是坚实的、不可再分的实心球。
科学史话
汤姆孙原子模型(1904年):原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成中性原子。
汤姆孙原子模型
科学史话
卢瑟福原子模型(1911年):在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。
科学史话
玻尔原子模型(1913年):电子在原子核外空间的一定轨道上绕核做高速圆周运动。
玻尔原子模型
科学史话
电子云模型(1926~1935年):现代物质结构学说。电子在原子核外很小的空间内做高速运动,其运动规律与一般物体不同,没有确定的轨道。
电子云模型
原子结构模型的演变历程
道尔顿模型(1803年):
坚实的、不可再分实心球
汤姆孙原子模型(1904年):
平均分布着正电荷的粒子,镶嵌着许多电子,中和了正电荷,从而形成中性原子。
卢瑟福原子模型(1911年):
中心有一个带正电荷的核,电子在它的周围沿着不同轨道运转,就像行星环绕太阳运转一样。
玻尔原子模型(1913年):
电子在原子核外空间的一定轨道上绕核做高速圆周运动。
电子云模型
电子云模型
现代物质结构学说
一、原子的构成
原子核
核外电子
质子
中子
原子
X
A
Z
(Z个)
(带正电)
(不带电)
(带负电)
①质量数(A)= 质子数(Z)+ 中子数(N)≈ 相对原子质量
②原子序数=核电荷数=质子数=核外电子数
质量数:原子核内核内所有质子和中子的相对质量取近似整数值相加所得的数值。
原子呈电中性
阳离子核外电子数 = 质子数 - 离子所带电荷数
阴离子核外电子数 = 质子数 + 离子所带电荷数
X
A
Z
m±
n
±c
元素化合价
微粒所带电荷数
原子个数
质子数
质量数
一、原子的构成
1.原子结构示意图
+11
2 8 1
原子核
质子数
或核电荷数
电子层
各层的电子数
二、原子的核外电子排布
二、原子的核外电子排布
2.电子层的表示方法
序数 1 2 3 4 5 6 7
符号 K L M N O P Q
离核距离: 近 ——→ 远
电子能量: 低 ——→ 高
3.核外电子排布规律
(1)能量最低原理
核外电子总是优先排布在能量最低的电子层里,然后再由里往外排布在能量逐步升高的电子层里,即按K→L→M→N……顺序排列。
二、原子的核外电子排布
3.核外电子排布规律
元素 各电子层的电子数
K L M N O P
2He(氦) 2
10Ne(氖) 2 8
18Ar(氩) 2 8 8
36Kr(氪) 2 8 18 8
54Xe(氙) 2 8 18 18 8
86Rn(氡) 2 8 18 32 18 8
① 各电子层最多容纳_______个电子
② 最外层电子数不超过_____个
(K层为最外层时不超过______个)
③ 次外层电子数不超过_____个
(当K层为次外层时不超过___个)
(当L层为次外层时不超过___个)
④ 倒数第三层电子数不超过______个
2n2
8
2
18
2
8
32
(2)电子层最多容纳的电子数
常见的10e-和18e-微粒
F-、O2-、N3-、OH-
HF、H2O、NH3、CH4
Na+、Mg2+、Al3+、、H3O+
(2)常见的18e-微粒
H2S
F2
K+、Ca2+
(1)常见的10e-微粒
周期表中有118种元素,是不是就只有118种原子呢?试分析下列三种原子结构的异同?它们是不是同一种元素?
请填写三种氢原子的原子符号:
氢元素的原子核 原子名称 原子符号
质子数(Z) 中子数(N)
1 0 氕
1 1 氘
1 2 氚
X
A
Z
质子数相同而中子数不同,它们是同一种元素。
或D
或T
二、核素、同位素
二、核素、同位素
元素:具有相同质子数(核电荷数)的一类原子的总称。
(2)核素:
把具有一定数目质子和一定数目中子的一种原子叫做核素,如、、就各为一种核素。
(1)同位素:
质子数相同而中子数不同的同一元素的不同原子,互称同位素(即同一元素的不同核素互称为同位素)。
(3)同素异形体:由同种元素形成的不同单质,互称为同素异形体。
如:氧气和臭氧、石墨和金刚石、红磷和白磷。
核组成
质子数
中子数
质量数
学 名
俗 称
1
1
1
1
1
0
2
3
2
氕
氘
氚
重氢
超重氢
H
1
1
H
2
1
H
3
1
(D)
(T)
统称为氢元素
单独称为核素
互称为同位素
三、元素、核素、同位素和同素异形体
同位素:
质子数相同而中子数不同的同一元素的不同原子,互称同位素(即同一元素的不同核素互称为同位素)。
(1)O2和O3互为同位素吗?H2O和D2O互为同位素吗?
(1)14C在考古中推断文物的年代;
(2)2H、3H制造氢弹的原料;
(3)235U核反应堆的燃料;
(4)12C相对原子质量的标准原子
(5)放射性同位素释放的射线可用于育种、治疗恶性肿瘤等。
2.同位素的应用
1.(2023·石家庄二中高一检测)下列关于电子排布的说法正确的是
A.氧离子(O2-)的核电荷数与最外层电子数相等
B.在多电子的原子中,能量高的电子通常在离核近的区域内运动
C.核外电子总是先排在能量高的电子层上
D.对于简单离子来说,最外层电子数一定为2或8
√
8
8
远
低
如H+最外层没有电子
2.太空探索器常用制成的核电池提供动力,该钚原子的中子数与核外电子数之差为
A.238 B.144 C.94 D.50
√
3.与Na+具有相同电子数和质子数的微粒是
A.OH- B.H2O
C.CH4 D.
√
238-94=144
94
10 11
电子数:10,质子数:9
电子数:10,质子数:10
电子数:10,质子数:10
电子数:10,质子数:11
