九年级化学(科粤版)上精品学案:5.2组成燃料的主要元素——碳
文档属性
| 名称 | 九年级化学(科粤版)上精品学案:5.2组成燃料的主要元素——碳 |

|
|
| 格式 | zip | ||
| 文件大小 | 7.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-16 10:10:44 | ||
图片预览



文档简介
5.2 组成燃料的主要元素——碳
1.了解金刚石、石墨、C60的物理性质及主要用途,明确物质的性质与用途的关系。
2.认识碳的燃烧及其产物。
3.了解CO的性质,理解碳与一些含碳化合物的相互转变关系。
1.碳有哪些单质
金刚石和石墨都是由碳元素组成的,为什么它们从外观上差别那么大呢?它们各有什么特性?
(1)金刚石、石墨
①活动与探究
实验
现象
结论
用玻璃刀刻划玻璃
划出痕迹
坚硬
观察铅笔芯和从干电池中取下的石墨电极的颜色
削下一些铅笔芯粉末,用手指摸一下,感觉
感觉到滑
有滑腻感
手拿铅笔芯在酒精灯火焰上加热,观察有无变化
铅笔芯无变化,手感到热
导热
按图所示,将一根铅笔芯或石墨电极连接在电路中,接通电源后,观察灯泡是否发亮
灯亮
有导电性
金刚石:坚硬石墨:质地软,有滑腻感,能导热、导电
哇!物理性质差别真的很大!真是太奇怪了!
②物理性质和用途对比
金刚石
石墨
富勒烯(以C60为例)
外观
无色透明、正八面体状的固体
深灰色、有金属光泽、细鳞片状固体
C60分子形似足球,有金属光泽的固体
硬度
天然最硬的物质
最软的矿物之一——有滑腻感
质脆
熔点
很高
很高
很高
导热性
很差
优良
很差
导电性
不导电
优良
不导电
用途
玻璃刀、钻探机上的钻头、装饰品等
电极、高温润滑剂、制铅笔芯等
制备新材料、超导体等
金刚石、石墨、富勒烯(以C60为例)都是碳的不同单质,由于各单质中碳原子的排列方式不同(如下图所示),产生了不相同的物理性质。
【例1—1】“轻轨列车”是近年来又一新兴的交通工具,该车以电为动力、具有无污染的优点。当轻轨列车开动时,在轻轨列车顶上的导电杆跟架空电线的接触点处分别装上一块石墨制成的滑块(如下图所示),以保证行驶时供电。为什么要选用石墨来制滑块?
解析:
↓ ↓
↓ ↓
↑
答案:石墨具有润滑、耐高温、良好的导电性的性质。
(2)无定形碳
我们经常用到的木炭、活性炭也是碳的单质吗?
木炭、活性炭、焦炭、炭黑等都是由石墨的细小晶体与少量杂质形成的,被称为“无定形碳”,属于混合物。
①几种无定形碳的用途
木炭
活性炭
焦炭
炭黑
作燃料、吸附剂、制造黑火药
净水剂、脱色剂、去味剂、滤毒剂
冶炼金属、生产水煤气
油墨、颜料、橡胶轮胎中的填充剂
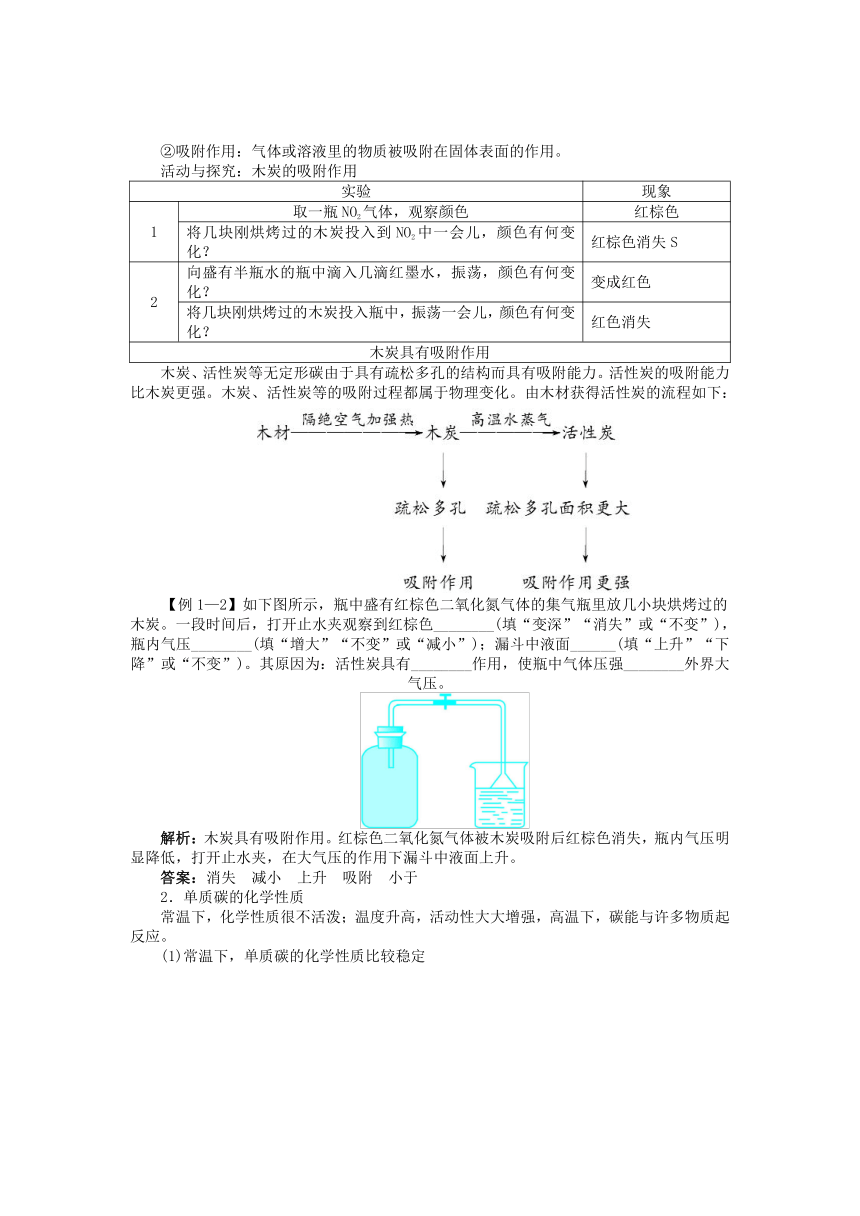
②吸附作用:气体或溶液里的物质被吸附在固体表面的作用。
活动与探究:木炭的吸附作用
实验
现象
1
取一瓶NO2气体,观察颜色
红棕色
将几块刚烘烤过的木炭投入到NO2中一会儿,颜色有何变化?
红棕色消失S
2
向盛有半瓶水的瓶中滴入几滴红墨水,振荡,颜色有何变化?
变成红色
将几块刚烘烤过的木炭投入瓶中,振荡一会儿,颜色有何变化?
红色消失
木炭具有吸附作用
木炭、活性炭等无定形碳由于具有疏松多孔的结构而具有吸附能力。活性炭的吸附能力比木炭更强。木炭、活性炭等的吸附过程都属于物理变化。由木材获得活性炭的流程如下:
【例1—2】如下图所示,瓶中盛有红棕色二氧化氮气体的集气瓶里放几小块烘烤过的木炭。一段时间后,打开止水夹观察到红棕色________(填“变深”“消失”或“不变”),瓶内气压________(填“增大”“不变”或“减小”);漏斗中液面______(填“上升”“下降”或“不变”)。其原因为:活性炭具有________作用,使瓶中气体压强________外界大气压。
解析:木炭具有吸附作用。红棕色二氧化氮气体被木炭吸附后红棕色消失,瓶内气压明显降低,打开止水夹,在大气压的作用下漏斗中液面上升。
答案:消失 减小 上升 吸附 小于
2.单质碳的化学性质
常温下,化学性质很不活泼;温度升高,活动性大大增强,高温下,碳能与许多物质起反应。
(1)常温下,单质碳的化学性质比较稳定
古代字画
我国古代用墨写的字、绘的画历经数百年乃至数千年为什么不褪色?
常温下,单质碳化比较稳定,不易跟其他物质发生化学反应。
【例2—1】全球钻石大鳄南非戴比尔斯珠宝公司“钻石恒久远,一颗永流传”这句广告词被美国《广告时代》评为20世纪的经典广告之一。该广告词能体现钻石的性质是( )。
A.硬度大
B.不能导电
C.化学性质稳定
D.熔点低
解析:本题通过一则经典的广告词,从化学的角度考查了金刚石的特性。这样的取材,拉近了科学与生活的距离。
答案:C
(2)高温下,单质碳的化学性质比较活泼,能与许多物质起反应
①碳与氧气的反应——可燃性
氧气充足,碳完全燃烧生成二氧化碳:
C+O2CO2(热值为32.8
kJ·g-1)
氧气不充足,碳不完全燃烧生成一氧化碳:
2C+O22CO(热值为9.2
kJ·g-1,只有完全燃烧热值的1/3.6)
②碳与二氧化碳的反应——还原性
高温条件下,炽热的木炭可使二氧化碳转变成一氧化碳。
C+CO22CO(吸热)
(1)常温下,单质碳的化学性质很不活泼。
(2)高温下,单质碳的化学性质比较活泼:
①可燃性C+O2CO2(氧气充足);
2C+O22CO(氧气不充足)
②还原性C+CO22CO。
【例2—2】有关碳的化学性质的叙述错误的是( )。
A.碳和氧气反应时,产物可以是CO2也可以是CO
B.碳和氧气的反应无论产物是什么,都是吸热反应
C.碳和氧气的反应无论产物是什么,都是放热反应
D.灼热的碳能还原二氧化碳
解析:碳和氧气反应时,氧气充足产物是CO2,氧气不充足产物是CO;燃烧都放出热量;高温时碳能还原二氧化碳生成一氧化碳。所以A、C、D都是正确的。B是错误的。
答案:B
3.一氧化碳的性质
(1)物理性质:一氧化碳是无色、无味、难溶于水的气体,密度比空气的小。
(2)特性:有毒。
血液中血红蛋白与一氧化碳的结合能力比与氧的结合能力要强200多倍,而且,血红蛋白与氧的分离速度却很慢。所以,人一旦吸入一氧化碳,氧便失去了与血红蛋白结合的机会,使组织细胞无法从血液中获得足够的氧气,造成人体缺氧,严重时危及生命。
(3)化学性质——可燃性
实验
现象
结论
①在盛放一氧化碳贮存瓶的导管口点燃气体,观察现象
蓝色火焰
CO能燃烧
②在火焰上方罩上一个冷而干燥的烧杯,过一会儿,观察现象
拿烧杯的手感到发烫
放热
③将烧杯迅速倒过来,注入少量澄清的石灰水,振荡,观察现象
澄清的石灰水变浑浊
生成二氧化碳
一氧化碳能燃烧:2CO+O22CO2;使用一氧化碳时,一定要检验其纯度。
观察煤炉里煤的燃烧(如下图所示):
煤炉里煤层上方的蓝色火焰,就是一氧化碳燃烧产生的。
【例3】下图是煤在煤炉中燃烧的剖面示意图。请完成下列问题:
(1)写出炉膛内A段发生反应产生蓝色火焰的化学方程式:________________;
(2)写出炉膛内B段可能发生的反应的化学方程式:________________;
(3)封闭不严的煤炉在缓慢燃烧过程中产生大量的剧毒气体CO,请制订出对这种煤炉的防毒措施:________________。
解析:(1)煤炉里煤层上方的蓝色火焰,就是一氧化碳在燃烧产生的。(2)炉膛内B段:最底层氧气充足,煤能完全燃烧,发生的反应是C+O2CO2;中、上层氧气不充足,煤不能完全燃烧,发生的反应是2C+O22CO;而下部反应生成的CO2通过中、上层炽热的煤炭发生反应C+CO22CO。(3)封闭不严的煤炉在缓慢燃烧过程中产生大量的剧毒气体CO,可采用二次进风到煤炉内的上层部位,使CO燃烧,也可安装烟囱引出室外(合理方法均可)。
答案:(1)2CO+O22CO2 (2)2C+O22CO C+O2CO2 C+CO22CO (3)改变炉体结构,采用二次进风(或安装烟囱或打开窗户通风。合理答案均可)
4.一氧化碳和二氧化碳性质的比较
CO
CO2
物理性质
无色、无味气体,难溶于水,密度比空气小
无色、无味气体,能溶于水,密度比空气大
化学性质
剧毒
无毒性
2CO+O22CO2
CO2+H2O===H2CO3
CO2+Ca(OH)2===CaCO3↓+
H2O
C+CO22CO
环境影响
污染空气
造成温室效应
用途
燃料
灭火、气体肥料、化工原料
转换
2CO+O22CO2,C+CO22CO
【例4】现有a、b两个塑料软瓶,a瓶内装有CO和O2的混合气体,b瓶内装有CO2气体。某同学从野外捉来了两只活蝗虫,分别放入两个塑料软瓶中,拧紧瓶盖。结果,两只蝗虫很快都死了。请根据下面所给选项,分析a瓶中造成蝗虫死亡的主要原因是( )。
A.没有食物
B.气体不能供给呼吸
C.气体有毒
D.活动空间大小
解析:CO有毒,a瓶内蝗虫中毒死亡;CO2无毒,b瓶内蝗虫缺氧窒息死亡。
答案:C
一氧化碳有剧毒,会使人、动物等中毒,甚至死亡;二氧化碳没有毒性,会使人、动物等窒息死亡。
5.单质碳和一氧化碳的比较
物质
化学性质
用途
C
C+O2CO2
燃料
2C+O22CO
CO
2CO+O22CO2
燃料
一氧化碳是碳不充分燃烧的产物,但是它们的化学性质却非常地相似,都具有可燃性,因而都能作燃料。
使用煤作燃料应注意加大通入空气的量,以防燃料不充分燃烧造成燃料的浪费和环境污染;以CO作燃料要防止泄漏扩散,以免发生中毒事故。
解答此类题,要充分认识发生反应的环境对反应产物的影响(量变引起质变等),还要考虑生成物对环境的影响。
【例5】下图是二次进风节煤炉示意图(煤的主要成分是碳)。
(1)分析煤炉中发生的化学反应,写出各部位的一个主要反应方程式:
煤炉底部______________;
煤炉中部________________;
煤炉上部________________。
(2)同一次进风炉相比,二次进风炉为什么能节煤,并能减少污染?
解析:煤炉底部空气充足,煤充分燃烧生成CO2;CO2流经中部时与炽热的碳反应生成CO;CO在上部又与二次通风口的氧气反应生成CO2,从而使燃料燃烧更加充分。
答案:(1)C+O2CO2 C+CO22CO 2CO+O22CO2 (2)二次进风增加了氧气的量,从而使燃料燃烧更加充分。
6.利用极值法分析碳燃烧的产物
极值法就是对数据不足无从下手的计算或混合物组成判断的题,极端假设恰好为某一成分,或者极端假设为恰好完全反应,以确定混合体系各成分的名称、质量分数、体积分数的解题方法。
高温时,碳在氧气中燃烧的产物因氧气质量的不同而不同。
若氧气充足,碳充分燃烧:
C+O2CO2;
12 32 44
若氧气不充足,碳不能充分燃烧:
2C+O22CO(C+CO22CO)
24
56 12 56
讨论:
(1)氧气充足,碳能充分燃烧,产物只有二氧化碳时,参加反应的碳与氧气的质量比为=;
(2)氧气不充足,碳不能充分燃烧,且产物只有一氧化碳时,参加反应的碳与氧气的质量比为=;
(3)氧气不充足,碳不能充分燃烧,产物为二氧化碳和一氧化碳的混合物时,参加反应的碳与氧气的质量比为<<。
【例6】3
g木炭和6
g氧气在密闭的容器中完全反应后,下列叙述中正确的是( )。
A.产物全部是CO
B.产物全部是CO2
C.产物是CO和CO2的混合物
D.木炭过量,产物为CO
解析:碳与氧气反应在不同的条件下生成的产物不同。此题涉及的化学反应有:C+O2CO2 ① 2C+O22CO ② C+CO22CO ③
设木炭和氧气的质量比为x,则
(1)假设反应按①进行,此时木炭和氧气的质量比为:
x==
(2)假设反应按②进行,此时木炭和氧气的质量比为:
x=2×=
综合起来,可得如下结论:
当x≤时,发生反应①,产物为CO2;
当x≥时,发生反应②,产物为CO;
当<x<时,木炭对反应①过量而对反应②不足,发生反应①后,过量的木炭还要发生反应:C+CO22CO,使一部分CO2转化为CO,产物为CO2和CO。
题中给出木炭和氧气的质量比为=。因为<<,所以产物为CO2和CO的混合物。
答案:C
3
g木炭和6
g氧气在密闭的容器中完全反应发生哪一个反应,题意没有说明,我们必须运用极值法经讨论来确定它;由化学反应方程式可以看出,发生的反应是由木炭和氧气的质量比来决定的,因此,讨论的关键点是题中所给的木炭和氧气的质量比符合哪一种情况。
1.了解金刚石、石墨、C60的物理性质及主要用途,明确物质的性质与用途的关系。
2.认识碳的燃烧及其产物。
3.了解CO的性质,理解碳与一些含碳化合物的相互转变关系。
1.碳有哪些单质
金刚石和石墨都是由碳元素组成的,为什么它们从外观上差别那么大呢?它们各有什么特性?
(1)金刚石、石墨
①活动与探究
实验
现象
结论
用玻璃刀刻划玻璃
划出痕迹
坚硬
观察铅笔芯和从干电池中取下的石墨电极的颜色
削下一些铅笔芯粉末,用手指摸一下,感觉
感觉到滑
有滑腻感
手拿铅笔芯在酒精灯火焰上加热,观察有无变化
铅笔芯无变化,手感到热
导热
按图所示,将一根铅笔芯或石墨电极连接在电路中,接通电源后,观察灯泡是否发亮
灯亮
有导电性
金刚石:坚硬石墨:质地软,有滑腻感,能导热、导电
哇!物理性质差别真的很大!真是太奇怪了!
②物理性质和用途对比
金刚石
石墨
富勒烯(以C60为例)
外观
无色透明、正八面体状的固体
深灰色、有金属光泽、细鳞片状固体
C60分子形似足球,有金属光泽的固体
硬度
天然最硬的物质
最软的矿物之一——有滑腻感
质脆
熔点
很高
很高
很高
导热性
很差
优良
很差
导电性
不导电
优良
不导电
用途
玻璃刀、钻探机上的钻头、装饰品等
电极、高温润滑剂、制铅笔芯等
制备新材料、超导体等
金刚石、石墨、富勒烯(以C60为例)都是碳的不同单质,由于各单质中碳原子的排列方式不同(如下图所示),产生了不相同的物理性质。
【例1—1】“轻轨列车”是近年来又一新兴的交通工具,该车以电为动力、具有无污染的优点。当轻轨列车开动时,在轻轨列车顶上的导电杆跟架空电线的接触点处分别装上一块石墨制成的滑块(如下图所示),以保证行驶时供电。为什么要选用石墨来制滑块?
解析:
↓ ↓
↓ ↓
↑
答案:石墨具有润滑、耐高温、良好的导电性的性质。
(2)无定形碳
我们经常用到的木炭、活性炭也是碳的单质吗?
木炭、活性炭、焦炭、炭黑等都是由石墨的细小晶体与少量杂质形成的,被称为“无定形碳”,属于混合物。
①几种无定形碳的用途
木炭
活性炭
焦炭
炭黑
作燃料、吸附剂、制造黑火药
净水剂、脱色剂、去味剂、滤毒剂
冶炼金属、生产水煤气
油墨、颜料、橡胶轮胎中的填充剂
②吸附作用:气体或溶液里的物质被吸附在固体表面的作用。
活动与探究:木炭的吸附作用
实验
现象
1
取一瓶NO2气体,观察颜色
红棕色
将几块刚烘烤过的木炭投入到NO2中一会儿,颜色有何变化?
红棕色消失S
2
向盛有半瓶水的瓶中滴入几滴红墨水,振荡,颜色有何变化?
变成红色
将几块刚烘烤过的木炭投入瓶中,振荡一会儿,颜色有何变化?
红色消失
木炭具有吸附作用
木炭、活性炭等无定形碳由于具有疏松多孔的结构而具有吸附能力。活性炭的吸附能力比木炭更强。木炭、活性炭等的吸附过程都属于物理变化。由木材获得活性炭的流程如下:
【例1—2】如下图所示,瓶中盛有红棕色二氧化氮气体的集气瓶里放几小块烘烤过的木炭。一段时间后,打开止水夹观察到红棕色________(填“变深”“消失”或“不变”),瓶内气压________(填“增大”“不变”或“减小”);漏斗中液面______(填“上升”“下降”或“不变”)。其原因为:活性炭具有________作用,使瓶中气体压强________外界大气压。
解析:木炭具有吸附作用。红棕色二氧化氮气体被木炭吸附后红棕色消失,瓶内气压明显降低,打开止水夹,在大气压的作用下漏斗中液面上升。
答案:消失 减小 上升 吸附 小于
2.单质碳的化学性质
常温下,化学性质很不活泼;温度升高,活动性大大增强,高温下,碳能与许多物质起反应。
(1)常温下,单质碳的化学性质比较稳定
古代字画
我国古代用墨写的字、绘的画历经数百年乃至数千年为什么不褪色?
常温下,单质碳化比较稳定,不易跟其他物质发生化学反应。
【例2—1】全球钻石大鳄南非戴比尔斯珠宝公司“钻石恒久远,一颗永流传”这句广告词被美国《广告时代》评为20世纪的经典广告之一。该广告词能体现钻石的性质是( )。
A.硬度大
B.不能导电
C.化学性质稳定
D.熔点低
解析:本题通过一则经典的广告词,从化学的角度考查了金刚石的特性。这样的取材,拉近了科学与生活的距离。
答案:C
(2)高温下,单质碳的化学性质比较活泼,能与许多物质起反应
①碳与氧气的反应——可燃性
氧气充足,碳完全燃烧生成二氧化碳:
C+O2CO2(热值为32.8
kJ·g-1)
氧气不充足,碳不完全燃烧生成一氧化碳:
2C+O22CO(热值为9.2
kJ·g-1,只有完全燃烧热值的1/3.6)
②碳与二氧化碳的反应——还原性
高温条件下,炽热的木炭可使二氧化碳转变成一氧化碳。
C+CO22CO(吸热)
(1)常温下,单质碳的化学性质很不活泼。
(2)高温下,单质碳的化学性质比较活泼:
①可燃性C+O2CO2(氧气充足);
2C+O22CO(氧气不充足)
②还原性C+CO22CO。
【例2—2】有关碳的化学性质的叙述错误的是( )。
A.碳和氧气反应时,产物可以是CO2也可以是CO
B.碳和氧气的反应无论产物是什么,都是吸热反应
C.碳和氧气的反应无论产物是什么,都是放热反应
D.灼热的碳能还原二氧化碳
解析:碳和氧气反应时,氧气充足产物是CO2,氧气不充足产物是CO;燃烧都放出热量;高温时碳能还原二氧化碳生成一氧化碳。所以A、C、D都是正确的。B是错误的。
答案:B
3.一氧化碳的性质
(1)物理性质:一氧化碳是无色、无味、难溶于水的气体,密度比空气的小。
(2)特性:有毒。
血液中血红蛋白与一氧化碳的结合能力比与氧的结合能力要强200多倍,而且,血红蛋白与氧的分离速度却很慢。所以,人一旦吸入一氧化碳,氧便失去了与血红蛋白结合的机会,使组织细胞无法从血液中获得足够的氧气,造成人体缺氧,严重时危及生命。
(3)化学性质——可燃性
实验
现象
结论
①在盛放一氧化碳贮存瓶的导管口点燃气体,观察现象
蓝色火焰
CO能燃烧
②在火焰上方罩上一个冷而干燥的烧杯,过一会儿,观察现象
拿烧杯的手感到发烫
放热
③将烧杯迅速倒过来,注入少量澄清的石灰水,振荡,观察现象
澄清的石灰水变浑浊
生成二氧化碳
一氧化碳能燃烧:2CO+O22CO2;使用一氧化碳时,一定要检验其纯度。
观察煤炉里煤的燃烧(如下图所示):
煤炉里煤层上方的蓝色火焰,就是一氧化碳燃烧产生的。
【例3】下图是煤在煤炉中燃烧的剖面示意图。请完成下列问题:
(1)写出炉膛内A段发生反应产生蓝色火焰的化学方程式:________________;
(2)写出炉膛内B段可能发生的反应的化学方程式:________________;
(3)封闭不严的煤炉在缓慢燃烧过程中产生大量的剧毒气体CO,请制订出对这种煤炉的防毒措施:________________。
解析:(1)煤炉里煤层上方的蓝色火焰,就是一氧化碳在燃烧产生的。(2)炉膛内B段:最底层氧气充足,煤能完全燃烧,发生的反应是C+O2CO2;中、上层氧气不充足,煤不能完全燃烧,发生的反应是2C+O22CO;而下部反应生成的CO2通过中、上层炽热的煤炭发生反应C+CO22CO。(3)封闭不严的煤炉在缓慢燃烧过程中产生大量的剧毒气体CO,可采用二次进风到煤炉内的上层部位,使CO燃烧,也可安装烟囱引出室外(合理方法均可)。
答案:(1)2CO+O22CO2 (2)2C+O22CO C+O2CO2 C+CO22CO (3)改变炉体结构,采用二次进风(或安装烟囱或打开窗户通风。合理答案均可)
4.一氧化碳和二氧化碳性质的比较
CO
CO2
物理性质
无色、无味气体,难溶于水,密度比空气小
无色、无味气体,能溶于水,密度比空气大
化学性质
剧毒
无毒性
2CO+O22CO2
CO2+H2O===H2CO3
CO2+Ca(OH)2===CaCO3↓+
H2O
C+CO22CO
环境影响
污染空气
造成温室效应
用途
燃料
灭火、气体肥料、化工原料
转换
2CO+O22CO2,C+CO22CO
【例4】现有a、b两个塑料软瓶,a瓶内装有CO和O2的混合气体,b瓶内装有CO2气体。某同学从野外捉来了两只活蝗虫,分别放入两个塑料软瓶中,拧紧瓶盖。结果,两只蝗虫很快都死了。请根据下面所给选项,分析a瓶中造成蝗虫死亡的主要原因是( )。
A.没有食物
B.气体不能供给呼吸
C.气体有毒
D.活动空间大小
解析:CO有毒,a瓶内蝗虫中毒死亡;CO2无毒,b瓶内蝗虫缺氧窒息死亡。
答案:C
一氧化碳有剧毒,会使人、动物等中毒,甚至死亡;二氧化碳没有毒性,会使人、动物等窒息死亡。
5.单质碳和一氧化碳的比较
物质
化学性质
用途
C
C+O2CO2
燃料
2C+O22CO
CO
2CO+O22CO2
燃料
一氧化碳是碳不充分燃烧的产物,但是它们的化学性质却非常地相似,都具有可燃性,因而都能作燃料。
使用煤作燃料应注意加大通入空气的量,以防燃料不充分燃烧造成燃料的浪费和环境污染;以CO作燃料要防止泄漏扩散,以免发生中毒事故。
解答此类题,要充分认识发生反应的环境对反应产物的影响(量变引起质变等),还要考虑生成物对环境的影响。
【例5】下图是二次进风节煤炉示意图(煤的主要成分是碳)。
(1)分析煤炉中发生的化学反应,写出各部位的一个主要反应方程式:
煤炉底部______________;
煤炉中部________________;
煤炉上部________________。
(2)同一次进风炉相比,二次进风炉为什么能节煤,并能减少污染?
解析:煤炉底部空气充足,煤充分燃烧生成CO2;CO2流经中部时与炽热的碳反应生成CO;CO在上部又与二次通风口的氧气反应生成CO2,从而使燃料燃烧更加充分。
答案:(1)C+O2CO2 C+CO22CO 2CO+O22CO2 (2)二次进风增加了氧气的量,从而使燃料燃烧更加充分。
6.利用极值法分析碳燃烧的产物
极值法就是对数据不足无从下手的计算或混合物组成判断的题,极端假设恰好为某一成分,或者极端假设为恰好完全反应,以确定混合体系各成分的名称、质量分数、体积分数的解题方法。
高温时,碳在氧气中燃烧的产物因氧气质量的不同而不同。
若氧气充足,碳充分燃烧:
C+O2CO2;
12 32 44
若氧气不充足,碳不能充分燃烧:
2C+O22CO(C+CO22CO)
24
56 12 56
讨论:
(1)氧气充足,碳能充分燃烧,产物只有二氧化碳时,参加反应的碳与氧气的质量比为=;
(2)氧气不充足,碳不能充分燃烧,且产物只有一氧化碳时,参加反应的碳与氧气的质量比为=;
(3)氧气不充足,碳不能充分燃烧,产物为二氧化碳和一氧化碳的混合物时,参加反应的碳与氧气的质量比为<<。
【例6】3
g木炭和6
g氧气在密闭的容器中完全反应后,下列叙述中正确的是( )。
A.产物全部是CO
B.产物全部是CO2
C.产物是CO和CO2的混合物
D.木炭过量,产物为CO
解析:碳与氧气反应在不同的条件下生成的产物不同。此题涉及的化学反应有:C+O2CO2 ① 2C+O22CO ② C+CO22CO ③
设木炭和氧气的质量比为x,则
(1)假设反应按①进行,此时木炭和氧气的质量比为:
x==
(2)假设反应按②进行,此时木炭和氧气的质量比为:
x=2×=
综合起来,可得如下结论:
当x≤时,发生反应①,产物为CO2;
当x≥时,发生反应②,产物为CO;
当<x<时,木炭对反应①过量而对反应②不足,发生反应①后,过量的木炭还要发生反应:C+CO22CO,使一部分CO2转化为CO,产物为CO2和CO。
题中给出木炭和氧气的质量比为=。因为<<,所以产物为CO2和CO的混合物。
答案:C
3
g木炭和6
g氧气在密闭的容器中完全反应发生哪一个反应,题意没有说明,我们必须运用极值法经讨论来确定它;由化学反应方程式可以看出,发生的反应是由木炭和氧气的质量比来决定的,因此,讨论的关键点是题中所给的木炭和氧气的质量比符合哪一种情况。
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
