九年级化学(科粤版)上精品学案:2.4辨别物质的元素组成
文档属性
| 名称 | 九年级化学(科粤版)上精品学案:2.4辨别物质的元素组成 |

|
|
| 格式 | zip | ||
| 文件大小 | 11.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-16 00:00:00 | ||
图片预览



文档简介
2.4 辨别物质的元素组成
1.知道元素的概念,认识元素种类由核内质子数决定。
2.了解元素符号表示的意义,学会元素符号的正确写法,逐步记住一些常见的元素符号。
3.知道单质、化合物、氧化物的概念及区别。
4.认识元素周期表,能找到指定元素和有关该元素的一些其他信息。
1.什么是元素
(1)概念:元素是具有相同核电荷数(即核内质子数)的一类原子的总称。
“元素”是描述某一类原子种类的概念。
①“相同质子”即元素的种类是由核电荷数(即核内质子数)决定的,与原子的中子数、电子数无关。同种元素的原子核内质子数一定相同,不同种元素的原子核内质子数一定不相同。
②“一类原子”是指一种元素可能不止一种原子。一方面包括质子数相同、中子数不同的原子,如氢元素有3氢原子——氕原子、氘原子、氚原子,它们的质子数都相同,但中子数不相同;另一方面也包括质子数相同,而核外电子数不同的原子和离子,如铁原子、亚铁离子、铁离子都属于铁元素。
元素概念的要点是“同质子、类原子”。①同质子:即质子数决定元素的种类。一种元素与另一种元素的根本区别在于原子的核内质子数不同。
②类原子:指元素是一类原子的总称,是一个抽象的宏观概念,只讲种类,不讲个数。
【例1—1】一种元素和另一种元素之间的本质区别是,它们原子的( )。
A.质子数不同
B.中子数和电子数不同
C.中子数不同
D.相对原子质量不同
解析:元素是具有相同核电荷数(即核内质子数)的同类原子的总称。不同类原子之间有很多差别,如含有的粒子数目、原子的质量等不同,但最本质的区别是核电荷数不同。
答案:A
(2)元素的种类与分布
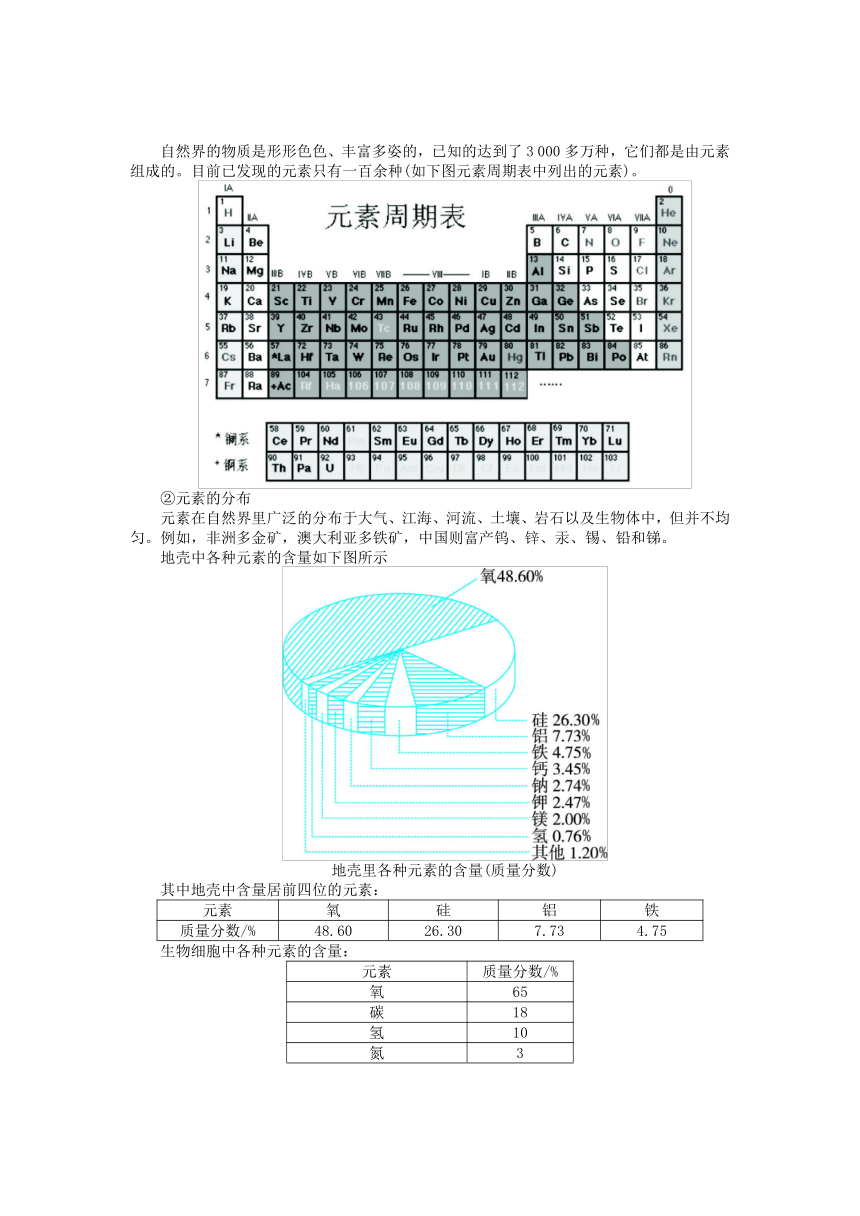
①元素的种类
自然界的物质是形形色色、丰富多姿的,已知的达到了3
000多万种,它们都是由元素组成的。目前已发现的元素只有一百余种(如下图元素周期表中列出的元素)。
②元素的分布
元素在自然界里广泛的分布于大气、江海、河流、土壤、岩石以及生物体中,但并不均匀。例如,非洲多金矿,澳大利亚多铁矿,中国则富产钨、锌、汞、锡、铅和锑。
地壳中各种元素的含量如下图所示
地壳里各种元素的含量(质量分数)
其中地壳中含量居前四位的元素:
元素
氧
硅
铝
铁
质量分数/%
48.60
26.30
7.73
4.75
生物细胞中各种元素的含量:
元素
质量分数/%
氧
65
碳
18
氢
10
氮
3
钙
1.5
磷
1.0
钾
0.35
硫
0.25
氯
0.15
钠
0.15
镁
0.15
铜锌硒钼氟碘铬钴锰铁
共0.55
其他
痕量
其中生物细胞中含量居前四位的元素:
元素
氧
碳
氢
氮
质量分数/%
65
18
10
8
空气中含量最多的元素:氮。
海水中含量前四位的元素依次是氧、氢、氯、钠。
【例1—2】元素在自然界中分布并不均匀,如南非多金矿、澳大利亚多铁矿等,从整个地壳中元素含量的多少分析,最丰富的元素是( )。
A.氧 B.硅 C.铝 D.铁
解析:由地壳中各种元素的含量可知含量最多的元素是氧元素。
答案:A
2.元素的名称和符号怎样表示
(1)元素的名称
元素的中文名称偏旁特点能反映元素的类别(如下图所示):
【例2—1】我们可以把元素分为金属元素、非金属元素和稀有气体元素三种,下列各组元素中,都属于金属元素的是( )。
A.钾、磷、钠 B.钡、汞、银
C.银、钠、氦
D.铜、钙、氯
解析:
A
×
磷元素是固态非金属元素。
B
√
金属元素的中文名称常常带有“钅”字旁(汞除外)。汞是常温下唯一的一种液态金属。
C
×
氦元素是稀有气体元素。
D
×
氯元素是气态非金属元素。
答案:B
(2)元素符号
不同的国家和地区采用不同的名称或符号表示元素,给书写和学术交流带来了很大的不便。如下图所示。
为了书写和学术交流的方便,国际上采用统一的符号来表示各种元素——这就是元素符号。
①元素符号的规定:国际上统一采用的是元素的拉丁文名称的第一个大写字母(大写)来表示元素,如果几种元素拉丁文名称的第一个字母相同时,则再附加第二个字母(小写)来表示,如碳C、钙Ca、铜Cu、氯Cl。
可吸入颗粒物 可吸入颗粒物及其吸附的其他有毒物质,被吸入体内会聚集在呼吸系统中,引发多种疾病。2003年发生的SARS的一种重要传播体——患者的飞沫,就是带有SARS病毒的可吸入颗粒物。②书写方法:
由一个字母表示的元素要大写,如H、O、K等;
由两个字母表示的元素符号,第一个字母要大写,第二个字母小写,如Na、Co、Fe等。
你知道吗!书写元素符号要“一大二小,高低有序”。
【例2—2】某班同学学完元素的知识后,把作业中出现的错误,整理在下列的表格中,请你把错误改正过来。
名称
符号
改正
名称
符号
改正
铝
AL
锰
mn
碳
S
氯
cL
钴
CO
银
Ag
解析:书写元素符号时一定要规范,要注意遵循“一大二小,高低有序”的书写原则。
答案:
名称
改正
名称
改正
铝
Al
锰
Mn
碳
C
氯
Cl
钴
Co
银
Ag
③元素符号表示的意义(如下图):
元素符号表示什么意义
即元素符号表示:
表示一种元素(宏观意义),
表示这种元素的一个原子(微观意义)。
【示例】“H”氢元素符号表示的意义(如下图所示):
氢元素符号表示什么
宏观意义:氢元素
微观意义:一个氢原子
3Al表示什么意义呢?
3Al表示3个铝原子。
元素符号前面加上化学计量数(数字),就只表示微观意义——表示几个原子。如2H只表示两个氢原子。
【例2—3】写出下列符号或符号所代表的含义:
(1)氧元素______;(2)一个镁原子______;(3)N________;________;(4)2Fe________;(5)3个钠原子______。
解析:元素符号表示两种意义,一是某种元素,二是这种元素的一个原子。但由于元素只有种类的概念,没有个数概念,所以当元素符号的前面加上化学计量数时,只表示微观意义某原子的个数。
答案:(1)O (2)Mg (3)氮元素 1个氮原子 (4)2个铁原子 (5)3Na
3.元素周期表
根据元素的原子结构和性质,把现已知的100多种元素按原子序数(核电荷数)科学有序地排列起来,这样得到的表叫元素周期表。
(1)元素周期表的结构:
①每一格(如下图所示):在元素周期表中每一种元素均占一格。每一格内包含了原子序数、元素符号、元素名称、相对原子质量等内容。
②每一个横行(周期):元素周期表共有7个横行,每一个横行叫做一个周期,即共有7个周期。
③每一个纵行(族):元素周期表中共有18个纵行,每一个纵行叫做一个族(8、9、10三个纵行共同组成一个族),共有16个族。
(2)元素周期表按照核电荷数递增的顺序给元素编了号,叫做原子序数。原子序数=核电荷数=质子数。
(3)元素周期表上对金属元素、非金属元素用不同的颜色做了区分。
【例3】如下图所示是元素周期表中某元素的信息示意图,从中获取的相关信息不正确的是( )。
A.元素名称是“硫”
B.元素符号“S”
C.相对原子质量是32.06
g
D.核电荷数是16
解析:在元素周期表的每一格内包含了原子
序数、元素符号、元素名称、相对原子质量。硫的相对原子质量是32.06,不是32.06
g,因为相对原子质量单位是1,而不是质量单位“g”。
答案:C
4.单质和化合物有何不同
(1)单质:由同种元素组成的纯净物。如氧气(O2)、铁(Fe)等。
(2)化合物:由不同种元素组成的纯净物。如水(H2O)、二氧化碳(CO2)、氯酸钾(KClO3)等。
(3)氧化物:仅由两种元素组成且其中一种是氧元素的化合物。如水(H2O)、二氧化碳(CO2)等。
氧化物是化合物中的一种,它只由两种元素组成,且其中一种元素是氧元素。
【例4】下列物质中,前者是单质,后者是化合物的是( )。
A.干冰、石油 B.水、啤酒
C.氢气、氯化钠
D.水银、石灰水
解析:统观四个选项的前项,A、B均为化合物,不符合题意;C的后项为化合物,符合题意。D的前项为单质,后项为混合物,不符合题意,答案为C。
答案:C
由同种元素组成的物质一定是单质吗?
由同种元素组成的物质不一定是单质,如氧气(O2)和臭氧(O3)都由氧元素组成,它们是不同的物质,混放在一起时,虽然只有一种元素,但为混合物,不属于单质。
5.元素与原子的区别与联系
项目
元素
原子
定义
具有相同核电荷数(即核内质子数)的一类原子的总称。
化学变化中的最小粒子。
区别
含义
宏观概念,只表示种类不表示个数。
微观概念,既表示种类,也表示个数。
适用范围
常用于表示物质的宏观组成。如水(H2O)是由氢元素和氧元素组成的。
常用于表示物质的微观构成。如一个水分子是由两个氢原子和一个氧原子构成的。
联系
具有相同核电荷数,(即核内质子数)的一类原子的总称为元素。原子是元素的最小单位,而元素则是原子的一个归类“集体”。
【例5】甲醛(CH2O)
是室内装潢时产生的主要污染物之一,其分子结构模型如下图所示,下列有关甲醛的说法正确的是( )。
A.甲醛由碳、氢、氧三种元素组成
B.甲醛由一个碳元素、二个氢元素、一个氧元素组成
C.甲醛由一个碳原子、二个氢原子、一个氧原子构成
D.甲醛由碳、氢气和氧气三种物质组成
解析:
A
√
由甲醛(CH2O)可知,它是由碳、氢、氧三种元素组成的。
B
×
元素只讲种类,不讲个数。
C
×
甲醛不是由一个碳原子、二个氢原子、一个氧原子直接构成,而是由甲醛分子构成的,且一个甲醛分子是由一个碳原子、二个氢原子、一个氧原子构成的。
D
×
甲醛是纯净物,不含碳、氢气和氧气三种物质。
答案:A
若题目只出现了某物质的名称,是指要从整体上(宏观)描述该物质的组成,应从元素的角度进行回答,它是由某元素和某元素组成的。若题目中出现名称的同时,名称后面跟有“分子”,则是要从微观的方面描述该分子的构成,应从原子的角度进行回答,它的一个分子是由几个某原子构成的。
6.物质的简单分类
单质概念中强调“同种元素”和“纯净物”;化合物概念中强调“不同种元素”和“纯净物”。一种物质是单质或化合物的前提条件是纯净物。
从物质分类的角度认识物质是化学学习中的一种重要方法。物质的分类要有一定的原则,我们依据不同的原则可以对物质从多角度进行分类。
从微观角度分析,由分子构成的物质,若只含有一种分子,则该物质是纯净物;若至少含有两种分子,则该物质为混合物。如空气里含有氧分子、氮分子、二氧化碳分子等,属于混合物;液氧中只含有氧分子,属于纯净物。
对于以模型图的形式来考查物质的分类的题目,解题时要明确图中含有几种分子,分子由几种原子构成。
①只含有一种分子,若由同种原子构成,则是单质;若由不同种原子构成,则是化合物。
②含有不同种的分子,一定是混合物。
【例6—1】某化学兴趣小组的同学学习完物质的分类知识后,对下列物质从不同角度进行了分类,他们将①氧气 ②二氧化碳 ③五氧化二磷 ④铝 ⑤红磷 ⑥四氧化三铁等六种物质分成了两组,并写出了分类依据。你能写出它们的分类和分类依据吗?
第一组:______,分类依据是_____________________________________________;
第二组:______,分类依据是_____________________________________________。
解析:氧气、铝、红磷都是由一种元素组成的纯净物,属于单质。二氧化碳、五氧化二磷、四氧化三铁都是由不同种元素组成的纯净物,属于化合物。另外本题还有其他的分类依据,答案开放。
答案:①④⑤ 单质 ②③⑥ 化合物(其他合理答案均可)
【例6—2】如下图所示,图中“”和“”分别表示两种质子数不同的原子,其中有可能表示氧化物的是( )。
解析:
故A为单质;B、C为混合物;D为化合物,可能为氧化物。
答案:D
7.元素周期表的应用
元素周期表是我们学习和研究化学知识的重要工具,它为寻找新元素提供了理论依据,可以启发人们在一定区域寻找新物质。每一周期开头的元素大部分为金属元素,靠近尾部的为非金属元素,最后为稀有气体元素。元素周期表中,元素是按原子序数递增顺序呈周期性排列的。
元素周期表隐含着化学知识的许多规律。从元素周期表中得出一般规律,通常采用对比的方法,即横向、纵向比较每种原子的核电荷数(即质子数)、电子层数、最外层电子数、所属元素类别等,找出相同点(普遍规律)和不同点(递变规律)。
【例7】元素周期表是化学学习和研究的重要工具。下表是元素周期表的一部分,根据表中信息回答下列问题。
(1)12号元素的元素符号为______;地壳中含量最多的元素的相对原子质量为________。
(2)质子数为16的属于______(填“金属”或“非金属”)元素。
(3)表中不同种元素最本质的区别是( )。
A.质子数不同 B.相对原子质量不同 C.中子数不同
(4)探究下列规律:①第二周期与第三周期同一族元素中质子数之差均为______;
②每一周期中元素从左到右的排列规律是_______________________________________。
解析:由元素周期表可以查出12号元素的元素符号、质子数为16的元素。可以通过对比,横向比较,找出它们的相同点。
答案:(1)Mg 16.00 (2)非金属 (3)A (4)①8 ②核电荷数依次增大
8.对构成物质的微粒的认识
宏观物质是由许许多多的微观粒子构成,构成物质的微观粒子有三种:分子、原子和离子。
(1)有些物质如氢气、氧气等非金属元素单质以及水、二氧化碳等非金属元素的化合物一般是由分子构成的。
(2)金属单质、稀有气体单质及碳等固态非金属单质一般是由原子直接构成的,如铁、氦气、硫等是由原子直接构成的。
(3)NaCl等由金属元素和非金属元素形成的化合物一般是由离子构成的。
【例8】下列各组物质中,都是由分子构成的是( )。
A.水、二氧化硫 B.氧气、红磷
C.铜、银
D.氯化钾、氢气
解析:
A
√
水、二氧化硫分别是由水分子、二氧化硫分子构成的。
B
×
红磷是固态非金属单质,是由磷原子直接构成的。
C
×
铜、银属于金属单质,由原子直接构成的。
D
×
氯化钾是由金属元素和非金属元素形成的化合物,是由离子构成的。
答案:A
解题时首先从宏观上明确物质所属类别及其组成元素,然后根据物质构成的一般规律,确定构成物质的微粒。
1.知道元素的概念,认识元素种类由核内质子数决定。
2.了解元素符号表示的意义,学会元素符号的正确写法,逐步记住一些常见的元素符号。
3.知道单质、化合物、氧化物的概念及区别。
4.认识元素周期表,能找到指定元素和有关该元素的一些其他信息。
1.什么是元素
(1)概念:元素是具有相同核电荷数(即核内质子数)的一类原子的总称。
“元素”是描述某一类原子种类的概念。
①“相同质子”即元素的种类是由核电荷数(即核内质子数)决定的,与原子的中子数、电子数无关。同种元素的原子核内质子数一定相同,不同种元素的原子核内质子数一定不相同。
②“一类原子”是指一种元素可能不止一种原子。一方面包括质子数相同、中子数不同的原子,如氢元素有3氢原子——氕原子、氘原子、氚原子,它们的质子数都相同,但中子数不相同;另一方面也包括质子数相同,而核外电子数不同的原子和离子,如铁原子、亚铁离子、铁离子都属于铁元素。
元素概念的要点是“同质子、类原子”。①同质子:即质子数决定元素的种类。一种元素与另一种元素的根本区别在于原子的核内质子数不同。
②类原子:指元素是一类原子的总称,是一个抽象的宏观概念,只讲种类,不讲个数。
【例1—1】一种元素和另一种元素之间的本质区别是,它们原子的( )。
A.质子数不同
B.中子数和电子数不同
C.中子数不同
D.相对原子质量不同
解析:元素是具有相同核电荷数(即核内质子数)的同类原子的总称。不同类原子之间有很多差别,如含有的粒子数目、原子的质量等不同,但最本质的区别是核电荷数不同。
答案:A
(2)元素的种类与分布
①元素的种类
自然界的物质是形形色色、丰富多姿的,已知的达到了3
000多万种,它们都是由元素组成的。目前已发现的元素只有一百余种(如下图元素周期表中列出的元素)。
②元素的分布
元素在自然界里广泛的分布于大气、江海、河流、土壤、岩石以及生物体中,但并不均匀。例如,非洲多金矿,澳大利亚多铁矿,中国则富产钨、锌、汞、锡、铅和锑。
地壳中各种元素的含量如下图所示
地壳里各种元素的含量(质量分数)
其中地壳中含量居前四位的元素:
元素
氧
硅
铝
铁
质量分数/%
48.60
26.30
7.73
4.75
生物细胞中各种元素的含量:
元素
质量分数/%
氧
65
碳
18
氢
10
氮
3
钙
1.5
磷
1.0
钾
0.35
硫
0.25
氯
0.15
钠
0.15
镁
0.15
铜锌硒钼氟碘铬钴锰铁
共0.55
其他
痕量
其中生物细胞中含量居前四位的元素:
元素
氧
碳
氢
氮
质量分数/%
65
18
10
8
空气中含量最多的元素:氮。
海水中含量前四位的元素依次是氧、氢、氯、钠。
【例1—2】元素在自然界中分布并不均匀,如南非多金矿、澳大利亚多铁矿等,从整个地壳中元素含量的多少分析,最丰富的元素是( )。
A.氧 B.硅 C.铝 D.铁
解析:由地壳中各种元素的含量可知含量最多的元素是氧元素。
答案:A
2.元素的名称和符号怎样表示
(1)元素的名称
元素的中文名称偏旁特点能反映元素的类别(如下图所示):
【例2—1】我们可以把元素分为金属元素、非金属元素和稀有气体元素三种,下列各组元素中,都属于金属元素的是( )。
A.钾、磷、钠 B.钡、汞、银
C.银、钠、氦
D.铜、钙、氯
解析:
A
×
磷元素是固态非金属元素。
B
√
金属元素的中文名称常常带有“钅”字旁(汞除外)。汞是常温下唯一的一种液态金属。
C
×
氦元素是稀有气体元素。
D
×
氯元素是气态非金属元素。
答案:B
(2)元素符号
不同的国家和地区采用不同的名称或符号表示元素,给书写和学术交流带来了很大的不便。如下图所示。
为了书写和学术交流的方便,国际上采用统一的符号来表示各种元素——这就是元素符号。
①元素符号的规定:国际上统一采用的是元素的拉丁文名称的第一个大写字母(大写)来表示元素,如果几种元素拉丁文名称的第一个字母相同时,则再附加第二个字母(小写)来表示,如碳C、钙Ca、铜Cu、氯Cl。
可吸入颗粒物 可吸入颗粒物及其吸附的其他有毒物质,被吸入体内会聚集在呼吸系统中,引发多种疾病。2003年发生的SARS的一种重要传播体——患者的飞沫,就是带有SARS病毒的可吸入颗粒物。②书写方法:
由一个字母表示的元素要大写,如H、O、K等;
由两个字母表示的元素符号,第一个字母要大写,第二个字母小写,如Na、Co、Fe等。
你知道吗!书写元素符号要“一大二小,高低有序”。
【例2—2】某班同学学完元素的知识后,把作业中出现的错误,整理在下列的表格中,请你把错误改正过来。
名称
符号
改正
名称
符号
改正
铝
AL
锰
mn
碳
S
氯
cL
钴
CO
银
Ag
解析:书写元素符号时一定要规范,要注意遵循“一大二小,高低有序”的书写原则。
答案:
名称
改正
名称
改正
铝
Al
锰
Mn
碳
C
氯
Cl
钴
Co
银
Ag
③元素符号表示的意义(如下图):
元素符号表示什么意义
即元素符号表示:
表示一种元素(宏观意义),
表示这种元素的一个原子(微观意义)。
【示例】“H”氢元素符号表示的意义(如下图所示):
氢元素符号表示什么
宏观意义:氢元素
微观意义:一个氢原子
3Al表示什么意义呢?
3Al表示3个铝原子。
元素符号前面加上化学计量数(数字),就只表示微观意义——表示几个原子。如2H只表示两个氢原子。
【例2—3】写出下列符号或符号所代表的含义:
(1)氧元素______;(2)一个镁原子______;(3)N________;________;(4)2Fe________;(5)3个钠原子______。
解析:元素符号表示两种意义,一是某种元素,二是这种元素的一个原子。但由于元素只有种类的概念,没有个数概念,所以当元素符号的前面加上化学计量数时,只表示微观意义某原子的个数。
答案:(1)O (2)Mg (3)氮元素 1个氮原子 (4)2个铁原子 (5)3Na
3.元素周期表
根据元素的原子结构和性质,把现已知的100多种元素按原子序数(核电荷数)科学有序地排列起来,这样得到的表叫元素周期表。
(1)元素周期表的结构:
①每一格(如下图所示):在元素周期表中每一种元素均占一格。每一格内包含了原子序数、元素符号、元素名称、相对原子质量等内容。
②每一个横行(周期):元素周期表共有7个横行,每一个横行叫做一个周期,即共有7个周期。
③每一个纵行(族):元素周期表中共有18个纵行,每一个纵行叫做一个族(8、9、10三个纵行共同组成一个族),共有16个族。
(2)元素周期表按照核电荷数递增的顺序给元素编了号,叫做原子序数。原子序数=核电荷数=质子数。
(3)元素周期表上对金属元素、非金属元素用不同的颜色做了区分。
【例3】如下图所示是元素周期表中某元素的信息示意图,从中获取的相关信息不正确的是( )。
A.元素名称是“硫”
B.元素符号“S”
C.相对原子质量是32.06
g
D.核电荷数是16
解析:在元素周期表的每一格内包含了原子
序数、元素符号、元素名称、相对原子质量。硫的相对原子质量是32.06,不是32.06
g,因为相对原子质量单位是1,而不是质量单位“g”。
答案:C
4.单质和化合物有何不同
(1)单质:由同种元素组成的纯净物。如氧气(O2)、铁(Fe)等。
(2)化合物:由不同种元素组成的纯净物。如水(H2O)、二氧化碳(CO2)、氯酸钾(KClO3)等。
(3)氧化物:仅由两种元素组成且其中一种是氧元素的化合物。如水(H2O)、二氧化碳(CO2)等。
氧化物是化合物中的一种,它只由两种元素组成,且其中一种元素是氧元素。
【例4】下列物质中,前者是单质,后者是化合物的是( )。
A.干冰、石油 B.水、啤酒
C.氢气、氯化钠
D.水银、石灰水
解析:统观四个选项的前项,A、B均为化合物,不符合题意;C的后项为化合物,符合题意。D的前项为单质,后项为混合物,不符合题意,答案为C。
答案:C
由同种元素组成的物质一定是单质吗?
由同种元素组成的物质不一定是单质,如氧气(O2)和臭氧(O3)都由氧元素组成,它们是不同的物质,混放在一起时,虽然只有一种元素,但为混合物,不属于单质。
5.元素与原子的区别与联系
项目
元素
原子
定义
具有相同核电荷数(即核内质子数)的一类原子的总称。
化学变化中的最小粒子。
区别
含义
宏观概念,只表示种类不表示个数。
微观概念,既表示种类,也表示个数。
适用范围
常用于表示物质的宏观组成。如水(H2O)是由氢元素和氧元素组成的。
常用于表示物质的微观构成。如一个水分子是由两个氢原子和一个氧原子构成的。
联系
具有相同核电荷数,(即核内质子数)的一类原子的总称为元素。原子是元素的最小单位,而元素则是原子的一个归类“集体”。
【例5】甲醛(CH2O)
是室内装潢时产生的主要污染物之一,其分子结构模型如下图所示,下列有关甲醛的说法正确的是( )。
A.甲醛由碳、氢、氧三种元素组成
B.甲醛由一个碳元素、二个氢元素、一个氧元素组成
C.甲醛由一个碳原子、二个氢原子、一个氧原子构成
D.甲醛由碳、氢气和氧气三种物质组成
解析:
A
√
由甲醛(CH2O)可知,它是由碳、氢、氧三种元素组成的。
B
×
元素只讲种类,不讲个数。
C
×
甲醛不是由一个碳原子、二个氢原子、一个氧原子直接构成,而是由甲醛分子构成的,且一个甲醛分子是由一个碳原子、二个氢原子、一个氧原子构成的。
D
×
甲醛是纯净物,不含碳、氢气和氧气三种物质。
答案:A
若题目只出现了某物质的名称,是指要从整体上(宏观)描述该物质的组成,应从元素的角度进行回答,它是由某元素和某元素组成的。若题目中出现名称的同时,名称后面跟有“分子”,则是要从微观的方面描述该分子的构成,应从原子的角度进行回答,它的一个分子是由几个某原子构成的。
6.物质的简单分类
单质概念中强调“同种元素”和“纯净物”;化合物概念中强调“不同种元素”和“纯净物”。一种物质是单质或化合物的前提条件是纯净物。
从物质分类的角度认识物质是化学学习中的一种重要方法。物质的分类要有一定的原则,我们依据不同的原则可以对物质从多角度进行分类。
从微观角度分析,由分子构成的物质,若只含有一种分子,则该物质是纯净物;若至少含有两种分子,则该物质为混合物。如空气里含有氧分子、氮分子、二氧化碳分子等,属于混合物;液氧中只含有氧分子,属于纯净物。
对于以模型图的形式来考查物质的分类的题目,解题时要明确图中含有几种分子,分子由几种原子构成。
①只含有一种分子,若由同种原子构成,则是单质;若由不同种原子构成,则是化合物。
②含有不同种的分子,一定是混合物。
【例6—1】某化学兴趣小组的同学学习完物质的分类知识后,对下列物质从不同角度进行了分类,他们将①氧气 ②二氧化碳 ③五氧化二磷 ④铝 ⑤红磷 ⑥四氧化三铁等六种物质分成了两组,并写出了分类依据。你能写出它们的分类和分类依据吗?
第一组:______,分类依据是_____________________________________________;
第二组:______,分类依据是_____________________________________________。
解析:氧气、铝、红磷都是由一种元素组成的纯净物,属于单质。二氧化碳、五氧化二磷、四氧化三铁都是由不同种元素组成的纯净物,属于化合物。另外本题还有其他的分类依据,答案开放。
答案:①④⑤ 单质 ②③⑥ 化合物(其他合理答案均可)
【例6—2】如下图所示,图中“”和“”分别表示两种质子数不同的原子,其中有可能表示氧化物的是( )。
解析:
故A为单质;B、C为混合物;D为化合物,可能为氧化物。
答案:D
7.元素周期表的应用
元素周期表是我们学习和研究化学知识的重要工具,它为寻找新元素提供了理论依据,可以启发人们在一定区域寻找新物质。每一周期开头的元素大部分为金属元素,靠近尾部的为非金属元素,最后为稀有气体元素。元素周期表中,元素是按原子序数递增顺序呈周期性排列的。
元素周期表隐含着化学知识的许多规律。从元素周期表中得出一般规律,通常采用对比的方法,即横向、纵向比较每种原子的核电荷数(即质子数)、电子层数、最外层电子数、所属元素类别等,找出相同点(普遍规律)和不同点(递变规律)。
【例7】元素周期表是化学学习和研究的重要工具。下表是元素周期表的一部分,根据表中信息回答下列问题。
(1)12号元素的元素符号为______;地壳中含量最多的元素的相对原子质量为________。
(2)质子数为16的属于______(填“金属”或“非金属”)元素。
(3)表中不同种元素最本质的区别是( )。
A.质子数不同 B.相对原子质量不同 C.中子数不同
(4)探究下列规律:①第二周期与第三周期同一族元素中质子数之差均为______;
②每一周期中元素从左到右的排列规律是_______________________________________。
解析:由元素周期表可以查出12号元素的元素符号、质子数为16的元素。可以通过对比,横向比较,找出它们的相同点。
答案:(1)Mg 16.00 (2)非金属 (3)A (4)①8 ②核电荷数依次增大
8.对构成物质的微粒的认识
宏观物质是由许许多多的微观粒子构成,构成物质的微观粒子有三种:分子、原子和离子。
(1)有些物质如氢气、氧气等非金属元素单质以及水、二氧化碳等非金属元素的化合物一般是由分子构成的。
(2)金属单质、稀有气体单质及碳等固态非金属单质一般是由原子直接构成的,如铁、氦气、硫等是由原子直接构成的。
(3)NaCl等由金属元素和非金属元素形成的化合物一般是由离子构成的。
【例8】下列各组物质中,都是由分子构成的是( )。
A.水、二氧化硫 B.氧气、红磷
C.铜、银
D.氯化钾、氢气
解析:
A
√
水、二氧化硫分别是由水分子、二氧化硫分子构成的。
B
×
红磷是固态非金属单质,是由磷原子直接构成的。
C
×
铜、银属于金属单质,由原子直接构成的。
D
×
氯化钾是由金属元素和非金属元素形成的化合物,是由离子构成的。
答案:A
解题时首先从宏观上明确物质所属类别及其组成元素,然后根据物质构成的一般规律,确定构成物质的微粒。
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
