第三单元 维持生命的物质——氧气、水 实验活动四 探究物质燃烧的条件 同步练习(含答案)
文档属性
| 名称 | 第三单元 维持生命的物质——氧气、水 实验活动四 探究物质燃烧的条件 同步练习(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 292.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-28 21:49:59 | ||
图片预览

文档简介
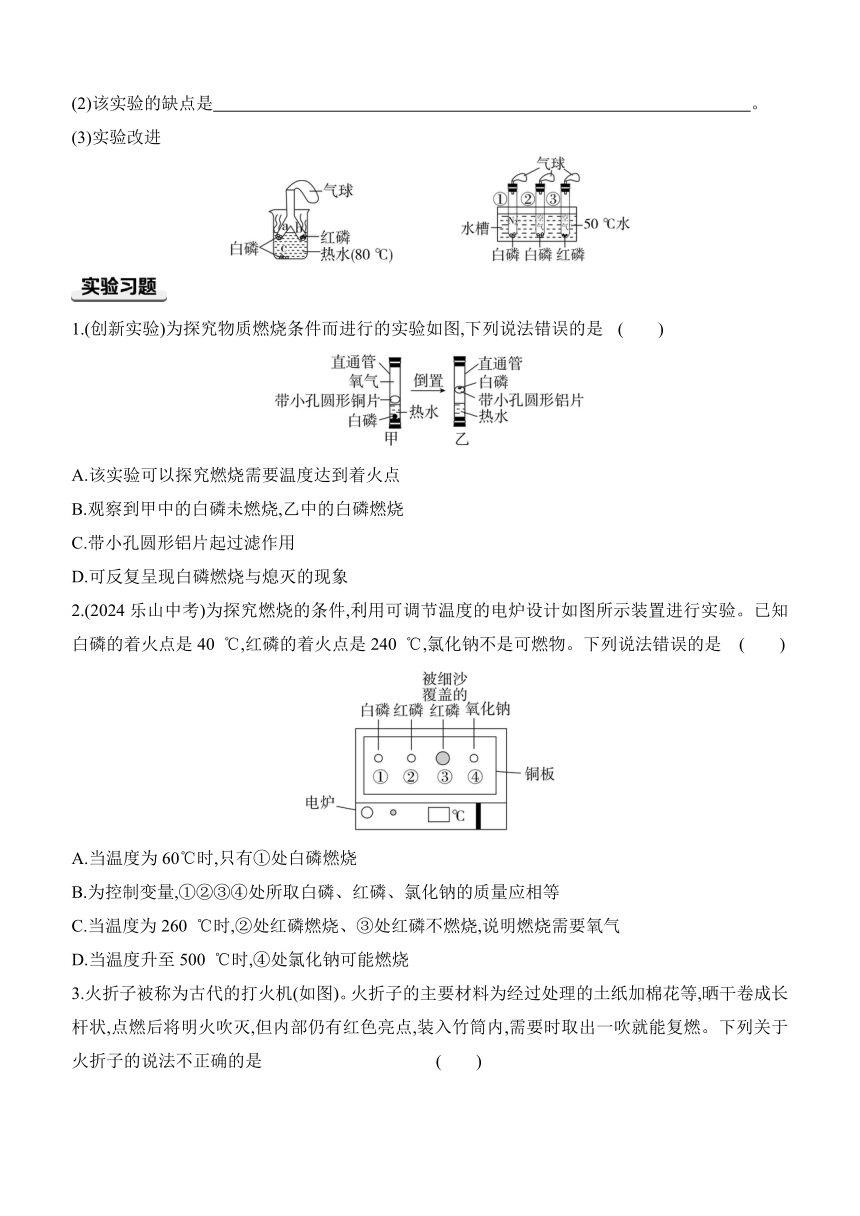
实验活动四 探究物质燃烧的条件
探究物质燃烧的条件
1.燃烧条件的实验探究
实验过程 实验现象 实验结论
坩埚钳夹持石块在酒精灯火焰上加热 石块 物质燃烧需要有
坩埚钳夹持火柴在酒精灯火焰上加热 火柴
火柴头C用细沙覆盖,用酒精灯加热B、C的 位置 火柴头A , 火柴头B , 火柴头C 对比火柴头A和B可得出:可燃物燃烧需要
对比火柴头B和C可得出:可燃物燃烧需要
【注意】(1)物质燃烧三个条件 。
(2)影响燃烧剧烈程度的因素:①与氧气的接触面积;②氧气的 。
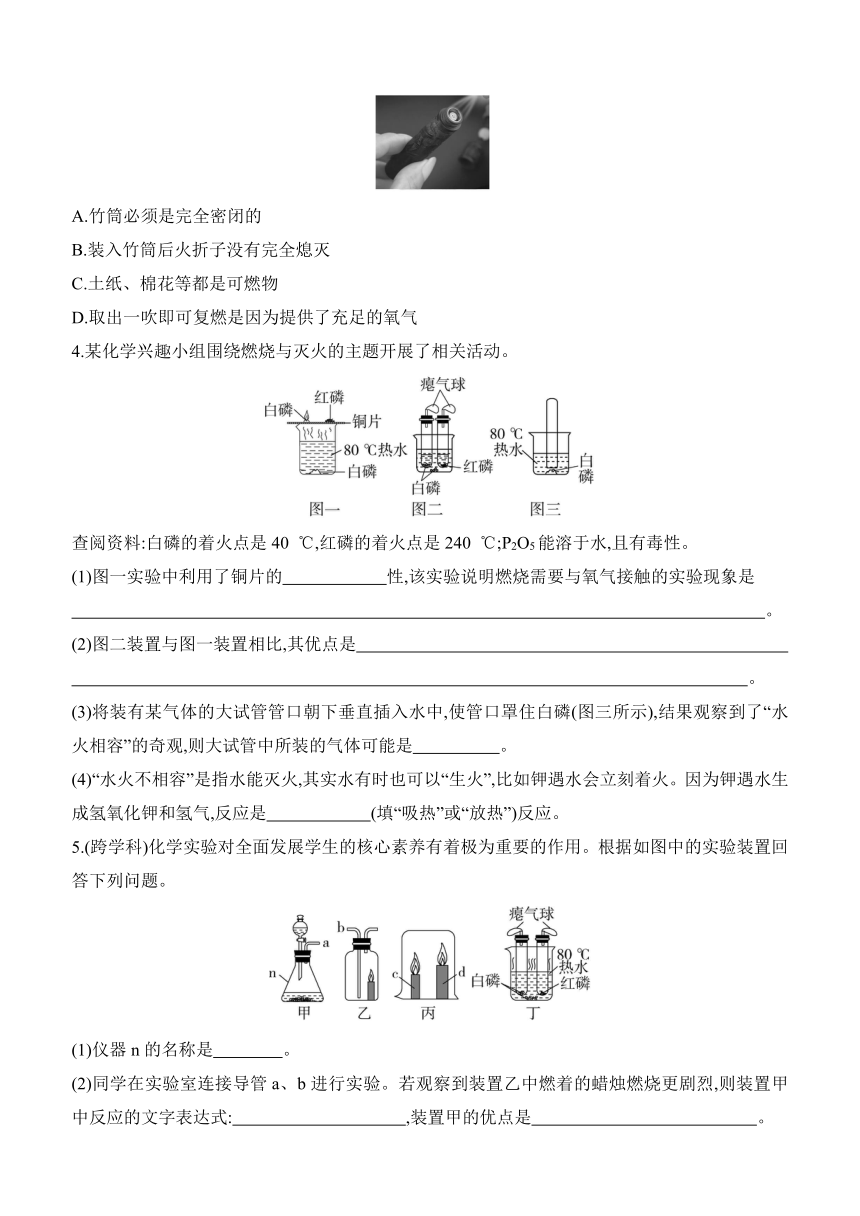
2.其他常见的探究燃烧条件的方法
(1)薄铜片的作用是 ;热水的 作用是 ;能说明燃烧需要使温度达到着火点的现象是 ;能说明燃烧需要与氧气接触的是 。
(2)该实验的缺点是 。
(3)实验改进
1.(创新实验)为探究物质燃烧条件而进行的实验如图,下列说法错误的是 ( )
A.该实验可以探究燃烧需要温度达到着火点
B.观察到甲中的白磷未燃烧,乙中的白磷燃烧
C.带小孔圆形铝片起过滤作用
D.可反复呈现白磷燃烧与熄灭的现象
2.(2024乐山中考)为探究燃烧的条件,利用可调节温度的电炉设计如图所示装置进行实验。已知白磷的着火点是40 ℃,红磷的着火点是240 ℃,氯化钠不是可燃物。下列说法错误的是 ( )
A.当温度为60℃时,只有①处白磷燃烧
B.为控制变量,①②③④处所取白磷、红磷、氯化钠的质量应相等
C.当温度为260 ℃时,②处红磷燃烧、③处红磷不燃烧,说明燃烧需要氧气
D.当温度升至500 ℃时,④处氯化钠可能燃烧
3.火折子被称为古代的打火机(如图)。火折子的主要材料为经过处理的土纸加棉花等,晒干卷成长杆状,点燃后将明火吹灭,但内部仍有红色亮点,装入竹筒内,需要时取出一吹就能复燃。下列关于火折子的说法不正确的是 ( )
A.竹筒必须是完全密闭的
B.装入竹筒后火折子没有完全熄灭
C.土纸、棉花等都是可燃物
D.取出一吹即可复燃是因为提供了充足的氧气
4.某化学兴趣小组围绕燃烧与灭火的主题开展了相关活动。
查阅资料:白磷的着火点是40 ℃,红磷的着火点是240 ℃;P2O5能溶于水,且有毒性。
(1)图一实验中利用了铜片的 性,该实验说明燃烧需要与氧气接触的实验现象是
。
(2)图二装置与图一装置相比,其优点是
。
(3)将装有某气体的大试管管口朝下垂直插入水中,使管口罩住白磷(图三所示),结果观察到了“水火相容”的奇观,则大试管中所装的气体可能是 。
(4)“水火不相容”是指水能灭火,其实水有时也可以“生火”,比如钾遇水会立刻着火。因为钾遇水生成氢氧化钾和氢气,反应是 (填“吸热”或“放热”)反应。
5.(跨学科)化学实验对全面发展学生的核心素养有着极为重要的作用。根据如图中的实验装置回答下列问题。
(1)仪器n的名称是 。
(2)同学在实验室连接导管a、b进行实验。若观察到装置乙中燃着的蜡烛燃烧更剧烈,则装置甲中反应的文字表达式: ,装置甲的优点是 。
(3)装置丙可观 察到蜡烛c (填“先于”或“后于”)d熄灭。因此,在火场逃生时应注意 。
(4)装置丁可观察到试管中的白磷燃烧,热水中的白磷不燃烧,说明燃烧需要的条件之一是 。待试管中白磷(过量)火焰熄灭并冷却至室温后,把试管倒扣在水中取下胶塞,可观察到的现象为 ,说明氧气约占空气体积的 ,装置丁中气球的作用是 (填字母)。
A.调节压强 B.隔绝空气 C.防止污染
【详解答案】
实验内容
1.不燃烧 燃烧 可燃物 中间 不燃烧
燃烧 不燃烧 温度达到着火点
与氧气接触 【注意】(1)缺一不可
(2)②浓度
2.(1)传递热量 隔绝空气、提供能量 薄铜片上的白磷燃烧,红磷不燃烧 薄铜片上的白磷燃烧,水中的白磷不燃烧
(2)白磷燃烧产生的大量白烟逸散到空气中,污染空气
实验习题
1.A 解析:甲、乙两个实验中温度相同,没有控制温度的高低,不能探究可燃物燃烧需要温度达到着火点,A错误;由题图可知,甲和乙中的白磷温度均达到了着火点,但甲中的白磷被水隔绝不能与氧气接触,不发生燃烧,而乙中的白磷能够与氧气接触,能够燃烧,B正确;带小孔圆形铝片起过滤作用,将白磷与水进行分离,来探究燃烧条件,C正确;实验中通过装置的倒立或正放,控制白磷与氧气的接触与分离可反复呈现白磷燃烧与熄灭的现象,D正确。
2.D 解析:当温度为60 ℃时,温度只达到了白磷的着火点,氯化钠不属于可燃物,故只有①处白磷燃烧;根据控制变量的原则,该实验只有“物质种类”一个变量,故①②③④处所取白磷、红磷、氯化钠的质量应相等;当温度为260 ℃时,温度达到了红磷的着火点,②处红磷接触了氧气,该处红磷燃烧,③处红磷被细沙覆盖,隔绝了氧气,该处红磷不能燃烧,说明燃烧需要氧气;氯化钠不属于可燃物,故当温度升至500 ℃时,④处氯化钠不可能燃烧。
3.A 解析:竹筒不能完全封闭,否则与空气隔绝,火折子就会完全熄灭,不会“仍有红色亮点”。
4.(1)导热 铜片上的白磷燃烧,水底的白磷不燃烧 (2)防止五氧化二磷进入空气,造成污染 (3)空气(或氧气)
(4)放热
5.(1)锥形瓶 (2)过氧化氢水+氧气 可以控制反应的速率
(3)后于 尽量贴近地面逃离(合理即可)
(4)与氧气(空气)接触 试管内液面上升,进入试管中的水约占试管容积的1/5 1/5 AC
解析:(2)装置乙中燃着的蜡烛燃烧更剧烈,说明甲中产生的气体是氧气,甲中装置属于固液常温型,采用的是分解过氧化氢溶液的方法,过氧化氢在二氧化锰的催化作用下生成水和氧气;分液漏斗能控制滴加液体的速率,装置甲的优点是可以控制反应的速率。(3)通常情况下,二氧化碳的密度比空气大,但由于热胀冷缩,蜡烛燃烧生成的热的二氧化碳气体体积变大,密度变得比空气的小,会聚集在烧杯的上方,使上方的蜡烛先熄灭,故会观察到装置丙中蜡烛c后于d熄灭,因此,在火场逃生时应注意尽量贴近地面逃离。(4)装置丁可观察到试管中的白磷燃烧,而热水中的白磷不燃烧,说明燃烧需要的条件之一是与氧气(空气)接触;待试管中白磷(过量)火焰熄灭并冷却至室温后,把试管倒扣在水中取下胶塞,可观察到的现象为试管内液面上升,进入试管中的水约占试管容积的五分之一,说明氧气约占空气体积的五分之一;白磷燃烧放出大量的热,使装置内压强增大,装置丁中气球能调节压强,还能防止生成的五氧化二磷污染空气。
探究物质燃烧的条件
1.燃烧条件的实验探究
实验过程 实验现象 实验结论
坩埚钳夹持石块在酒精灯火焰上加热 石块 物质燃烧需要有
坩埚钳夹持火柴在酒精灯火焰上加热 火柴
火柴头C用细沙覆盖,用酒精灯加热B、C的 位置 火柴头A , 火柴头B , 火柴头C 对比火柴头A和B可得出:可燃物燃烧需要
对比火柴头B和C可得出:可燃物燃烧需要
【注意】(1)物质燃烧三个条件 。
(2)影响燃烧剧烈程度的因素:①与氧气的接触面积;②氧气的 。
2.其他常见的探究燃烧条件的方法
(1)薄铜片的作用是 ;热水的 作用是 ;能说明燃烧需要使温度达到着火点的现象是 ;能说明燃烧需要与氧气接触的是 。
(2)该实验的缺点是 。
(3)实验改进
1.(创新实验)为探究物质燃烧条件而进行的实验如图,下列说法错误的是 ( )
A.该实验可以探究燃烧需要温度达到着火点
B.观察到甲中的白磷未燃烧,乙中的白磷燃烧
C.带小孔圆形铝片起过滤作用
D.可反复呈现白磷燃烧与熄灭的现象
2.(2024乐山中考)为探究燃烧的条件,利用可调节温度的电炉设计如图所示装置进行实验。已知白磷的着火点是40 ℃,红磷的着火点是240 ℃,氯化钠不是可燃物。下列说法错误的是 ( )
A.当温度为60℃时,只有①处白磷燃烧
B.为控制变量,①②③④处所取白磷、红磷、氯化钠的质量应相等
C.当温度为260 ℃时,②处红磷燃烧、③处红磷不燃烧,说明燃烧需要氧气
D.当温度升至500 ℃时,④处氯化钠可能燃烧
3.火折子被称为古代的打火机(如图)。火折子的主要材料为经过处理的土纸加棉花等,晒干卷成长杆状,点燃后将明火吹灭,但内部仍有红色亮点,装入竹筒内,需要时取出一吹就能复燃。下列关于火折子的说法不正确的是 ( )
A.竹筒必须是完全密闭的
B.装入竹筒后火折子没有完全熄灭
C.土纸、棉花等都是可燃物
D.取出一吹即可复燃是因为提供了充足的氧气
4.某化学兴趣小组围绕燃烧与灭火的主题开展了相关活动。
查阅资料:白磷的着火点是40 ℃,红磷的着火点是240 ℃;P2O5能溶于水,且有毒性。
(1)图一实验中利用了铜片的 性,该实验说明燃烧需要与氧气接触的实验现象是
。
(2)图二装置与图一装置相比,其优点是
。
(3)将装有某气体的大试管管口朝下垂直插入水中,使管口罩住白磷(图三所示),结果观察到了“水火相容”的奇观,则大试管中所装的气体可能是 。
(4)“水火不相容”是指水能灭火,其实水有时也可以“生火”,比如钾遇水会立刻着火。因为钾遇水生成氢氧化钾和氢气,反应是 (填“吸热”或“放热”)反应。
5.(跨学科)化学实验对全面发展学生的核心素养有着极为重要的作用。根据如图中的实验装置回答下列问题。
(1)仪器n的名称是 。
(2)同学在实验室连接导管a、b进行实验。若观察到装置乙中燃着的蜡烛燃烧更剧烈,则装置甲中反应的文字表达式: ,装置甲的优点是 。
(3)装置丙可观 察到蜡烛c (填“先于”或“后于”)d熄灭。因此,在火场逃生时应注意 。
(4)装置丁可观察到试管中的白磷燃烧,热水中的白磷不燃烧,说明燃烧需要的条件之一是 。待试管中白磷(过量)火焰熄灭并冷却至室温后,把试管倒扣在水中取下胶塞,可观察到的现象为 ,说明氧气约占空气体积的 ,装置丁中气球的作用是 (填字母)。
A.调节压强 B.隔绝空气 C.防止污染
【详解答案】
实验内容
1.不燃烧 燃烧 可燃物 中间 不燃烧
燃烧 不燃烧 温度达到着火点
与氧气接触 【注意】(1)缺一不可
(2)②浓度
2.(1)传递热量 隔绝空气、提供能量 薄铜片上的白磷燃烧,红磷不燃烧 薄铜片上的白磷燃烧,水中的白磷不燃烧
(2)白磷燃烧产生的大量白烟逸散到空气中,污染空气
实验习题
1.A 解析:甲、乙两个实验中温度相同,没有控制温度的高低,不能探究可燃物燃烧需要温度达到着火点,A错误;由题图可知,甲和乙中的白磷温度均达到了着火点,但甲中的白磷被水隔绝不能与氧气接触,不发生燃烧,而乙中的白磷能够与氧气接触,能够燃烧,B正确;带小孔圆形铝片起过滤作用,将白磷与水进行分离,来探究燃烧条件,C正确;实验中通过装置的倒立或正放,控制白磷与氧气的接触与分离可反复呈现白磷燃烧与熄灭的现象,D正确。
2.D 解析:当温度为60 ℃时,温度只达到了白磷的着火点,氯化钠不属于可燃物,故只有①处白磷燃烧;根据控制变量的原则,该实验只有“物质种类”一个变量,故①②③④处所取白磷、红磷、氯化钠的质量应相等;当温度为260 ℃时,温度达到了红磷的着火点,②处红磷接触了氧气,该处红磷燃烧,③处红磷被细沙覆盖,隔绝了氧气,该处红磷不能燃烧,说明燃烧需要氧气;氯化钠不属于可燃物,故当温度升至500 ℃时,④处氯化钠不可能燃烧。
3.A 解析:竹筒不能完全封闭,否则与空气隔绝,火折子就会完全熄灭,不会“仍有红色亮点”。
4.(1)导热 铜片上的白磷燃烧,水底的白磷不燃烧 (2)防止五氧化二磷进入空气,造成污染 (3)空气(或氧气)
(4)放热
5.(1)锥形瓶 (2)过氧化氢水+氧气 可以控制反应的速率
(3)后于 尽量贴近地面逃离(合理即可)
(4)与氧气(空气)接触 试管内液面上升,进入试管中的水约占试管容积的1/5 1/5 AC
解析:(2)装置乙中燃着的蜡烛燃烧更剧烈,说明甲中产生的气体是氧气,甲中装置属于固液常温型,采用的是分解过氧化氢溶液的方法,过氧化氢在二氧化锰的催化作用下生成水和氧气;分液漏斗能控制滴加液体的速率,装置甲的优点是可以控制反应的速率。(3)通常情况下,二氧化碳的密度比空气大,但由于热胀冷缩,蜡烛燃烧生成的热的二氧化碳气体体积变大,密度变得比空气的小,会聚集在烧杯的上方,使上方的蜡烛先熄灭,故会观察到装置丙中蜡烛c后于d熄灭,因此,在火场逃生时应注意尽量贴近地面逃离。(4)装置丁可观察到试管中的白磷燃烧,而热水中的白磷不燃烧,说明燃烧需要的条件之一是与氧气(空气)接触;待试管中白磷(过量)火焰熄灭并冷却至室温后,把试管倒扣在水中取下胶塞,可观察到的现象为试管内液面上升,进入试管中的水约占试管容积的五分之一,说明氧气约占空气体积的五分之一;白磷燃烧放出大量的热,使装置内压强增大,装置丁中气球能调节压强,还能防止生成的五氧化二磷污染空气。
同课章节目录
