第四单元 化学式与化学方程式 专题训练六 常见化学方程式的计算类型 同步练习 (含答案)
文档属性
| 名称 | 第四单元 化学式与化学方程式 专题训练六 常见化学方程式的计算类型 同步练习 (含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 176.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-29 14:51:03 | ||
图片预览

文档简介
专题训练六 常见化学方程式的计算类型
文字表述型计算
1.(2025西安期中)实验室有一瓶含杂质的氯酸钾,某兴趣小组的同学利用该试剂和二氧化锰制取氧气(杂质不溶于水也不参加反应),实验数据如下图,请回答下列问题:
(1)a= g。
(2)小组同学欲从反应后的剩余固体中回收二氧化锰,主要操作步骤为加水溶解、 、洗涤、干燥。
(3)计算受热分解的氯酸钾的质量(写出计算过程)。
2.乙炔(C2H2)是一种重要的化工原料,工业上常用碳化钙(CaC2)与水反应制取乙炔,同时生成氢氧化钙。现小明取含杂质的碳化钙与适量的水放在相应装置中模拟工业制取乙炔气体(杂质没有参加反应),已知所用含杂质的碳化钙与水的总质量是58 g,反应后装置中剩余物质的总质量为45 g。计算:
(1)反应过程中生成的乙炔气体的质量为 g。
(2)参加反应的碳化钙的质量。[已知:CaC2+2H2OCa(OH)2+C2H2↑]
图像型计算
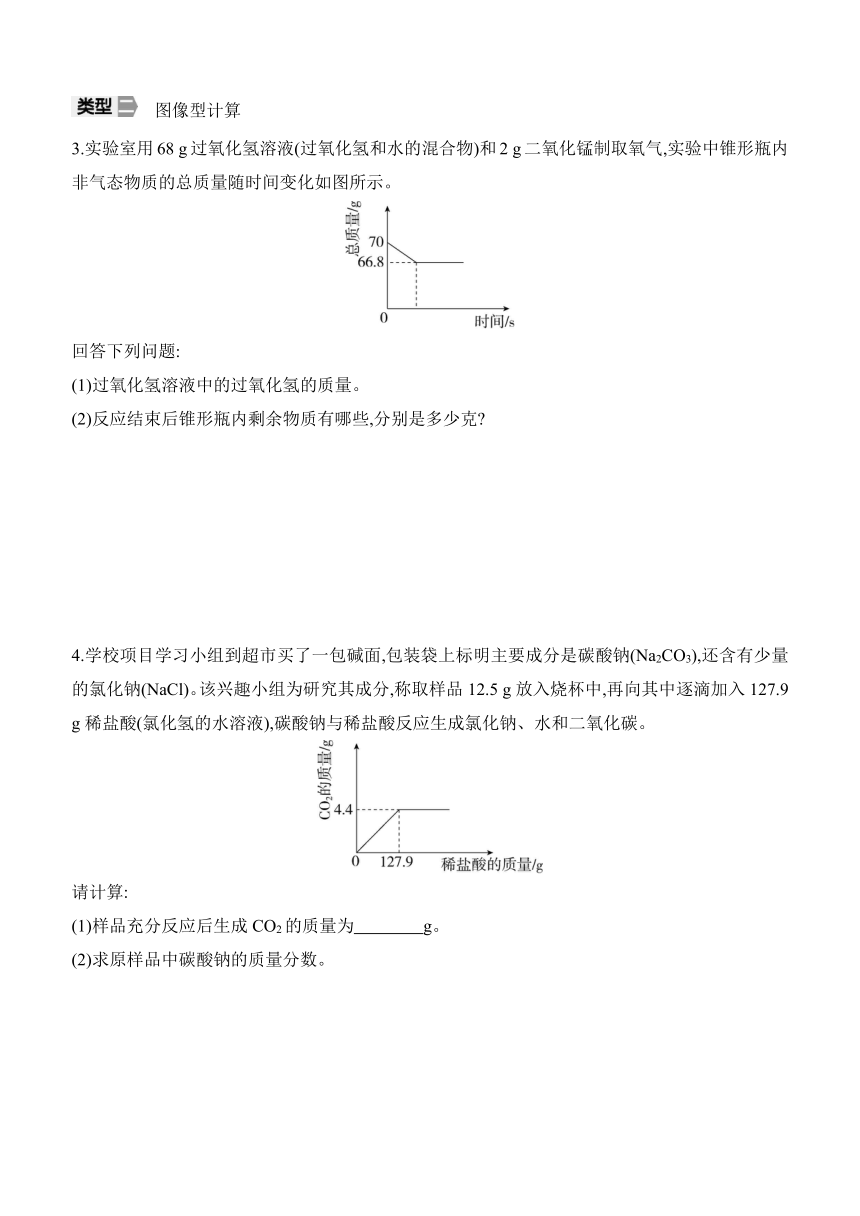
3.实验室用68 g过氧化氢溶液(过氧化氢和水的混合物)和2 g二氧化锰制取氧气,实验中锥形瓶内非气态物质的总质量随时间变化如图所示。
回答下列问题:
(1)过氧化氢溶液中的过氧化氢的质量。
(2)反应结束后锥形瓶内剩余物质有哪些,分别是多少克
4.学校项目学习小组到超市买了一包碱面,包装袋上标明主要成分是碳酸钠(Na2CO3),还含有少量的氯化钠(NaCl)。该兴趣小组为研究其成分,称取样品12.5 g放入烧杯中,再向其中逐滴加入127.9 g稀盐酸(氯化氢的水溶液),碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳。
请计算:
(1)样品充分反应后生成CO2的质量为 g。
(2)求原样品中碳酸钠的质量分数。
图解实验型计算
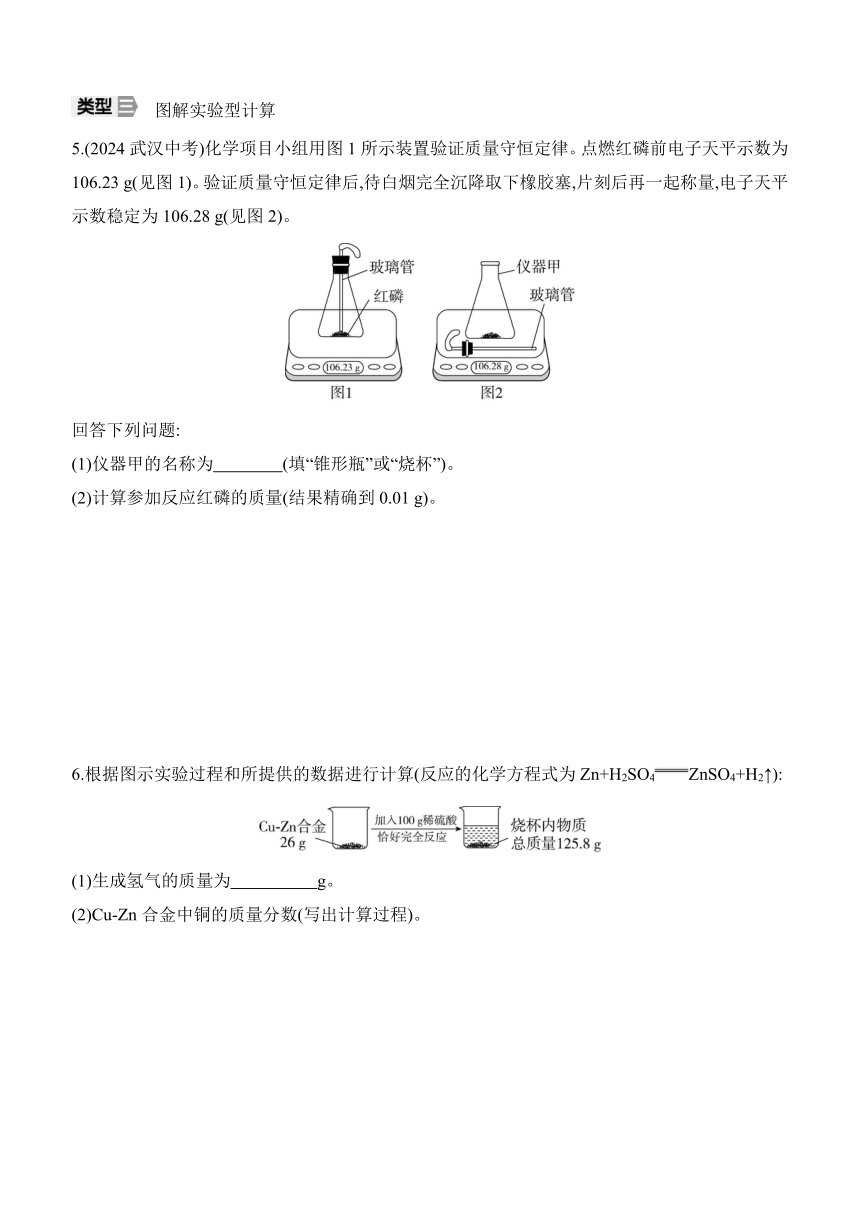
5.(2024武汉中考)化学项目小组用图1所示装置验证质量守恒定律。点燃红磷前电子天平示数为106.23 g(见图1)。验证质量守恒定律后,待白烟完全沉降取下橡胶塞,片刻后再一起称量,电子天平示数稳定为106.28 g(见图2)。
回答下列问题:
(1)仪器甲的名称为 (填“锥形瓶”或“烧杯”)。
(2)计算参加反应红磷的质量(结果精确到0.01 g)。
6.根据图示实验过程和所提供的数据进行计算(反应的化学方程式为Zn+H2SO4ZnSO4+H2↑):
(1)生成氢气的质量为 g。
(2)Cu-Zn合金中铜的质量分数(写出计算过程)。
表格型计算
7.某同学为测定实验室里高锰酸钾样品的质量分数,取16.0 g该样品进行加热,在加热过程中测定了剩余固体和容器的总质量如表所示。求:
时间 t0 t1 t2 t3 t4 t5
测量质量/g 48.2 48.2 47.8 47.3 46.6 46.6
(1)盛放高锰酸钾的容器质量= 。
(2)该样品中高锰酸钾的质量分数是多少
8.(2025淄博月考)兴趣小组同学要测定某石灰石样品中碳酸钙的质量分数。称量20 g石灰石样品放入烧杯中,取60 g稀盐酸分三次加入其中,每次充分反应后,测定生成二氧化碳的质量,实验数据如表所示:
实验次数 第一次 第二次 第三次
加入稀盐酸的质量/g 20 20 20
生成CO2的质量/g 2.2 m 1.1
提示:稀盐酸是氯化氢气体的水溶液,CaCO3+2HClCaCl2+H2O+CO2↑。
(1)表中m的数值是 。
(2)计算石灰石矿中碳酸钙的质量分数。
【详解答案】
1.解:(1)4.5 (2)过滤
(3)设受热分解的氯酸钾的质量为x。
2KClO32KCl+3O2↑
245 96
x 4.8 g
=
x=12.25 g
答:受热分解的氯酸钾的质量为12.25 g。
解析:(1)根据质量守恒定律,化学反应前后物质的总质量不变,则a=18.2+4.8-18.5=4.5。(2)小组同学欲从反应后的剩余固体中回收二氧化锰,主要操作步骤为加水溶解、过滤、洗涤、干燥。
2.解:(1)13
设参加反应的碳化钙的质量为x。
CaC2+2H2OCa(OH)2+C2H2↑
64 26
x 13 g
=
x=32 g
答:参加反应的碳化钙的质量为32 g。
3.解:(1)生成氧气的质量为70 g-66.8 g=3.2 g。
设过氧化氢的质量为x。
2H2O22H2O+O2↑
68 32
x 3.2 g
=
x=6.8 g
答:过氧化氢溶液中过氧化氢的质量为6.8 g。
(2)反应结束后锥形瓶内剩余物质是水和二氧化锰,二氧化锰是该反应的催化剂,在反应前后二氧化锰的质量不变,是2 g。水的质量=66.8 g-2 g=64.8 g。
4.解:(1)4.4
(2)设参加反应的碳酸钠质量为x。
Na2CO3+2HCl2NaCl+H2O+CO2↑
106 44
x 4.4 g
=
x=10.6 g
则原样品中碳酸钠的质量分数为×100%=84.8%
答:原样品中碳酸钠的质量分数为84.8%。
5.解:(1)锥形瓶
(2)参加反应的氧气的质量为106.28 g-106.23 g=0.05 g。
设参加反应的红磷的质量为x。
4P + 5O22P2O5
124 160
x 0.05 g
=
x≈0.04 g
答:参加反应的红磷的质量为0.04 g。
解析:该实验中,红磷燃烧消耗氧气,待完全反应后,逐渐冷却至室温,由于消耗了氧气,装置内压强减小,打开橡胶塞,空气进入装置中,进入装置内空气的质量约等于消耗氧气的质量。
6.解:(1)0.2
(2)设合金中锌的质量为x。
Zn+H2SO4ZnSO4+H2↑
65 2
x 0.2 g
=
x=6.5 g
Cu-Zn合金中铜的质量分数为×100%=75%
答:Cu-Zn合金中铜的质量分数为75%。
7.解:(1)32.2 g
(2)反应生成氧气质量为48.2 g-46.6 g=1.6 g,设KMnO4的质量为x。
2KMnO4K2MnO4+MnO2+O2↑
316 32
x 1.6 g
=
x=15.8 g
样品中KMNO4的质量分数为15.8 g÷16.0 g×100%=98.75%
答:样品中KMNO4的质量分数为98.75%。
8.解:(1)2.2
(2)由表中数据可知,生成二氧化碳的总质量为2.2 g+2.2 g+1.1 g=5.5 g。
设石灰石矿中碳酸钙的质量为x。
CaCO3+2HClCaCl2+H2O+CO2↑
100 44
x 5.5 g
=
x=12.5 g
石灰石矿中碳酸钙的质量分数为×100%=62.5%
答:石灰石矿中碳酸钙的质量分数为62.5%。
解析:(1)第一次加入20 g盐酸后生成了2.2 g的二氧化碳,第三次加入20 g盐酸只生成了1.1 g的二氧化碳,所以第二次加入20 g盐酸后,碳酸钙还有剩余,20 g盐酸完全反应,m=2.2。
文字表述型计算
1.(2025西安期中)实验室有一瓶含杂质的氯酸钾,某兴趣小组的同学利用该试剂和二氧化锰制取氧气(杂质不溶于水也不参加反应),实验数据如下图,请回答下列问题:
(1)a= g。
(2)小组同学欲从反应后的剩余固体中回收二氧化锰,主要操作步骤为加水溶解、 、洗涤、干燥。
(3)计算受热分解的氯酸钾的质量(写出计算过程)。
2.乙炔(C2H2)是一种重要的化工原料,工业上常用碳化钙(CaC2)与水反应制取乙炔,同时生成氢氧化钙。现小明取含杂质的碳化钙与适量的水放在相应装置中模拟工业制取乙炔气体(杂质没有参加反应),已知所用含杂质的碳化钙与水的总质量是58 g,反应后装置中剩余物质的总质量为45 g。计算:
(1)反应过程中生成的乙炔气体的质量为 g。
(2)参加反应的碳化钙的质量。[已知:CaC2+2H2OCa(OH)2+C2H2↑]
图像型计算
3.实验室用68 g过氧化氢溶液(过氧化氢和水的混合物)和2 g二氧化锰制取氧气,实验中锥形瓶内非气态物质的总质量随时间变化如图所示。
回答下列问题:
(1)过氧化氢溶液中的过氧化氢的质量。
(2)反应结束后锥形瓶内剩余物质有哪些,分别是多少克
4.学校项目学习小组到超市买了一包碱面,包装袋上标明主要成分是碳酸钠(Na2CO3),还含有少量的氯化钠(NaCl)。该兴趣小组为研究其成分,称取样品12.5 g放入烧杯中,再向其中逐滴加入127.9 g稀盐酸(氯化氢的水溶液),碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳。
请计算:
(1)样品充分反应后生成CO2的质量为 g。
(2)求原样品中碳酸钠的质量分数。
图解实验型计算
5.(2024武汉中考)化学项目小组用图1所示装置验证质量守恒定律。点燃红磷前电子天平示数为106.23 g(见图1)。验证质量守恒定律后,待白烟完全沉降取下橡胶塞,片刻后再一起称量,电子天平示数稳定为106.28 g(见图2)。
回答下列问题:
(1)仪器甲的名称为 (填“锥形瓶”或“烧杯”)。
(2)计算参加反应红磷的质量(结果精确到0.01 g)。
6.根据图示实验过程和所提供的数据进行计算(反应的化学方程式为Zn+H2SO4ZnSO4+H2↑):
(1)生成氢气的质量为 g。
(2)Cu-Zn合金中铜的质量分数(写出计算过程)。
表格型计算
7.某同学为测定实验室里高锰酸钾样品的质量分数,取16.0 g该样品进行加热,在加热过程中测定了剩余固体和容器的总质量如表所示。求:
时间 t0 t1 t2 t3 t4 t5
测量质量/g 48.2 48.2 47.8 47.3 46.6 46.6
(1)盛放高锰酸钾的容器质量= 。
(2)该样品中高锰酸钾的质量分数是多少
8.(2025淄博月考)兴趣小组同学要测定某石灰石样品中碳酸钙的质量分数。称量20 g石灰石样品放入烧杯中,取60 g稀盐酸分三次加入其中,每次充分反应后,测定生成二氧化碳的质量,实验数据如表所示:
实验次数 第一次 第二次 第三次
加入稀盐酸的质量/g 20 20 20
生成CO2的质量/g 2.2 m 1.1
提示:稀盐酸是氯化氢气体的水溶液,CaCO3+2HClCaCl2+H2O+CO2↑。
(1)表中m的数值是 。
(2)计算石灰石矿中碳酸钙的质量分数。
【详解答案】
1.解:(1)4.5 (2)过滤
(3)设受热分解的氯酸钾的质量为x。
2KClO32KCl+3O2↑
245 96
x 4.8 g
=
x=12.25 g
答:受热分解的氯酸钾的质量为12.25 g。
解析:(1)根据质量守恒定律,化学反应前后物质的总质量不变,则a=18.2+4.8-18.5=4.5。(2)小组同学欲从反应后的剩余固体中回收二氧化锰,主要操作步骤为加水溶解、过滤、洗涤、干燥。
2.解:(1)13
设参加反应的碳化钙的质量为x。
CaC2+2H2OCa(OH)2+C2H2↑
64 26
x 13 g
=
x=32 g
答:参加反应的碳化钙的质量为32 g。
3.解:(1)生成氧气的质量为70 g-66.8 g=3.2 g。
设过氧化氢的质量为x。
2H2O22H2O+O2↑
68 32
x 3.2 g
=
x=6.8 g
答:过氧化氢溶液中过氧化氢的质量为6.8 g。
(2)反应结束后锥形瓶内剩余物质是水和二氧化锰,二氧化锰是该反应的催化剂,在反应前后二氧化锰的质量不变,是2 g。水的质量=66.8 g-2 g=64.8 g。
4.解:(1)4.4
(2)设参加反应的碳酸钠质量为x。
Na2CO3+2HCl2NaCl+H2O+CO2↑
106 44
x 4.4 g
=
x=10.6 g
则原样品中碳酸钠的质量分数为×100%=84.8%
答:原样品中碳酸钠的质量分数为84.8%。
5.解:(1)锥形瓶
(2)参加反应的氧气的质量为106.28 g-106.23 g=0.05 g。
设参加反应的红磷的质量为x。
4P + 5O22P2O5
124 160
x 0.05 g
=
x≈0.04 g
答:参加反应的红磷的质量为0.04 g。
解析:该实验中,红磷燃烧消耗氧气,待完全反应后,逐渐冷却至室温,由于消耗了氧气,装置内压强减小,打开橡胶塞,空气进入装置中,进入装置内空气的质量约等于消耗氧气的质量。
6.解:(1)0.2
(2)设合金中锌的质量为x。
Zn+H2SO4ZnSO4+H2↑
65 2
x 0.2 g
=
x=6.5 g
Cu-Zn合金中铜的质量分数为×100%=75%
答:Cu-Zn合金中铜的质量分数为75%。
7.解:(1)32.2 g
(2)反应生成氧气质量为48.2 g-46.6 g=1.6 g,设KMnO4的质量为x。
2KMnO4K2MnO4+MnO2+O2↑
316 32
x 1.6 g
=
x=15.8 g
样品中KMNO4的质量分数为15.8 g÷16.0 g×100%=98.75%
答:样品中KMNO4的质量分数为98.75%。
8.解:(1)2.2
(2)由表中数据可知,生成二氧化碳的总质量为2.2 g+2.2 g+1.1 g=5.5 g。
设石灰石矿中碳酸钙的质量为x。
CaCO3+2HClCaCl2+H2O+CO2↑
100 44
x 5.5 g
=
x=12.5 g
石灰石矿中碳酸钙的质量分数为×100%=62.5%
答:石灰石矿中碳酸钙的质量分数为62.5%。
解析:(1)第一次加入20 g盐酸后生成了2.2 g的二氧化碳,第三次加入20 g盐酸只生成了1.1 g的二氧化碳,所以第二次加入20 g盐酸后,碳酸钙还有剩余,20 g盐酸完全反应,m=2.2。
同课章节目录
