2.3.2 氧气的实验室制备 教学课件(共27张PPT,内嵌视频)
文档属性
| 名称 | 2.3.2 氧气的实验室制备 教学课件(共27张PPT,内嵌视频) |  | |
| 格式 | pptx | ||
| 文件大小 | 81.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-30 17:11:23 | ||
图片预览




文档简介
(共27张PPT)
沪教版(2024)九年级化学上册
第2章 空气与水资源
2.3.2 氧气的制备
2 .3 氧气的制备
一、从空气中 分离出氧气
02
二、利用化学反应制备氧气
01
学习目标
能运用化学原理设计氧气的实验
室制备方案,初步学习氧气制备的实验操作,养成严格遵守实验规则的意
识,初步形成实验室制备气体的一般思路。
(1) 能认识工业制取氧气的思路和方法;能依据
观察的实验现象初步推断空气的主要成分;
(2)能运用化学原理设计氧气的实验室制备方案,
初步形成实验室制备气体的一般思路。
(3) 初步学习氧气制备的实验操作,养成严格
遵守实验规则的意识
学习重点
学习难点
1.实验装置的选择与组装。
2.催化剂的作用机制及 “催化作用” 与 “化学反应速率” 的关系。
3.工业制氧的原理与实验室制氧的本质区别。
学习重难点
1.实验室制取氧气的两种方法的反应原理、实验装置、操作步骤及注意事项。
2.分解反应的概念及实例判断,催化剂的定义及作用。
3.氧气的收集方法选择依据及验满方法。
二、利用化学反应制备氧气
新课导入
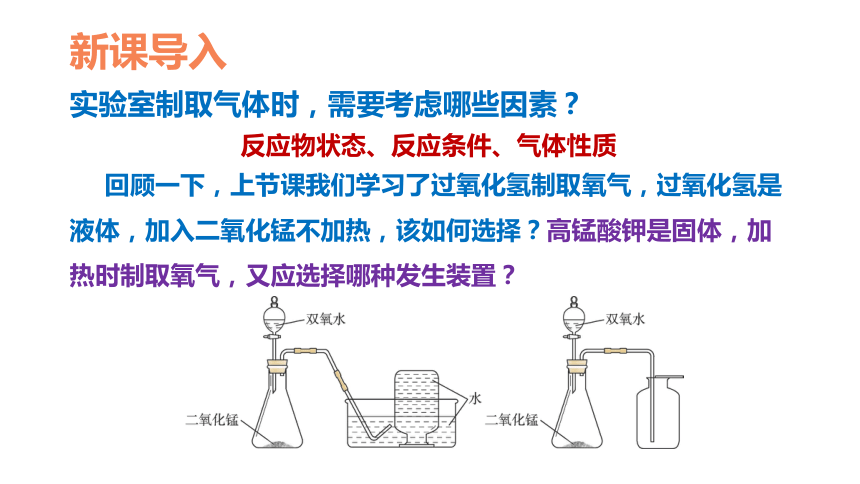
实验室制取气体时,需要考虑哪些因素?
反应物状态、反应条件、气体性质
回顾一下,上节课我们学习了过氧化氢制取氧气,过氧化氢是液体,加入二氧化锰不加热,该如何选择?高锰酸钾是固体,加热时制取氧气,又应选择哪种发生装置?
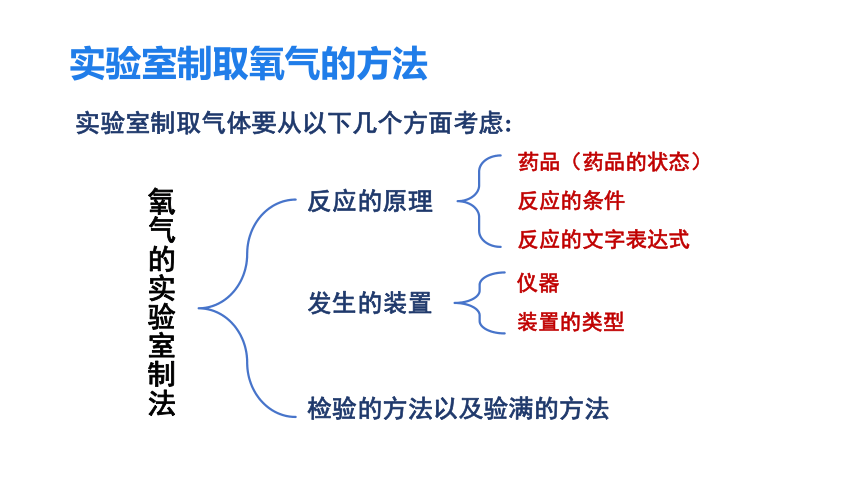
实验室制取氧气的方法
实验室制取气体要从以下几个方面考虑:
氧气的实验室制法
反应的原理
药品(药品的状态)
反应的条件
反应的文字表达式
发生的装置
仪器
装置的类型
检验的方法以及验满的方法
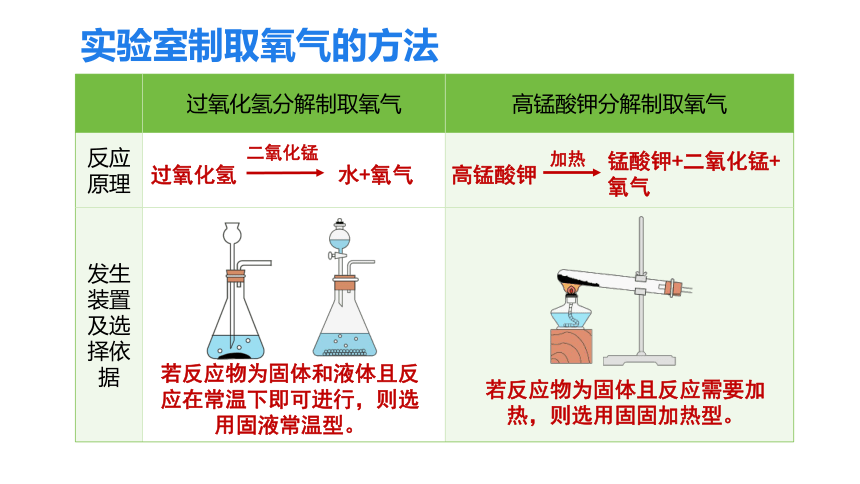
过氧化氢分解制取氧气 高锰酸钾分解制取氧气
反应原理
发生装置及选择依据
若反应物为固体且反应需要加热,则选用固固加热型。
若反应物为固体和液体且反应在常温下即可进行,则选用固液常温型。
高锰酸钾
加热
锰酸钾+二氧化锰+氧气
过氧化氢
二氧化锰
水+氧气
实验室制取氧气的方法
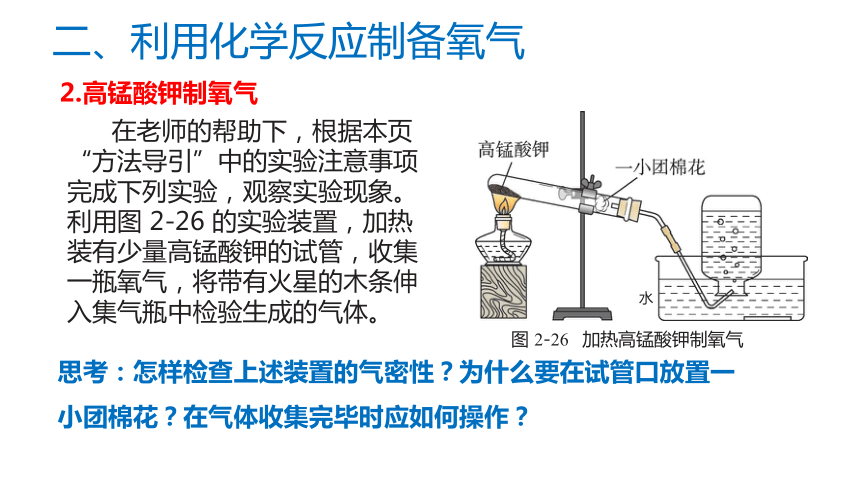
思考:怎样检查上述装置的气密性?为什么要在试管口放置一小团棉花?在气体收集完毕时应如何操作?
在老师的帮助下,根据本页“方法导引”中的实验注意事项完成下列实验,观察实验现象。
利用图 2-26 的实验装置,加热装有少量高锰酸钾的试管,收集一瓶氧气,将带有火星的木条伸入集气瓶中检验生成的气体。
图 2-26 加热高锰酸钾制氧气
水
2.高锰酸钾制氧气
二、利用化学反应制备氧气
2.高锰酸钾制氧气
实验原理:
实验步骤:
实验试剂:
高锰酸钾粉末(暗紫色固体)
(1).查
连接好装置,先将导管末端放入水中,再用手紧握试管,若观察到导管口有气泡冒出,移开手后过一段时间,导管中形成一段水柱,说明装置气密性良好;
2.高锰酸钾制氧气
2.高锰酸钾制氧气
(3).定
(4).点
铁夹夹在试管的中上部(或距试管口1/4~1/3 处),并使试管口略向下倾斜 (防止冷凝水流至热的试管底部,引起试管炸裂);
点燃酒精灯,先用酒精灯对试管预热,然后对准试剂部位加热,防止试管因受热不均匀而炸裂;
(2).装
将试剂平铺在试管底部(增大受热面积,便于均匀受热),并在试管口放一小团棉花,用单孔橡皮塞塞紧;
防止高锰酸钾粉末进入导管堵塞导管
2.高锰酸钾制氧气
(5).收
集气瓶内装满水,倒扣在水槽中(瓶口在水面下),当导管口有气泡连续均匀地冒出时,开始收集(否则收集的氧气中混有空气)。当有气泡从瓶口向外冒时表明瓶内已经集满氧气,在水下盖好玻璃片取出,正放在桌面上(氧气的密度比空气的大,正放可减少氧气的逸散)
(6).离
(7).熄
实验结束后,先将导管从水槽中撤离,后熄灭酒精灯(防止水槽中的水倒吸,炸裂试管)
2.高锰酸钾制氧气
1
2
3
4
5
6
7
仪器连接
① 将玻璃管口用水润湿,稍用力将玻璃管插入胶皮管。
② 将玻璃管口用水润湿,对准胶塞的孔稍用力转动插入。
③ 手拿容器 ( 切勿抵桌面 ),将胶塞慢慢转动旋进容器口。
2.高锰酸钾制氧气
装置气密性的检查
方法:把导气管的一端浸入水中,用手紧握试管或热毛巾捂住试管,一段时间后把手或热毛巾移开。
现象:开始时看到导管口有气泡冒出,手或热毛巾移开一段时间后,导管中会形成一段水柱。
2.高锰酸钾制氧气
方法导引
2. 在试管口放置一小团棉花,防止高锰酸钾粉末进入导管造成堵塞或污染水槽。
1. 检查装置的气密性。
3. 气体收集完毕时,应先将导管移出水面,再熄灭酒精灯,以免因试管内压强减小而产生倒吸现象。
01
02
03
高锰酸钾分解制氧气实验的注意事项
实验室中,还可加热氯酸钾(KClO3 )和二氧化锰的固体混合物
来制取氧气。该反应中二氧化锰是催化剂。
氯酸钾 氯化钾 + 氧气
KClO3 KCl O2
根据氯酸钾(KClO3 )分解制氧气的化学原理,
设计实验装置,并说明实验操作的具体要求。
3.氯酸钾制氧气
学以致用
加热
二氧化锰
①检查装置的气密性;②加入试剂并固定仪器;③点燃酒精灯并收集气体;④从水槽中撤出导管;⑤熄灭酒精灯
实验试剂:
氯酸钾(白色固体)、二氧化锰(黑色粉末)
实验步骤:
与高锰酸钾制氧气不同的是,氯酸钾制氧气无需放棉花
3.氯酸钾制氧气
二、利用化学反应制备氧气
(1)利用化学反应制备物质,应选择价廉易得的物质为原料;
(2)物质制备的装置要安全可靠,物质制备反应的条件要便于控制,生成物要易于分离和收集;
(3)物质制备过程中能源的消耗要尽可能少,要尽量避免对环境造成不利的影响。
物质制备的要求
1.分解反应
分解反应的概念
由一种物质生成两种或两种以上其他物质的反应,叫作分解反应
表达式:AB→A+B 一变多
反应类型 化合反应 分解反应
定义
形式
参加反应的 物质种类
生成物质的 种类
共性 化合反应与分解反应
由两种或两种以上的物质生成另一种物质的反应
由一种物质生成两种或两种以上其他物质的反应
A+B→ AB(多变一)
AB→A+B (一变多)
两种或两种以上
一种
一种
两种或两种以上
都是化学反应的基本类型,并列关系
归纳总结
氧气的制取
氧气的工业制法
氧气的实验室制法
实验原理
实验步骤
实验装置
检验验满
高锰酸钾分解
过氧化氢分解
发生装置
收集装置
催化剂和催化作用
分解反应
氯酸钾分解
1. 下列关于实验室制取氧气的说法中正确的是( )
A.实验室制取氧气的方法都要用到催化剂
B.用排水法收集和用向上排空气法收集时,验满的方法一样
C.用氯酸钾制取氧气的发生装置与用高锰酸钾制取氧气的发生装置一样
D.过氧化氢溶液和二氧化锰混合制得氧气的质量与二氧化锰的质量有关
随堂小测
C
2. 下列有关高锰酸钾制氧气实验中有关实验操作叙述不正确的是
A. 实验时,要先检查装置气密性
B.试管口要塞棉花,防止高锰酸钾粉末通过导管进入水槽
C.试管口略向上倾斜
D. 加热时,要先预热,再集中加热
随堂小测
C
3. 下列变化属于分解反应的是
C
随堂小测
谢 谢
沪教版(2024)九年级化学上册
第2章 空气与水资源
2.3.2 氧气的制备
2 .3 氧气的制备
一、从空气中 分离出氧气
02
二、利用化学反应制备氧气
01
学习目标
能运用化学原理设计氧气的实验
室制备方案,初步学习氧气制备的实验操作,养成严格遵守实验规则的意
识,初步形成实验室制备气体的一般思路。
(1) 能认识工业制取氧气的思路和方法;能依据
观察的实验现象初步推断空气的主要成分;
(2)能运用化学原理设计氧气的实验室制备方案,
初步形成实验室制备气体的一般思路。
(3) 初步学习氧气制备的实验操作,养成严格
遵守实验规则的意识
学习重点
学习难点
1.实验装置的选择与组装。
2.催化剂的作用机制及 “催化作用” 与 “化学反应速率” 的关系。
3.工业制氧的原理与实验室制氧的本质区别。
学习重难点
1.实验室制取氧气的两种方法的反应原理、实验装置、操作步骤及注意事项。
2.分解反应的概念及实例判断,催化剂的定义及作用。
3.氧气的收集方法选择依据及验满方法。
二、利用化学反应制备氧气
新课导入
实验室制取气体时,需要考虑哪些因素?
反应物状态、反应条件、气体性质
回顾一下,上节课我们学习了过氧化氢制取氧气,过氧化氢是液体,加入二氧化锰不加热,该如何选择?高锰酸钾是固体,加热时制取氧气,又应选择哪种发生装置?
实验室制取氧气的方法
实验室制取气体要从以下几个方面考虑:
氧气的实验室制法
反应的原理
药品(药品的状态)
反应的条件
反应的文字表达式
发生的装置
仪器
装置的类型
检验的方法以及验满的方法
过氧化氢分解制取氧气 高锰酸钾分解制取氧气
反应原理
发生装置及选择依据
若反应物为固体且反应需要加热,则选用固固加热型。
若反应物为固体和液体且反应在常温下即可进行,则选用固液常温型。
高锰酸钾
加热
锰酸钾+二氧化锰+氧气
过氧化氢
二氧化锰
水+氧气
实验室制取氧气的方法
思考:怎样检查上述装置的气密性?为什么要在试管口放置一小团棉花?在气体收集完毕时应如何操作?
在老师的帮助下,根据本页“方法导引”中的实验注意事项完成下列实验,观察实验现象。
利用图 2-26 的实验装置,加热装有少量高锰酸钾的试管,收集一瓶氧气,将带有火星的木条伸入集气瓶中检验生成的气体。
图 2-26 加热高锰酸钾制氧气
水
2.高锰酸钾制氧气
二、利用化学反应制备氧气
2.高锰酸钾制氧气
实验原理:
实验步骤:
实验试剂:
高锰酸钾粉末(暗紫色固体)
(1).查
连接好装置,先将导管末端放入水中,再用手紧握试管,若观察到导管口有气泡冒出,移开手后过一段时间,导管中形成一段水柱,说明装置气密性良好;
2.高锰酸钾制氧气
2.高锰酸钾制氧气
(3).定
(4).点
铁夹夹在试管的中上部(或距试管口1/4~1/3 处),并使试管口略向下倾斜 (防止冷凝水流至热的试管底部,引起试管炸裂);
点燃酒精灯,先用酒精灯对试管预热,然后对准试剂部位加热,防止试管因受热不均匀而炸裂;
(2).装
将试剂平铺在试管底部(增大受热面积,便于均匀受热),并在试管口放一小团棉花,用单孔橡皮塞塞紧;
防止高锰酸钾粉末进入导管堵塞导管
2.高锰酸钾制氧气
(5).收
集气瓶内装满水,倒扣在水槽中(瓶口在水面下),当导管口有气泡连续均匀地冒出时,开始收集(否则收集的氧气中混有空气)。当有气泡从瓶口向外冒时表明瓶内已经集满氧气,在水下盖好玻璃片取出,正放在桌面上(氧气的密度比空气的大,正放可减少氧气的逸散)
(6).离
(7).熄
实验结束后,先将导管从水槽中撤离,后熄灭酒精灯(防止水槽中的水倒吸,炸裂试管)
2.高锰酸钾制氧气
1
2
3
4
5
6
7
仪器连接
① 将玻璃管口用水润湿,稍用力将玻璃管插入胶皮管。
② 将玻璃管口用水润湿,对准胶塞的孔稍用力转动插入。
③ 手拿容器 ( 切勿抵桌面 ),将胶塞慢慢转动旋进容器口。
2.高锰酸钾制氧气
装置气密性的检查
方法:把导气管的一端浸入水中,用手紧握试管或热毛巾捂住试管,一段时间后把手或热毛巾移开。
现象:开始时看到导管口有气泡冒出,手或热毛巾移开一段时间后,导管中会形成一段水柱。
2.高锰酸钾制氧气
方法导引
2. 在试管口放置一小团棉花,防止高锰酸钾粉末进入导管造成堵塞或污染水槽。
1. 检查装置的气密性。
3. 气体收集完毕时,应先将导管移出水面,再熄灭酒精灯,以免因试管内压强减小而产生倒吸现象。
01
02
03
高锰酸钾分解制氧气实验的注意事项
实验室中,还可加热氯酸钾(KClO3 )和二氧化锰的固体混合物
来制取氧气。该反应中二氧化锰是催化剂。
氯酸钾 氯化钾 + 氧气
KClO3 KCl O2
根据氯酸钾(KClO3 )分解制氧气的化学原理,
设计实验装置,并说明实验操作的具体要求。
3.氯酸钾制氧气
学以致用
加热
二氧化锰
①检查装置的气密性;②加入试剂并固定仪器;③点燃酒精灯并收集气体;④从水槽中撤出导管;⑤熄灭酒精灯
实验试剂:
氯酸钾(白色固体)、二氧化锰(黑色粉末)
实验步骤:
与高锰酸钾制氧气不同的是,氯酸钾制氧气无需放棉花
3.氯酸钾制氧气
二、利用化学反应制备氧气
(1)利用化学反应制备物质,应选择价廉易得的物质为原料;
(2)物质制备的装置要安全可靠,物质制备反应的条件要便于控制,生成物要易于分离和收集;
(3)物质制备过程中能源的消耗要尽可能少,要尽量避免对环境造成不利的影响。
物质制备的要求
1.分解反应
分解反应的概念
由一种物质生成两种或两种以上其他物质的反应,叫作分解反应
表达式:AB→A+B 一变多
反应类型 化合反应 分解反应
定义
形式
参加反应的 物质种类
生成物质的 种类
共性 化合反应与分解反应
由两种或两种以上的物质生成另一种物质的反应
由一种物质生成两种或两种以上其他物质的反应
A+B→ AB(多变一)
AB→A+B (一变多)
两种或两种以上
一种
一种
两种或两种以上
都是化学反应的基本类型,并列关系
归纳总结
氧气的制取
氧气的工业制法
氧气的实验室制法
实验原理
实验步骤
实验装置
检验验满
高锰酸钾分解
过氧化氢分解
发生装置
收集装置
催化剂和催化作用
分解反应
氯酸钾分解
1. 下列关于实验室制取氧气的说法中正确的是( )
A.实验室制取氧气的方法都要用到催化剂
B.用排水法收集和用向上排空气法收集时,验满的方法一样
C.用氯酸钾制取氧气的发生装置与用高锰酸钾制取氧气的发生装置一样
D.过氧化氢溶液和二氧化锰混合制得氧气的质量与二氧化锰的质量有关
随堂小测
C
2. 下列有关高锰酸钾制氧气实验中有关实验操作叙述不正确的是
A. 实验时,要先检查装置气密性
B.试管口要塞棉花,防止高锰酸钾粉末通过导管进入水槽
C.试管口略向上倾斜
D. 加热时,要先预热,再集中加热
随堂小测
C
3. 下列变化属于分解反应的是
C
随堂小测
谢 谢
同课章节目录
