安徽省合肥市一六八中学2024-2025学年高二下学期期末考试化学试卷(含答案)
文档属性
| 名称 | 安徽省合肥市一六八中学2024-2025学年高二下学期期末考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-30 14:05:09 | ||
图片预览



文档简介
合肥一六八中学2023级高二期末调研试卷
化学试题
注意事项:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间75分钟。
2.可能用到的相对原子质量: Be 9 O 16 Cl 35.5 Mn 55
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1. 化学与生活、生产密切相关。下列说法正确的是
A. 聚合蕴酸铁[Fe2(OH)x(SO4)y]n是一种新型絮凝剂,可用于杀灭水中病菌
B. 《吕氏春秋别类》中“金(即铜)柔锡柔,合两柔则钢”,体现合金硬度特性
C. “自古书契多输以竹简,其用缣帛者(丝质品)谓之为纸”,文中的纸主要成分是纤维素
D. “司南之杓(勺),投之于地,其柢(勺柄)指南”,司南的杓中含有Fe2O3
NA为阿伏加德罗常数的值。下列叙述正确的是
A.足量的浓盐酸与8.7g MnO2反应,转移电子的数目为0.2NA
B.标准状况下,2.24 L SO3中电子的数目为4.00NA
C.0.50 mol C3H6分子中键的数目为4NA
D.1.0 mol·L-1的HCOONa溶液中HCOO-的数目小于1.0NA
我国科研人员在嫦娥五号带回的月球样本中,发现了富含水分子、铵和氯的未知矿物晶体,且该矿物
中氯的同位素组成和地球矿物显著不同。下列说法正确的是
A.和互为同素异形体
B.NH4Cl的电子式为
C.该未知晶体中一定含极性键、非极性键和离子键
D.H2O的形成过程可表示为
4. 下列指定反应的离子方程式正确的是
A. 漂白粉溶液中通入少量CO2气体:
B. 用惰性电极电解水溶液:
C.用高锰酸钾标准溶液滴定草酸:
D. 用溶液吸收少量:
5. 某天然有机物M具有抗肿瘤生物活性的作用,其结构如图所示,下列有关M的说法正确的是
A.含3种官能团
B.分子中至少有11个碳原子一定共面
C.能发生氧化、取代、加成、消去反应
D.遇溶液会发生显色反应
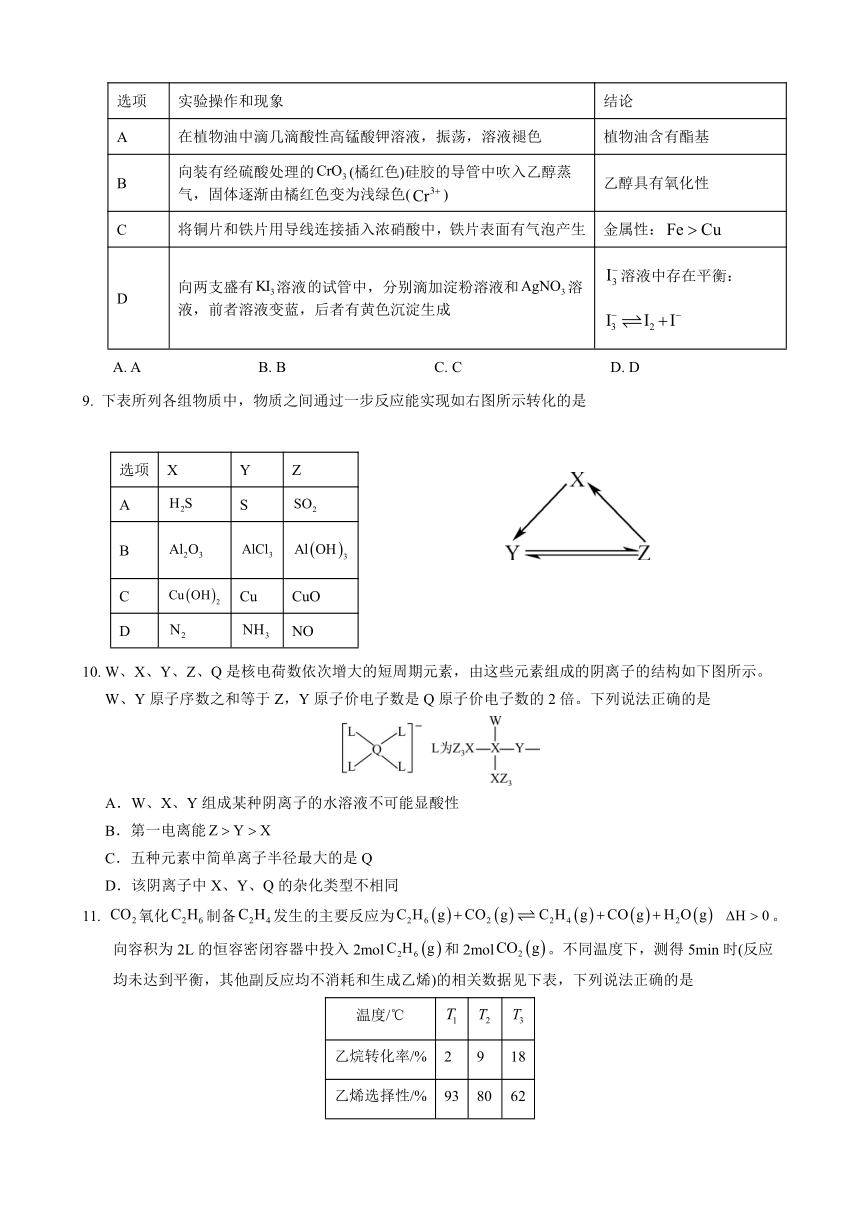
8. 根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 结论
A 在植物油中滴几滴酸性高锰酸钾溶液,振荡,溶液褪色 植物油含有酯基
B 向装有经硫酸处理的(橘红色)硅胶的导管中吹入乙醇蒸气,固体逐渐由橘红色变为浅绿色() 乙醇具有氧化性
C 将铜片和铁片用导线连接插入浓硝酸中,铁片表面有气泡产生 金属性:
D 向两支盛有溶液试管中,分别滴加淀粉溶液和溶液,前者溶液变蓝,后者有黄色沉淀生成 溶液中存在平衡:
A. A B. B C. C D. D
9. 下表所列各组物质中,物质之间通过一步反应能实现如右图所示转化的是
选项 X Y Z
A S
B
C Cu CuO
D NO
10. W、X、Y、Z、Q是核电荷数依次增大的短周期元素,由这些元素组成的阴离子的结构如下图所示。W、Y原子序数之和等于Z,Y原子价电子数是Q原子价电子数的2倍。下列说法正确的是
A.W、X、Y组成某种阴离子的水溶液不可能显酸性
B.第一电离能
C.五种元素中简单离子半径最大的是Q
D.该阴离子中X、Y、Q的杂化类型不相同
11. 氧化制备发生的主要反应为 。向容积为2L的恒容密闭容器中投入2mol和2mol。不同温度下,测得5min时(反应均未达到平衡,其他副反应均不消耗和生成乙烯)的相关数据见下表,下列说法正确的是
温度/℃
乙烷转化率/% 2 9 18
乙烯选择性/% 93 80 62
注:乙烯选择性。
A.℃,0 5min内,平均速率molLmin
B.℃,5min时,容器内的物质的量为0.04mol
C.反应达到平衡后,其他条件不变,仅升高温度,平衡向逆反应方向移动
D.该反应仅在低温条件下能正向自发进行
12. 随着工业发展,空气污染也日益严重,其中NOx是主要污染源,最近科学家制备出了规整形貌的硫酸改性Fe2O3催化剂,该催化剂具有很好的NH3-SCR催化效果。研究表明,经过硫酸改性后的六方盘状Fe2O3催化活性和N2选择性都得到了极大的提升,催化流程如图所示。
下列说法不正确的是
A. 硫酸改性后的六方盘状Fe2O3催化剂提高了NOx的去除率
B. 该过程可能发生的反应有
C.反应a为化合反应
D.该反应的催化剂为
13. 利用下图所示装置可合成己二腈[]。充电时生成己二腈,放电时生成,其中a、b是互为反置的双极膜,双极膜中的会解离出和向两极移动。下列说法正确的是
A.放电时M极为负极,发生氧化反应
B.充电时,N极的电极反应式为
C.充电时,每生成,双极膜解离
D.放电时,双极膜中向N极移动
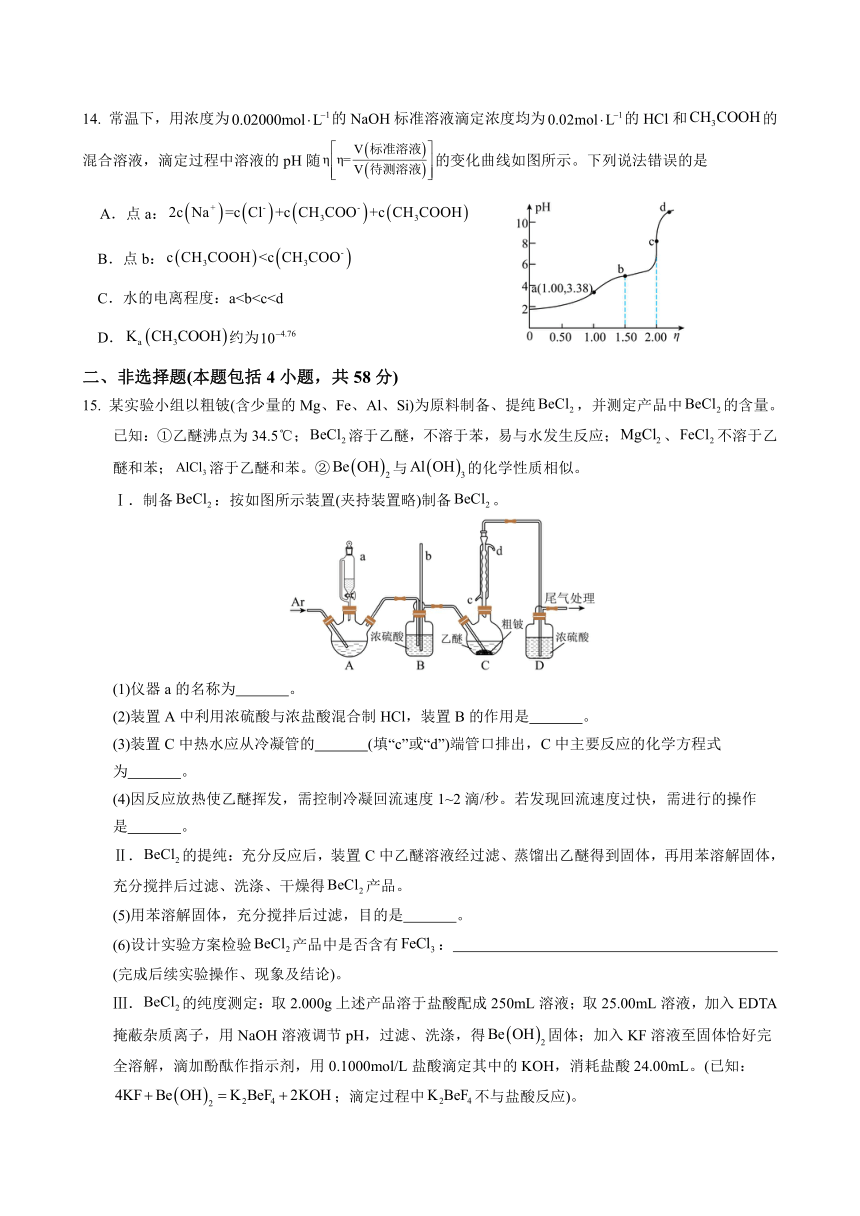
14. 常温下,用浓度为的NaOH标准溶液滴定浓度均为的HCl和的混合溶液,滴定过程中溶液的pH随的变化曲线如图所示。下列说法错误的是
A.点a:
B.点b:
C.水的电离程度:aD.约为
二、非选择题(本题包括4小题,共58分)
15. 某实验小组以粗铍(含少量的Mg、Fe、Al、Si)为原料制备、提纯,并测定产品中的含量。已知:①乙醚沸点为34.5℃;溶于乙醚,不溶于苯,易与水发生反应;、不溶于乙醚和苯;溶于乙醚和苯。②与的化学性质相似。
Ⅰ.制备:按如图所示装置(夹持装置略)制备。
(1)仪器a的名称为 。
(2)装置A中利用浓硫酸与浓盐酸混合制HCl,装置B的作用是 。
(3)装置C中热水应从冷凝管的 (填“c”或“d”)端管口排出,C中主要反应的化学方程式为 。
(4)因反应放热使乙醚挥发,需控制冷凝回流速度1~2滴/秒。若发现回流速度过快,需进行的操作是 。
Ⅱ.的提纯:充分反应后,装置C中乙醚溶液经过滤、蒸馏出乙醚得到固体,再用苯溶解固体,充分搅拌后过滤、洗涤、干燥得产品。
(5)用苯溶解固体,充分搅拌后过滤,目的是 。
(6)设计实验方案检验产品中是否含有: (完成后续实验操作、现象及结论)。
Ⅲ.的纯度测定:取2.000g上述产品溶于盐酸配成250mL溶液;取25.00mL溶液,加入EDTA掩蔽杂质离子,用NaOH溶液调节pH,过滤、洗涤,得固体;加入KF溶液至固体恰好完全溶解,滴加酚酞作指示剂,用0.1000mol/L盐酸滴定其中的KOH,消耗盐酸24.00mL。(已知:;滴定过程中不与盐酸反应)。
(7)用NaOH溶液调节pH不能过大,其原因为 (用化学方程式表示)。
(8)的纯度为 。
16. 以某废料(主要成分为、Al、碳粉等)为原料制备、、的流程如下:
已知:的溶解度与温度关系如表所示:
温度/℃ 20 40 60 80
溶解度/g 1.33 1.17 1.01 0.85
回答下列问题:
(1)“碱浸”目的是_____。
(2)料渣A的主要成分是_____(填化学式);处理“料液B”后用_____(填“热”或“冷”)水洗晶体。
(3)操作A包括蒸发浓缩、降温结晶、过滤、洗涤、减压低温烘干,其中“减压低温烘干”的目的是_____。
(4)“氧化1”中绿色氧化剂X宜选择或_____(填化学式)。
(5)“氧化2”中离子方程式为_____。
(6)“调pH”过程中,相同条件下铁、磷元素沉淀率与纯碱溶液体积关系如图所示。纯碱溶液过多时,磷元素的沉淀率下降的原因可能是_____。
17.氨是一种重要的化工产品。回答下列问题:
(1)已知:①N2(g)+3H2(g)2NH3(g) ΔH=-92.0kJ/mol
②H2(g)+O2(g)H2O(g) ΔH=-240.0kJ/mol
③2Fe(s)+O2(g)Fe2O3(s) ΔH=-1644.0kJ/mol
则反应2NH3(g)+Fe2O3(s)N2(g)+3H2O(g)+2Fe(s) ΔH= kJ/mol,该反应在 (填“高温”“低温”或“任意温度”)下能自发进行。
(2)下列关于合成氨工艺的理解中,正确的有___________(填标号)。
A.控制温度远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
B.合成氨反应在不同温度下的ΔH和ΔS都小于零
C.NH3易液化,不断将液氨移去,利于反应正向进行
D.原料气中N2由分离空气得到,H2由天然气与水蒸气反应生成,原料气需要经过净化处理,以防催化剂中毒和安全事故发生
(3)温度为T℃,压强恒定为pMPa,用Fe2O3处理NH3和HCN(起始时NH3的体积分数为58%)的混合气体,部分气体的体积分数随时间的变化如图,反应经30min达到平衡。
①0~30min内用NH3的压强变化表示的反应速率v(NH3)= MPa·min-1。
②反应2NH3(g)+Fe2O3(s)N2(g)+3H2O(g)+2Fe(s)的平衡常数Kp= (MPa)2 (列出计算式即可);若降低温度,该反应的平衡常数将 (填“增大”“减小”或“不变”)。
(4)在催化剂作用下,可用NH3去除NO,其反应原理为4NH3+6NO=5N2+6H2O。不同温度条件下,n(NH3):n(NO)分别为4:1、3∶1、1:3时,得到的NO脱除率曲线如图所示:
①曲线a中,在温度超过900℃时,NO脱除率骤然下降的原因可能是 。
②曲线c对应的NH3与NO的物质的量之比是 。
18. (15分)以甲苯为原料制备羧酸的流程如下:
请回答下列问题:
(1)X的名称为 。
(2)F中所含官能团的名称为 ;的反应类型是 。
(3)写出E→F的化学方程式: 。
(4)下列叙述正确的是 (填标号)。
a.A能使酸性KMnO4溶液褪色
b.E、F中碳原子都只有2种杂化类型
c.D、G可形成分子间氢键,所以它们的熔点较低
(5)A的二氯代物有 种,其中,在核磁共振氢谱上有3组峰的结构简式有 (任写一种)。
(6)以和为原料合成,设计合成路线 (其他试剂自选)。
合肥一六八中学2023级高二期末调研
参考答案
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1.【答案】B
【解析】
【详解】A.新型絮凝剂可以吸附水中杂质,达到净水的目的,并不能起到杀菌作用,A错误;
B.体现了合金硬度大于其成分金属的硬度,B正确;
C.丝质品主要成分为蛋白质,不是纤维素,C错误;
D.该段描述的是指南针,司南中的“勺”指的是磁铁,即司南中的“勺”含有Fe3O4,D错误;
2. 【答案】A
【解析】A.浓盐酸足量,MnO2物质的量为0.1 mol,完全反应转移电子数为0.2NA
A项正确;B. 标况下,SO3为固态,物质的量无法求出,B错误;C. C3H6可能是丙烯,也可能是环丙烷,1个环丙烷分子有9个键,0.50 mol则为4.5NA;若为丙烯,则键数目为4NA,,C项错误;D. HCOO-会水解,且溶液体积未知,D项错误。
3. 【答案】D
4. 【答案】D
【解析】
【详解】A.二氧化碳过量才会生成碳酸氢根,故A错误;
B.用惰性电极电解水溶液,阳极氯离子放电生成氯气,阴极铜离子得电子生成铜:,故B错误;
C.草酸是弱电解质不能拆,故C错误;
D.用溶液吸收少量生成亚硫酸氢钠:,故D正确;
5. 【答案】B
8. 【答案】D
【解析】
【详解】A.因为植物油的结构中含有碳碳双键,可以使酸性高锰酸钾溶液褪色,A项错误;
B.中为+6价,价态较高,具有氧化性,加入乙醇后被还原为浅绿色的,说明乙醇具有还原性,B项错误;
C.铁与浓硝酸发生钝化,铜作负极,不能证明铁与铜的金属性强弱,C项错误;
D.滴加淀粉溶液变蓝,说明含有碘单质,滴加硝酸银产生黄色沉淀,说明含有,所以溶液中含、,即溶液中存在平衡,D项正确;
9. 【答案】B
【解析】
【详解】A.二氧化硫不能一步得到硫化氢,A错误;
B.与HCl反应得到,与氨水反应得到,与HCl反应得到,与HCl反应得到,B正确;
C.无法一步反应得到Cu,氧化铜不能溶于水得到氢氧化铜,C错误;
D. NO无法一步得到,所以无法实现转化,D错误;
10. 【答案】B
11. 【答案】A
12. 【答案】D
【解析】
【详解】A.由题干可知,经过硫酸改性后的六方盘状Fe2O3催化剂活性和选择性都得到了极大提升,故硫酸改性后六方盘状Fe2O3催化剂提高了NOx的去除率,A正确;
B.根据该催化流程,该过程可能发生的反应有,B正确;
C.反应a为NO、NH3和发生化合反应生成,C正确;
D.该反应的催化剂为硫酸改性后的六方盘状Fe2O3,结合题图可知,该反应的催化剂为,D错误;
13. 【答案】B
14. 【答案】C
二、非选择题(本题包括4小题,共58分)
15. 【答案】(15分,除了标注1分外,每空2分)
(1)恒压分液漏斗或恒压滴液漏斗(1分)
(2)干燥气体(1分)
(3) d (1分) Be+2HCl=BeCl2+H2↑
(4)旋转滴液漏斗活塞,减缓盐酸的滴速
(5)除去AlCl3杂质
(6)取BeCl2产品溶于适量的盐酸中,滴加KSCN溶液,如呈红色,说明含氯化铁
(7)Be(OH)2+2NaOH= Na2Be(OH)4
(8)48%
16. 【答案】 (13分,除了标注1分外,每空2分)
(1)除去铝 (1分)
(2) ①. C ②. 热
(3)避免失去结晶水 (4)
(5)2Fe(OH)3 + 4OH- +3ClO- = 2FeO42- + 3Cl- + 5H2O
(6)碱性增强,生成,部分转化为磷酸钠而损失
17. 【答案】(15分)(除标明外,每空2分)
(1)+1016.0 高温(1分)
(2)BCD
(3)0.019p 减小
(4)催化剂失去活性 1 :3
18. 【答案】(15分,除了标注外,每空2分)
(1)环氧乙烷(1分)
(2) 氰基 (1分) 取代反应
(3)+NaCN+NaBr
(4)a
(5)10 或或
(6)(3分)
化学试题
注意事项:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间75分钟。
2.可能用到的相对原子质量: Be 9 O 16 Cl 35.5 Mn 55
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1. 化学与生活、生产密切相关。下列说法正确的是
A. 聚合蕴酸铁[Fe2(OH)x(SO4)y]n是一种新型絮凝剂,可用于杀灭水中病菌
B. 《吕氏春秋别类》中“金(即铜)柔锡柔,合两柔则钢”,体现合金硬度特性
C. “自古书契多输以竹简,其用缣帛者(丝质品)谓之为纸”,文中的纸主要成分是纤维素
D. “司南之杓(勺),投之于地,其柢(勺柄)指南”,司南的杓中含有Fe2O3
NA为阿伏加德罗常数的值。下列叙述正确的是
A.足量的浓盐酸与8.7g MnO2反应,转移电子的数目为0.2NA
B.标准状况下,2.24 L SO3中电子的数目为4.00NA
C.0.50 mol C3H6分子中键的数目为4NA
D.1.0 mol·L-1的HCOONa溶液中HCOO-的数目小于1.0NA
我国科研人员在嫦娥五号带回的月球样本中,发现了富含水分子、铵和氯的未知矿物晶体,且该矿物
中氯的同位素组成和地球矿物显著不同。下列说法正确的是
A.和互为同素异形体
B.NH4Cl的电子式为
C.该未知晶体中一定含极性键、非极性键和离子键
D.H2O的形成过程可表示为
4. 下列指定反应的离子方程式正确的是
A. 漂白粉溶液中通入少量CO2气体:
B. 用惰性电极电解水溶液:
C.用高锰酸钾标准溶液滴定草酸:
D. 用溶液吸收少量:
5. 某天然有机物M具有抗肿瘤生物活性的作用,其结构如图所示,下列有关M的说法正确的是
A.含3种官能团
B.分子中至少有11个碳原子一定共面
C.能发生氧化、取代、加成、消去反应
D.遇溶液会发生显色反应
8. 根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 结论
A 在植物油中滴几滴酸性高锰酸钾溶液,振荡,溶液褪色 植物油含有酯基
B 向装有经硫酸处理的(橘红色)硅胶的导管中吹入乙醇蒸气,固体逐渐由橘红色变为浅绿色() 乙醇具有氧化性
C 将铜片和铁片用导线连接插入浓硝酸中,铁片表面有气泡产生 金属性:
D 向两支盛有溶液试管中,分别滴加淀粉溶液和溶液,前者溶液变蓝,后者有黄色沉淀生成 溶液中存在平衡:
A. A B. B C. C D. D
9. 下表所列各组物质中,物质之间通过一步反应能实现如右图所示转化的是
选项 X Y Z
A S
B
C Cu CuO
D NO
10. W、X、Y、Z、Q是核电荷数依次增大的短周期元素,由这些元素组成的阴离子的结构如下图所示。W、Y原子序数之和等于Z,Y原子价电子数是Q原子价电子数的2倍。下列说法正确的是
A.W、X、Y组成某种阴离子的水溶液不可能显酸性
B.第一电离能
C.五种元素中简单离子半径最大的是Q
D.该阴离子中X、Y、Q的杂化类型不相同
11. 氧化制备发生的主要反应为 。向容积为2L的恒容密闭容器中投入2mol和2mol。不同温度下,测得5min时(反应均未达到平衡,其他副反应均不消耗和生成乙烯)的相关数据见下表,下列说法正确的是
温度/℃
乙烷转化率/% 2 9 18
乙烯选择性/% 93 80 62
注:乙烯选择性。
A.℃,0 5min内,平均速率molLmin
B.℃,5min时,容器内的物质的量为0.04mol
C.反应达到平衡后,其他条件不变,仅升高温度,平衡向逆反应方向移动
D.该反应仅在低温条件下能正向自发进行
12. 随着工业发展,空气污染也日益严重,其中NOx是主要污染源,最近科学家制备出了规整形貌的硫酸改性Fe2O3催化剂,该催化剂具有很好的NH3-SCR催化效果。研究表明,经过硫酸改性后的六方盘状Fe2O3催化活性和N2选择性都得到了极大的提升,催化流程如图所示。
下列说法不正确的是
A. 硫酸改性后的六方盘状Fe2O3催化剂提高了NOx的去除率
B. 该过程可能发生的反应有
C.反应a为化合反应
D.该反应的催化剂为
13. 利用下图所示装置可合成己二腈[]。充电时生成己二腈,放电时生成,其中a、b是互为反置的双极膜,双极膜中的会解离出和向两极移动。下列说法正确的是
A.放电时M极为负极,发生氧化反应
B.充电时,N极的电极反应式为
C.充电时,每生成,双极膜解离
D.放电时,双极膜中向N极移动
14. 常温下,用浓度为的NaOH标准溶液滴定浓度均为的HCl和的混合溶液,滴定过程中溶液的pH随的变化曲线如图所示。下列说法错误的是
A.点a:
B.点b:
C.水的电离程度:a
二、非选择题(本题包括4小题,共58分)
15. 某实验小组以粗铍(含少量的Mg、Fe、Al、Si)为原料制备、提纯,并测定产品中的含量。已知:①乙醚沸点为34.5℃;溶于乙醚,不溶于苯,易与水发生反应;、不溶于乙醚和苯;溶于乙醚和苯。②与的化学性质相似。
Ⅰ.制备:按如图所示装置(夹持装置略)制备。
(1)仪器a的名称为 。
(2)装置A中利用浓硫酸与浓盐酸混合制HCl,装置B的作用是 。
(3)装置C中热水应从冷凝管的 (填“c”或“d”)端管口排出,C中主要反应的化学方程式为 。
(4)因反应放热使乙醚挥发,需控制冷凝回流速度1~2滴/秒。若发现回流速度过快,需进行的操作是 。
Ⅱ.的提纯:充分反应后,装置C中乙醚溶液经过滤、蒸馏出乙醚得到固体,再用苯溶解固体,充分搅拌后过滤、洗涤、干燥得产品。
(5)用苯溶解固体,充分搅拌后过滤,目的是 。
(6)设计实验方案检验产品中是否含有: (完成后续实验操作、现象及结论)。
Ⅲ.的纯度测定:取2.000g上述产品溶于盐酸配成250mL溶液;取25.00mL溶液,加入EDTA掩蔽杂质离子,用NaOH溶液调节pH,过滤、洗涤,得固体;加入KF溶液至固体恰好完全溶解,滴加酚酞作指示剂,用0.1000mol/L盐酸滴定其中的KOH,消耗盐酸24.00mL。(已知:;滴定过程中不与盐酸反应)。
(7)用NaOH溶液调节pH不能过大,其原因为 (用化学方程式表示)。
(8)的纯度为 。
16. 以某废料(主要成分为、Al、碳粉等)为原料制备、、的流程如下:
已知:的溶解度与温度关系如表所示:
温度/℃ 20 40 60 80
溶解度/g 1.33 1.17 1.01 0.85
回答下列问题:
(1)“碱浸”目的是_____。
(2)料渣A的主要成分是_____(填化学式);处理“料液B”后用_____(填“热”或“冷”)水洗晶体。
(3)操作A包括蒸发浓缩、降温结晶、过滤、洗涤、减压低温烘干,其中“减压低温烘干”的目的是_____。
(4)“氧化1”中绿色氧化剂X宜选择或_____(填化学式)。
(5)“氧化2”中离子方程式为_____。
(6)“调pH”过程中,相同条件下铁、磷元素沉淀率与纯碱溶液体积关系如图所示。纯碱溶液过多时,磷元素的沉淀率下降的原因可能是_____。
17.氨是一种重要的化工产品。回答下列问题:
(1)已知:①N2(g)+3H2(g)2NH3(g) ΔH=-92.0kJ/mol
②H2(g)+O2(g)H2O(g) ΔH=-240.0kJ/mol
③2Fe(s)+O2(g)Fe2O3(s) ΔH=-1644.0kJ/mol
则反应2NH3(g)+Fe2O3(s)N2(g)+3H2O(g)+2Fe(s) ΔH= kJ/mol,该反应在 (填“高温”“低温”或“任意温度”)下能自发进行。
(2)下列关于合成氨工艺的理解中,正确的有___________(填标号)。
A.控制温度远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
B.合成氨反应在不同温度下的ΔH和ΔS都小于零
C.NH3易液化,不断将液氨移去,利于反应正向进行
D.原料气中N2由分离空气得到,H2由天然气与水蒸气反应生成,原料气需要经过净化处理,以防催化剂中毒和安全事故发生
(3)温度为T℃,压强恒定为pMPa,用Fe2O3处理NH3和HCN(起始时NH3的体积分数为58%)的混合气体,部分气体的体积分数随时间的变化如图,反应经30min达到平衡。
①0~30min内用NH3的压强变化表示的反应速率v(NH3)= MPa·min-1。
②反应2NH3(g)+Fe2O3(s)N2(g)+3H2O(g)+2Fe(s)的平衡常数Kp= (MPa)2 (列出计算式即可);若降低温度,该反应的平衡常数将 (填“增大”“减小”或“不变”)。
(4)在催化剂作用下,可用NH3去除NO,其反应原理为4NH3+6NO=5N2+6H2O。不同温度条件下,n(NH3):n(NO)分别为4:1、3∶1、1:3时,得到的NO脱除率曲线如图所示:
①曲线a中,在温度超过900℃时,NO脱除率骤然下降的原因可能是 。
②曲线c对应的NH3与NO的物质的量之比是 。
18. (15分)以甲苯为原料制备羧酸的流程如下:
请回答下列问题:
(1)X的名称为 。
(2)F中所含官能团的名称为 ;的反应类型是 。
(3)写出E→F的化学方程式: 。
(4)下列叙述正确的是 (填标号)。
a.A能使酸性KMnO4溶液褪色
b.E、F中碳原子都只有2种杂化类型
c.D、G可形成分子间氢键,所以它们的熔点较低
(5)A的二氯代物有 种,其中,在核磁共振氢谱上有3组峰的结构简式有 (任写一种)。
(6)以和为原料合成,设计合成路线 (其他试剂自选)。
合肥一六八中学2023级高二期末调研
参考答案
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1.【答案】B
【解析】
【详解】A.新型絮凝剂可以吸附水中杂质,达到净水的目的,并不能起到杀菌作用,A错误;
B.体现了合金硬度大于其成分金属的硬度,B正确;
C.丝质品主要成分为蛋白质,不是纤维素,C错误;
D.该段描述的是指南针,司南中的“勺”指的是磁铁,即司南中的“勺”含有Fe3O4,D错误;
2. 【答案】A
【解析】A.浓盐酸足量,MnO2物质的量为0.1 mol,完全反应转移电子数为0.2NA
A项正确;B. 标况下,SO3为固态,物质的量无法求出,B错误;C. C3H6可能是丙烯,也可能是环丙烷,1个环丙烷分子有9个键,0.50 mol则为4.5NA;若为丙烯,则键数目为4NA,,C项错误;D. HCOO-会水解,且溶液体积未知,D项错误。
3. 【答案】D
4. 【答案】D
【解析】
【详解】A.二氧化碳过量才会生成碳酸氢根,故A错误;
B.用惰性电极电解水溶液,阳极氯离子放电生成氯气,阴极铜离子得电子生成铜:,故B错误;
C.草酸是弱电解质不能拆,故C错误;
D.用溶液吸收少量生成亚硫酸氢钠:,故D正确;
5. 【答案】B
8. 【答案】D
【解析】
【详解】A.因为植物油的结构中含有碳碳双键,可以使酸性高锰酸钾溶液褪色,A项错误;
B.中为+6价,价态较高,具有氧化性,加入乙醇后被还原为浅绿色的,说明乙醇具有还原性,B项错误;
C.铁与浓硝酸发生钝化,铜作负极,不能证明铁与铜的金属性强弱,C项错误;
D.滴加淀粉溶液变蓝,说明含有碘单质,滴加硝酸银产生黄色沉淀,说明含有,所以溶液中含、,即溶液中存在平衡,D项正确;
9. 【答案】B
【解析】
【详解】A.二氧化硫不能一步得到硫化氢,A错误;
B.与HCl反应得到,与氨水反应得到,与HCl反应得到,与HCl反应得到,B正确;
C.无法一步反应得到Cu,氧化铜不能溶于水得到氢氧化铜,C错误;
D. NO无法一步得到,所以无法实现转化,D错误;
10. 【答案】B
11. 【答案】A
12. 【答案】D
【解析】
【详解】A.由题干可知,经过硫酸改性后的六方盘状Fe2O3催化剂活性和选择性都得到了极大提升,故硫酸改性后六方盘状Fe2O3催化剂提高了NOx的去除率,A正确;
B.根据该催化流程,该过程可能发生的反应有,B正确;
C.反应a为NO、NH3和发生化合反应生成,C正确;
D.该反应的催化剂为硫酸改性后的六方盘状Fe2O3,结合题图可知,该反应的催化剂为,D错误;
13. 【答案】B
14. 【答案】C
二、非选择题(本题包括4小题,共58分)
15. 【答案】(15分,除了标注1分外,每空2分)
(1)恒压分液漏斗或恒压滴液漏斗(1分)
(2)干燥气体(1分)
(3) d (1分) Be+2HCl=BeCl2+H2↑
(4)旋转滴液漏斗活塞,减缓盐酸的滴速
(5)除去AlCl3杂质
(6)取BeCl2产品溶于适量的盐酸中,滴加KSCN溶液,如呈红色,说明含氯化铁
(7)Be(OH)2+2NaOH= Na2Be(OH)4
(8)48%
16. 【答案】 (13分,除了标注1分外,每空2分)
(1)除去铝 (1分)
(2) ①. C ②. 热
(3)避免失去结晶水 (4)
(5)2Fe(OH)3 + 4OH- +3ClO- = 2FeO42- + 3Cl- + 5H2O
(6)碱性增强,生成,部分转化为磷酸钠而损失
17. 【答案】(15分)(除标明外,每空2分)
(1)+1016.0 高温(1分)
(2)BCD
(3)0.019p 减小
(4)催化剂失去活性 1 :3
18. 【答案】(15分,除了标注外,每空2分)
(1)环氧乙烷(1分)
(2) 氰基 (1分) 取代反应
(3)+NaCN+NaBr
(4)a
(5)10 或或
(6)(3分)
同课章节目录
