3.2水的电离平衡- 课件 (共29张PPT)高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.2水的电离平衡- 课件 (共29张PPT)高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-07-30 23:39:01 | ||
图片预览




文档简介
(共29张PPT)
第三章
水溶液中的离子
平衡
高中化学选修四
第二课时水的电离和溶液的酸碱性
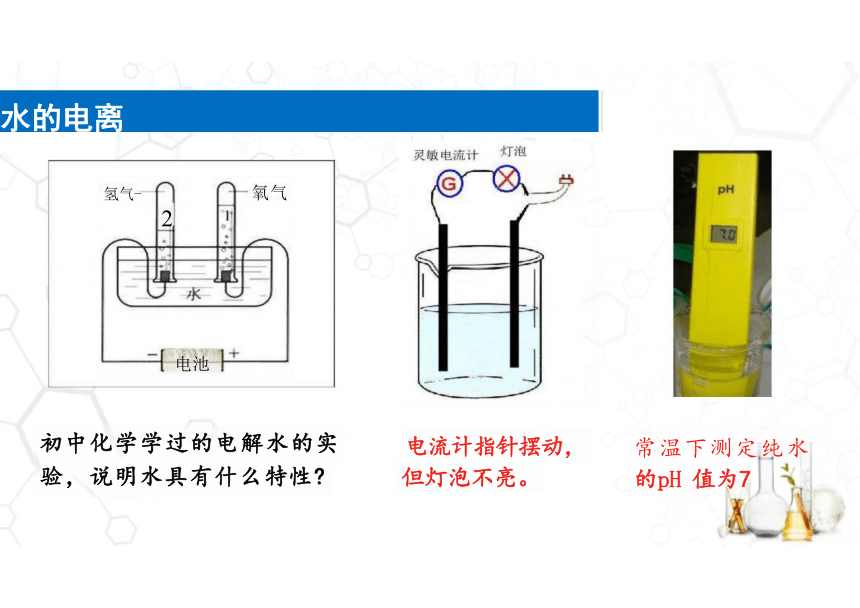
氢气-
2
电池
水的电离
初中化学学过的电解水的实
验,说明水具有什么特性
电流计指针摆动,
但灯泡不亮。
常温下测定纯水
的pH 值为7
氧气
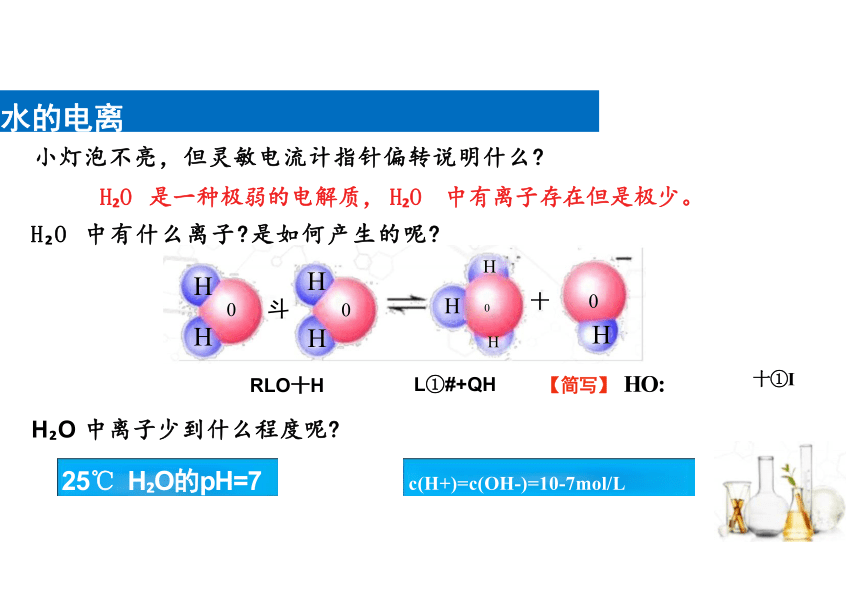
小灯泡不亮,但灵敏电流计指针偏转说明什么
H O 是一种极弱的电解质, H O 中有离子存在但是极少。
H O 中有什么离子 是如何产生的呢
H
水的电离
十 0
H
【简写】 HO:
H
斗 0
H
RLO十H
c(H+)=c(OH-)=10-7mol/L
25℃ H O的pH=7
H 0
H
L①#+QH
H O 中离子少到什么程度呢
H
0
H
十①I
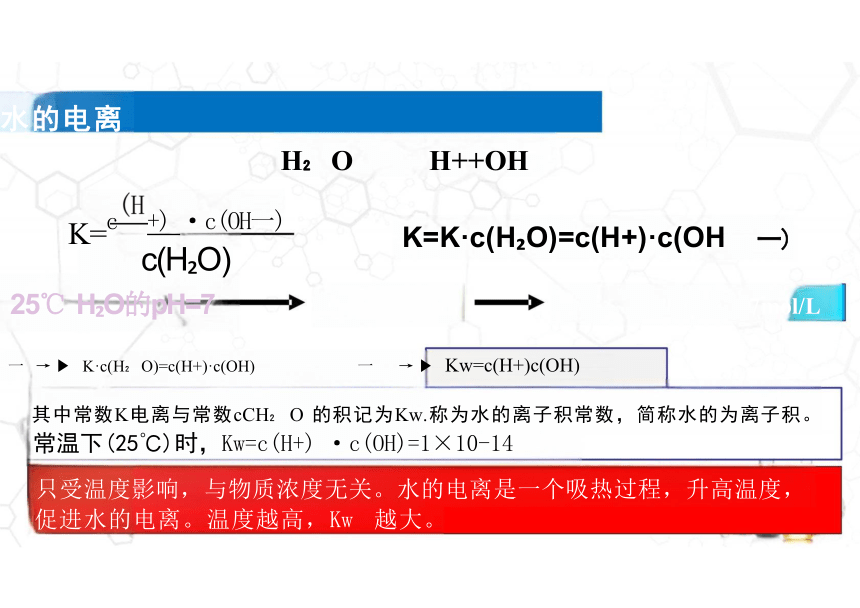
一 → K·c(H O)=c(H+)·c(OH) 一 → Kw=c(H+)c(OH)
其中常数K电离与常数cCH O 的积记为Kw.称为水的离子积常数,简称水的为离子积。
常温下(25℃)时,Kw=c(H+) ·c(OH)=1×10-14
只受温度影响,与物质浓度无关。水的电离是一个吸热过程,升高温度, 促进水的电离。温度越高,Kw 越大。
H O H++OH
K=c +) ·c(OH一) c(H O) K=K·c(H O)=c(H+)·c(OH
一)
25℃ H O的pH=7
7mol/L
水的电离
注 意:
1、K 不仅适用于纯水,也适用于酸碱盐的稀溶液。
2 、任何水溶液中, c(H+)水电离= c(OH) 水电离
3 、纯水中c(H+) 、c(OH) 的计算方法为c(H+)=c( OH )=√Kw 常温下,c(H+)=c(OH)=√Kw=10-7mol/L
水的电离
25℃ c(H+) c(OH一)
K=c(H+) ·c(OH一)
0.1mol/L稀盐酸 10-1 10-13
1.0×10-14
0.2mol/L稀盐酸 2×10-1 5×10-14
1.0×10-14
0.5mol/L稀盐酸 5×10-1 2×10-14
1.0×10-14
水的离子积常数Kw适用于稀溶液, -u40
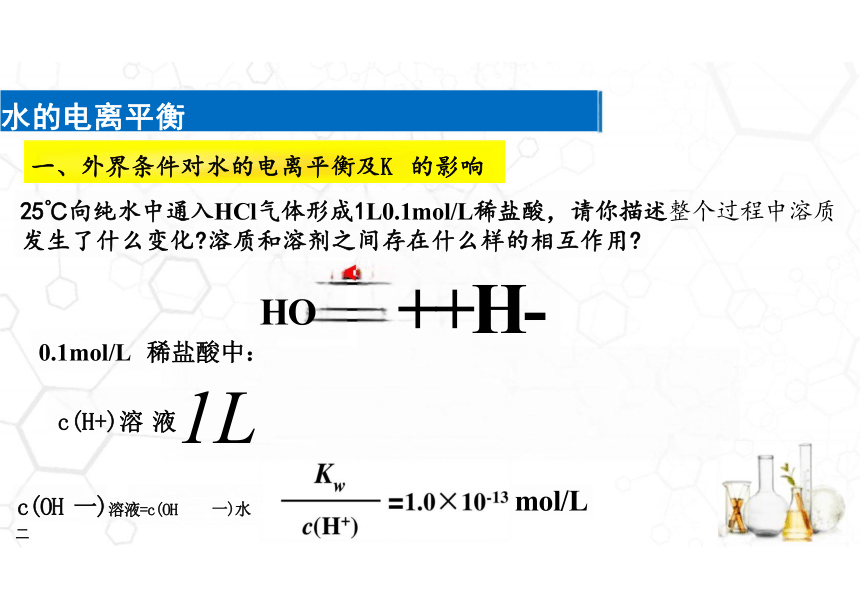
25℃向纯水中通入HCl气体形成1L0.1mol/L稀盐酸,请你描述整个过程中溶质 发生了什么变化 溶质和溶剂之间存在什么样的相互作用
水的电离平衡
一、外界条件对水的电离平衡及K 的影响
25℃时稀溶液中Kw=c(H+) ·c(OH一)=1.0×10-14
H+↓ OH =H+ + Cl-
H O 一
HCI 二
25℃向纯水中通入HCl气体形成1L0.1mol/L稀盐酸,请你描述整个过程中溶质 发生了什么变化 溶质和溶剂之间存在什么样的相互作用
c(H+)溶 液1L
c(OH 一)溶液=c(OH 一)水
二
水的电离平衡
一、外界条件对水的电离平衡及K 的影响
HO
0.1mol/L 稀盐酸中:
++H-
mol/L
改变条件 水的电离平衡移动方向 c(H+)变化 COH)变化
K
加入HCl 逆向 增大 减小
不变
加 入 N a O H 逆向 减小 增大
不变
加入NaCl 不移动 不变 不变
不变
升高30℃ 正向 增大 增大
增大
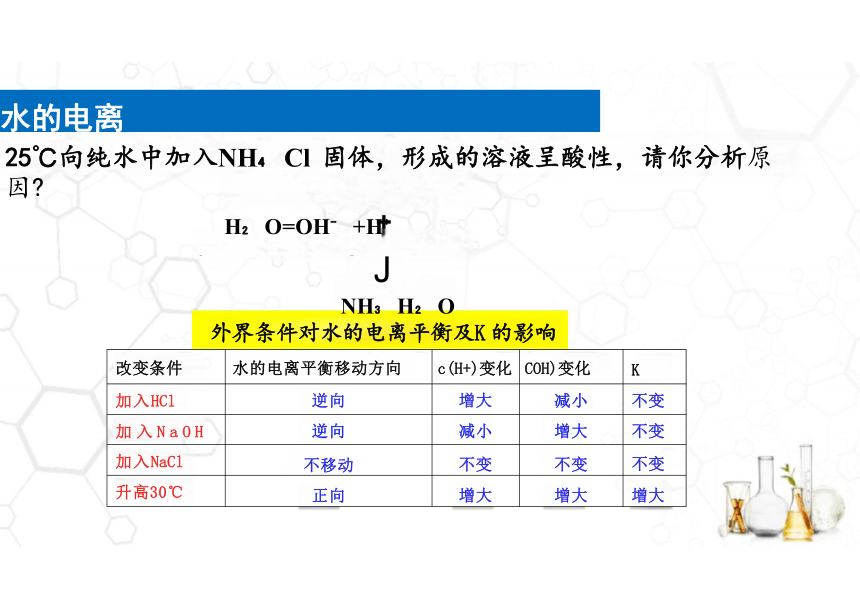
25℃向纯水中加入NH Cl 固体,形成的溶液呈酸性,请你分析原因
H O=OH +H
水的电离
NH H O
外界条件对水的电离平衡及K 的影响
J
NH ++Cl-
NH Cl
二
(1)水的电离为吸热过程,升高温度,水的电离平衡向电离方向移 动 ,Kw增大。
(2)温度不变,加入酸或碱,电离产生H+或OH, 能抑制水的电离, 使水的电离程度减小,但Kw不变。
(3)加入某些与水反应的物质,由于结合水电离出的H+ 或OH- 能 促进水的电离平衡,使水的电离程度增大,但Kw 不变。
水的电离
影响因素 改变条件 移动方向 c(H+) c(OH-)
Kw
温度 升温 向右移动 增大 增大
增大
外加酸碱 加酸 向左移动 增大 减小
不变
加碱 向左移动 减小 增大
不变
化学反应 加活泼金属 (如Na) 向右移动 减小 增大
不变
能水解的盐 弱碱阳离子 (如NH +) 向右移动 增大 减小
不变
弱酸阴离 (如CH COO) 向右移动 减小 增大
不变
水的电离
总结:外界条件对水的电离的影响水的电离平衡:H O=H++OH △H>0
例1、计算常温下列溶液中c(H+)与c(OH)
(11×10-3mol/LHCl 溶液
解: c(H+)= c(HCl)=1×10-3mol/L
由Kw=c(H+)·c(OH) , 得 c(OH)=
二 1×10-11 mol/l
(20.05mol/LBa(OH) 溶液
解 : c(OH-)= 2c[Ba(OH) ]=0.1 mol/L
水的电离
由Kw=c(H+)·c(OH ), 得
c(H+)=
练习1 0.1mol/L 的盐酸溶液中水电离出的c(H+) 和c(OH一)是多少(常温)
水电离出的c(OH)=1×10- 4/0.1=1×10-1 mol/L=c(H+)
练习2 0.1mol/L 的NaOH 溶液中水电离出的c(H+) 和c(OH 一)是多少(常温)
水电离出的c(H+)=1×10- 4/0.1=1×10-13mol/L=c(OH)
练习3、25℃,浓度均为0.1mol/L 的下列溶液中c(H+) 由大到小的排列顺序:
①氨水 ②NaOH ③盐 酸 ④醋酸 ③>④>①> ②
练习4、在由水电离产生的H+ 浓度为1×10-13mol ·L-1 的溶液中, 一定能
大量共存的离子组是①K+ 、Cl- 、NO 、S -②K+ 、Fe + 、I 、SO -③Na+ 、 Cl-、NO - SO -④Na+ 、Ca + 、Cl- 、HCO -⑤K+ 、Ba + 、Cl- 、NO 3
A.①③B ③⑤ C.③④D.②⑤
水的电离
二、溶液的酸碱性与H+、OH- 浓度的关系
常温25℃ 酸性:c(H+)>c(OH) c(H+)> 10-7mol/L
中性:c(H+)=c(OH) c(H+)= 10-7mol/L
碱性:c(H+)溶液的酸碱性由溶液中H+ 、OH-浓度相对大小决定
表示溶液的酸碱性如何才能更加方便 25℃时有以下溶液:
10-5mol/L 盐酸、1mol/L 盐酸、2mol/L 盐酸、10-5mol/LNaOH 溶液、1mol/LNaOH 溶液
浓度较小时,如: c(H+)=10- mol/L,这种表示方法很麻烦但应用广,所以引入了一种方 便方案
溶液的酸碱性及pH
三 、溶液的pH 值
1 、用 H+ 物质的量浓度的负对数来表示溶液酸碱性。 即: pH=-1gc(H+) c(H+) → lgc(H+) 一 → -1g c(H+)
10-12mol/L → -12 → 12
pH 的大小能反映出溶液中c(H+)的大小,即表示稀溶液酸、碱性的强弱。
c(H+)=c(OH)=1×10-7mol/L
c(H+)>c(OH) c(H+)>1×10-7mol/L
c(H+)溶液的酸碱性及pH
常温下 中性溶液
酸性溶液
碱性溶液
pH=7
pH<7
c(H+)
由当c(H+)>1mol/L时,使用pH值更不方便。所以用 c(H+)或c(OH) 直接表示更好。
由pH 值一般表示1mol/L 以 下c(H+)的浓度。
pH值越小酸性越强,碱性越弱
pH值越大碱性越强,酸性越弱
溶液的酸碱性及pH
0—
1
2
3
4
5
6
7
8
9
10
11
12
13
10
10-1
10-
10- 104
10-5
10-
10-7
108
10-
10-10
10-11
10-12
10-13
溶液的pH 值
强
酸 性 增 碱 性 增 强
14 10-14
中性溶液 pH=6
c(H+)=c(OH)=1×10- mol/L
酸性溶液 pH<6
c(H+)>c(OH) c(H+)>1×10- mol/L
碱性溶液 pH>6
c(H+)思 考 :pH 为7的溶液是否 一 定是中性溶液
不一定,只有在常温下才显中性。100℃时pH 为7显碱性 溶液的酸碱性与pH的关系 (100℃)
溶液的酸碱性及pH
pH 1 23.1 4.45678 91011121314 甲基橙 红色 橙色 5.0 8.0 黄色 石蕊 红色 紫色 蓝色 酚酞 无色 浅红 色
红色
2、 pH的测定方法
(1)酸碱指示剂(定性测量范围)
酸碱指示剂的颜色变化是在一定的pH 值范围内发生的。我们 把指示剂发生颜色变化的pH值范围叫做指示剂的变色范围。
溶液的酸碱性及pH
变色范围(pH) 甲基橙 3.1~4.4
石蕊 5.0~8.0
酚酞 8.2~10.0
8.2 10.0
溶液的酸碱性及pH
指示剂发生颜色变化的pH值范围叫做指示剂的变色范围。
2.定量测定:pH试纸法 pH计法等
使用方 法 :将pH试纸放在表面皿或玻璃片上,直接把待测液滴在干燥
的pH试纸上,试纸上显出颜色后马上跟标准比色卡相对比
①pH 试纸不能润湿;
②玻璃棒应干燥洁净;
③应在半分钟内观察,时间长, pH试纸所显示的颜色会改变。
例:计算0.1mol/L 的HCl溶液的pH值
解、∵ c(H+)= 0.1mol/L ∴pH=—1g 0.1=1
练习:试计算常温下下列溶液的pH值
①0.005 mol/LH SO 溶液;②0.005 mol/L Ba(OH) 溶液
解:①∵ c(H+)=0.005 mol/L ×2=0.01 mol/L
∴pH=-1g0.01=2
②∵c(OH 一)=0.01mol/L
∴pH=-lg 10-12=12
溶液的酸碱性及pH
例:25℃时,10mL0.1mol/LN aOH 和10mL0.05 mol/L Ba(OH) 混合,计算混合溶液的pH 值
解 :c(OH-)=0.1mol/L
c(OH 一)π=0.1mol/L
K
C(OH- )混合 →C(H+)
→pOH
-1gC (OH-),混合
溶液的酸碱性及pH
③强碱与强碱混合求pH
强碱I: C电
强 碱 Ⅱ: C 电
离C(OH-)
离C(OH-)
—IgC(H+) 混含H
混合
14—pOH
pH=—lg c(H+)余
例:求30mL pH=3的盐酸溶液与20mL pH=11的氢氧化钠溶液反应后溶液的pH
解 :c(H+)=10- mol/L c(OH-)=10- mol/L
I/L pH= 1g2×10- =4 1g
例:将pH=2 盐 酸aL 和pH=13 的氢氧化钠bL 混合,溶液恰好呈中性,则a:b 等 于 多少
(1)强酸强碱恰好完全反应,溶液呈中性,混合溶液p H=7
溶液的酸碱性及pH
(2)强酸强碱混合酸过量,先求过量的酸的浓度,再求pH
④ 强 酸 与 强 碱 混 合 求pH
4、 溶液的稀释问题
强酸的稀释: 强酸pH=a, 加水稀释10#倍,则pH=a+n;
10
例:取1mL pH=3的硫酸溶液加水稀释到100mL, 溶液的pH变为多少
解: pH=-1gc(H+)=-lg10- =5
若上述溶液加水稀释到体积为原来的1000倍,则溶液的pH变为多少 pH=6
若稀释到体积为原来的10 倍,则溶液的pH变为多少
pH8 pH 接近于7
溶液的酸碱性及pH
稀释相同倍数时 稀释到相同pH 时
V水 pH: 盐酸>醋酸 稀释的倍数:醋酸>盐酸
pH 值相同的两酸溶液稀释相同倍数后,酸性强的酸pH值变化大
pH=2的盐酸稀释10倍后pH= 3
pH=2的醋酸稀释10倍后pH <3
结论:稀释10倍pH变 化 ( 增 大 ) < 1
个PH 盐酸
醋酸
3
2 10倍
溶液的酸碱性及pH
例、将pH=2 的醋酸稀释10倍后,溶液的pH 等于3吗
弱酸的稀释 pH=a 的弱酸稀释10#倍后,a强碱的稀释:强碱pH=b, 加水稀释10#倍,则pH=b-n;
例:取pH=11 的NaOH 溶液与水按1:99的体积比混合后,溶液的pH 变为多少
原来的10
解: 稀释前c(OH)=10 mol/L
稀释后溶液的pH=9
若上述溶液加水稀释到体积为原来的1000倍,则溶液
的pH 变为多少 pH=8
若稀释到体积为原来的10 倍,则溶液的pH 变为多少
pH 6
溶液的酸碱性及pH
弱碱的稀释 pH=b 的弱碱稀释10#倍后,b-n例4将pH=12 的氨水稀释10倍后后,溶液的pH 是11,对吗 例 :pH=12 的NaOH 溶液稀释10倍后pH= 11
溶液的酸碱性及pH
pH=12 的氨水稀释10倍后pH >1 1
结论:稀释10倍pH变化(减小)<1 .
稀释到相同pH 时
稀释的倍数:氨水>NaOH
pH 值相同的两碱溶液稀释相同倍数后,碱性强的碱pH 值变化大
稀释相同倍数时
pH: 氨水>NaOH
氨水
11-
个pH
NaOH
10倍
V水
12
总结:酸或碱的稀释与pH 的关系
强酸pH=a, 加水稀释10”倍,则pH=a+n;
弱酸pH=a, 加水稀释10倍,则pH强碱pH=b, 加水稀释10倍,则pH=b-n;
弱碱pH=b, 加水稀释10#倍,则pH>b-n;
酸、碱溶液无限稀释时,pH只能接近7,但酸不能大于7,碱不能小于7;
对于浓度(或pH ) 相同的强酸和弱酸,稀释相同倍数,强酸的pH 变化幅
度大。(强碱、弱碱相似)
溶液的酸碱性及pH
注 意 :
①酸溶液一定呈酸性,碱溶液一定呈碱性;但呈酸性的溶液不一定是 酸溶液,呈碱性的溶液不一定是碱溶液;
②溶液酸性强弱是根据C(H+)的大小判断,C(H+)越大,酸性越强;
溶液碱性性强弱是根据C(OH) 的大小判断,C(OH) 越大,碱性越强;
③强酸(碱)溶液的酸碱性不一定比弱酸碱溶液的酸碱性强,酸碱性 强的溶液也不一定是强酸碱溶液;
④酸碱性相同的弱酸碱比强酸碱浓度大,中和能力强;
⑤pH 与C(H+)成反比,pH<7 不一定呈酸性;pH=7 不一定呈中性; pH>7 不一定呈碱性;
溶液的酸碱性及pH
【练习1】已知25℃时水电离出的C(H+)=10- mol/L, 计算纯水pH并判断酸碱性
【 习 肯定 显无 液
C.pH<7 的溶液 D.c(OH-)【练习3】25℃,浓度均为0.1mol/L 的下列溶液中[H+]由大到小的排列顺序:
①氨水 ②NaOH ③盐 酸 ④醋酸 ③ >④ >① >②
【练习4】有相同pH的三种酸HX 、HY 、HZ的溶液,稀释相同倍数后,pH
的变化值依次增大,则HX 、HY 、HZ 的酸性由强到弱的顺序是 B
A 、HX.HY.HZ B 、HZ.HY.HX
C 、HX.HZ.HY D 、HY.HZ.HX
的
D
能使酚酞
酸性的是
B
是
的溶液
列溶液
A
练
溶液的酸碱性及pH
水的电离及溶液酸碱性
下节再见
第三章
水溶液中的离子
平衡
高中化学选修四
第二课时水的电离和溶液的酸碱性
氢气-
2
电池
水的电离
初中化学学过的电解水的实
验,说明水具有什么特性
电流计指针摆动,
但灯泡不亮。
常温下测定纯水
的pH 值为7
氧气
小灯泡不亮,但灵敏电流计指针偏转说明什么
H O 是一种极弱的电解质, H O 中有离子存在但是极少。
H O 中有什么离子 是如何产生的呢
H
水的电离
十 0
H
【简写】 HO:
H
斗 0
H
RLO十H
c(H+)=c(OH-)=10-7mol/L
25℃ H O的pH=7
H 0
H
L①#+QH
H O 中离子少到什么程度呢
H
0
H
十①I
一 → K·c(H O)=c(H+)·c(OH) 一 → Kw=c(H+)c(OH)
其中常数K电离与常数cCH O 的积记为Kw.称为水的离子积常数,简称水的为离子积。
常温下(25℃)时,Kw=c(H+) ·c(OH)=1×10-14
只受温度影响,与物质浓度无关。水的电离是一个吸热过程,升高温度, 促进水的电离。温度越高,Kw 越大。
H O H++OH
K=c +) ·c(OH一) c(H O) K=K·c(H O)=c(H+)·c(OH
一)
25℃ H O的pH=7
7mol/L
水的电离
注 意:
1、K 不仅适用于纯水,也适用于酸碱盐的稀溶液。
2 、任何水溶液中, c(H+)水电离= c(OH) 水电离
3 、纯水中c(H+) 、c(OH) 的计算方法为c(H+)=c( OH )=√Kw 常温下,c(H+)=c(OH)=√Kw=10-7mol/L
水的电离
25℃ c(H+) c(OH一)
K=c(H+) ·c(OH一)
0.1mol/L稀盐酸 10-1 10-13
1.0×10-14
0.2mol/L稀盐酸 2×10-1 5×10-14
1.0×10-14
0.5mol/L稀盐酸 5×10-1 2×10-14
1.0×10-14
水的离子积常数Kw适用于稀溶液, -u40
25℃向纯水中通入HCl气体形成1L0.1mol/L稀盐酸,请你描述整个过程中溶质 发生了什么变化 溶质和溶剂之间存在什么样的相互作用
水的电离平衡
一、外界条件对水的电离平衡及K 的影响
25℃时稀溶液中Kw=c(H+) ·c(OH一)=1.0×10-14
H+↓ OH =H+ + Cl-
H O 一
HCI 二
25℃向纯水中通入HCl气体形成1L0.1mol/L稀盐酸,请你描述整个过程中溶质 发生了什么变化 溶质和溶剂之间存在什么样的相互作用
c(H+)溶 液1L
c(OH 一)溶液=c(OH 一)水
二
水的电离平衡
一、外界条件对水的电离平衡及K 的影响
HO
0.1mol/L 稀盐酸中:
++H-
mol/L
改变条件 水的电离平衡移动方向 c(H+)变化 COH)变化
K
加入HCl 逆向 增大 减小
不变
加 入 N a O H 逆向 减小 增大
不变
加入NaCl 不移动 不变 不变
不变
升高30℃ 正向 增大 增大
增大
25℃向纯水中加入NH Cl 固体,形成的溶液呈酸性,请你分析原因
H O=OH +H
水的电离
NH H O
外界条件对水的电离平衡及K 的影响
J
NH ++Cl-
NH Cl
二
(1)水的电离为吸热过程,升高温度,水的电离平衡向电离方向移 动 ,Kw增大。
(2)温度不变,加入酸或碱,电离产生H+或OH, 能抑制水的电离, 使水的电离程度减小,但Kw不变。
(3)加入某些与水反应的物质,由于结合水电离出的H+ 或OH- 能 促进水的电离平衡,使水的电离程度增大,但Kw 不变。
水的电离
影响因素 改变条件 移动方向 c(H+) c(OH-)
Kw
温度 升温 向右移动 增大 增大
增大
外加酸碱 加酸 向左移动 增大 减小
不变
加碱 向左移动 减小 增大
不变
化学反应 加活泼金属 (如Na) 向右移动 减小 增大
不变
能水解的盐 弱碱阳离子 (如NH +) 向右移动 增大 减小
不变
弱酸阴离 (如CH COO) 向右移动 减小 增大
不变
水的电离
总结:外界条件对水的电离的影响水的电离平衡:H O=H++OH △H>0
例1、计算常温下列溶液中c(H+)与c(OH)
(11×10-3mol/LHCl 溶液
解: c(H+)= c(HCl)=1×10-3mol/L
由Kw=c(H+)·c(OH) , 得 c(OH)=
二 1×10-11 mol/l
(20.05mol/LBa(OH) 溶液
解 : c(OH-)= 2c[Ba(OH) ]=0.1 mol/L
水的电离
由Kw=c(H+)·c(OH ), 得
c(H+)=
练习1 0.1mol/L 的盐酸溶液中水电离出的c(H+) 和c(OH一)是多少(常温)
水电离出的c(OH)=1×10- 4/0.1=1×10-1 mol/L=c(H+)
练习2 0.1mol/L 的NaOH 溶液中水电离出的c(H+) 和c(OH 一)是多少(常温)
水电离出的c(H+)=1×10- 4/0.1=1×10-13mol/L=c(OH)
练习3、25℃,浓度均为0.1mol/L 的下列溶液中c(H+) 由大到小的排列顺序:
①氨水 ②NaOH ③盐 酸 ④醋酸 ③>④>①> ②
练习4、在由水电离产生的H+ 浓度为1×10-13mol ·L-1 的溶液中, 一定能
大量共存的离子组是①K+ 、Cl- 、NO 、S -②K+ 、Fe + 、I 、SO -③Na+ 、 Cl-、NO - SO -④Na+ 、Ca + 、Cl- 、HCO -⑤K+ 、Ba + 、Cl- 、NO 3
A.①③B ③⑤ C.③④D.②⑤
水的电离
二、溶液的酸碱性与H+、OH- 浓度的关系
常温25℃ 酸性:c(H+)>c(OH) c(H+)> 10-7mol/L
中性:c(H+)=c(OH) c(H+)= 10-7mol/L
碱性:c(H+)
表示溶液的酸碱性如何才能更加方便 25℃时有以下溶液:
10-5mol/L 盐酸、1mol/L 盐酸、2mol/L 盐酸、10-5mol/LNaOH 溶液、1mol/LNaOH 溶液
浓度较小时,如: c(H+)=10- mol/L,这种表示方法很麻烦但应用广,所以引入了一种方 便方案
溶液的酸碱性及pH
三 、溶液的pH 值
1 、用 H+ 物质的量浓度的负对数来表示溶液酸碱性。 即: pH=-1gc(H+) c(H+) → lgc(H+) 一 → -1g c(H+)
10-12mol/L → -12 → 12
pH 的大小能反映出溶液中c(H+)的大小,即表示稀溶液酸、碱性的强弱。
c(H+)=c(OH)=1×10-7mol/L
c(H+)>c(OH) c(H+)>1×10-7mol/L
c(H+)
常温下 中性溶液
酸性溶液
碱性溶液
pH=7
pH<7
c(H+)
由当c(H+)>1mol/L时,使用pH值更不方便。所以用 c(H+)或c(OH) 直接表示更好。
由pH 值一般表示1mol/L 以 下c(H+)的浓度。
pH值越小酸性越强,碱性越弱
pH值越大碱性越强,酸性越弱
溶液的酸碱性及pH
0—
1
2
3
4
5
6
7
8
9
10
11
12
13
10
10-1
10-
10- 104
10-5
10-
10-7
108
10-
10-10
10-11
10-12
10-13
溶液的pH 值
强
酸 性 增 碱 性 增 强
14 10-14
中性溶液 pH=6
c(H+)=c(OH)=1×10- mol/L
酸性溶液 pH<6
c(H+)>c(OH) c(H+)>1×10- mol/L
碱性溶液 pH>6
c(H+)
不一定,只有在常温下才显中性。100℃时pH 为7显碱性 溶液的酸碱性与pH的关系 (100℃)
溶液的酸碱性及pH
pH 1 23.1 4.45678 91011121314 甲基橙 红色 橙色 5.0 8.0 黄色 石蕊 红色 紫色 蓝色 酚酞 无色 浅红 色
红色
2、 pH的测定方法
(1)酸碱指示剂(定性测量范围)
酸碱指示剂的颜色变化是在一定的pH 值范围内发生的。我们 把指示剂发生颜色变化的pH值范围叫做指示剂的变色范围。
溶液的酸碱性及pH
变色范围(pH) 甲基橙 3.1~4.4
石蕊 5.0~8.0
酚酞 8.2~10.0
8.2 10.0
溶液的酸碱性及pH
指示剂发生颜色变化的pH值范围叫做指示剂的变色范围。
2.定量测定:pH试纸法 pH计法等
使用方 法 :将pH试纸放在表面皿或玻璃片上,直接把待测液滴在干燥
的pH试纸上,试纸上显出颜色后马上跟标准比色卡相对比
①pH 试纸不能润湿;
②玻璃棒应干燥洁净;
③应在半分钟内观察,时间长, pH试纸所显示的颜色会改变。
例:计算0.1mol/L 的HCl溶液的pH值
解、∵ c(H+)= 0.1mol/L ∴pH=—1g 0.1=1
练习:试计算常温下下列溶液的pH值
①0.005 mol/LH SO 溶液;②0.005 mol/L Ba(OH) 溶液
解:①∵ c(H+)=0.005 mol/L ×2=0.01 mol/L
∴pH=-1g0.01=2
②∵c(OH 一)=0.01mol/L
∴pH=-lg 10-12=12
溶液的酸碱性及pH
例:25℃时,10mL0.1mol/LN aOH 和10mL0.05 mol/L Ba(OH) 混合,计算混合溶液的pH 值
解 :c(OH-)=0.1mol/L
c(OH 一)π=0.1mol/L
K
C(OH- )混合 →C(H+)
→pOH
-1gC (OH-),混合
溶液的酸碱性及pH
③强碱与强碱混合求pH
强碱I: C电
强 碱 Ⅱ: C 电
离C(OH-)
离C(OH-)
—IgC(H+) 混含H
混合
14—pOH
pH=—lg c(H+)余
例:求30mL pH=3的盐酸溶液与20mL pH=11的氢氧化钠溶液反应后溶液的pH
解 :c(H+)=10- mol/L c(OH-)=10- mol/L
I/L pH= 1g2×10- =4 1g
例:将pH=2 盐 酸aL 和pH=13 的氢氧化钠bL 混合,溶液恰好呈中性,则a:b 等 于 多少
(1)强酸强碱恰好完全反应,溶液呈中性,混合溶液p H=7
溶液的酸碱性及pH
(2)强酸强碱混合酸过量,先求过量的酸的浓度,再求pH
④ 强 酸 与 强 碱 混 合 求pH
4、 溶液的稀释问题
强酸的稀释: 强酸pH=a, 加水稀释10#倍,则pH=a+n;
10
例:取1mL pH=3的硫酸溶液加水稀释到100mL, 溶液的pH变为多少
解: pH=-1gc(H+)=-lg10- =5
若上述溶液加水稀释到体积为原来的1000倍,则溶液的pH变为多少 pH=6
若稀释到体积为原来的10 倍,则溶液的pH变为多少
pH8 pH 接近于7
溶液的酸碱性及pH
稀释相同倍数时 稀释到相同pH 时
V水 pH: 盐酸>醋酸 稀释的倍数:醋酸>盐酸
pH 值相同的两酸溶液稀释相同倍数后,酸性强的酸pH值变化大
pH=2的盐酸稀释10倍后pH= 3
pH=2的醋酸稀释10倍后pH <3
结论:稀释10倍pH变 化 ( 增 大 ) < 1
个PH 盐酸
醋酸
3
2 10倍
溶液的酸碱性及pH
例、将pH=2 的醋酸稀释10倍后,溶液的pH 等于3吗
弱酸的稀释 pH=a 的弱酸稀释10#倍后,a
例:取pH=11 的NaOH 溶液与水按1:99的体积比混合后,溶液的pH 变为多少
原来的10
解: 稀释前c(OH)=10 mol/L
稀释后溶液的pH=9
若上述溶液加水稀释到体积为原来的1000倍,则溶液
的pH 变为多少 pH=8
若稀释到体积为原来的10 倍,则溶液的pH 变为多少
pH 6
溶液的酸碱性及pH
弱碱的稀释 pH=b 的弱碱稀释10#倍后,b-n
溶液的酸碱性及pH
pH=12 的氨水稀释10倍后pH >1 1
结论:稀释10倍pH变化(减小)<1 .
稀释到相同pH 时
稀释的倍数:氨水>NaOH
pH 值相同的两碱溶液稀释相同倍数后,碱性强的碱pH 值变化大
稀释相同倍数时
pH: 氨水>NaOH
氨水
11-
个pH
NaOH
10倍
V水
12
总结:酸或碱的稀释与pH 的关系
强酸pH=a, 加水稀释10”倍,则pH=a+n;
弱酸pH=a, 加水稀释10倍,则pH
弱碱pH=b, 加水稀释10#倍,则pH>b-n;
酸、碱溶液无限稀释时,pH只能接近7,但酸不能大于7,碱不能小于7;
对于浓度(或pH ) 相同的强酸和弱酸,稀释相同倍数,强酸的pH 变化幅
度大。(强碱、弱碱相似)
溶液的酸碱性及pH
注 意 :
①酸溶液一定呈酸性,碱溶液一定呈碱性;但呈酸性的溶液不一定是 酸溶液,呈碱性的溶液不一定是碱溶液;
②溶液酸性强弱是根据C(H+)的大小判断,C(H+)越大,酸性越强;
溶液碱性性强弱是根据C(OH) 的大小判断,C(OH) 越大,碱性越强;
③强酸(碱)溶液的酸碱性不一定比弱酸碱溶液的酸碱性强,酸碱性 强的溶液也不一定是强酸碱溶液;
④酸碱性相同的弱酸碱比强酸碱浓度大,中和能力强;
⑤pH 与C(H+)成反比,pH<7 不一定呈酸性;pH=7 不一定呈中性; pH>7 不一定呈碱性;
溶液的酸碱性及pH
【练习1】已知25℃时水电离出的C(H+)=10- mol/L, 计算纯水pH并判断酸碱性
【 习 肯定 显无 液
C.pH<7 的溶液 D.c(OH-)
①氨水 ②NaOH ③盐 酸 ④醋酸 ③ >④ >① >②
【练习4】有相同pH的三种酸HX 、HY 、HZ的溶液,稀释相同倍数后,pH
的变化值依次增大,则HX 、HY 、HZ 的酸性由强到弱的顺序是 B
A 、HX.HY.HZ B 、HZ.HY.HX
C 、HX.HZ.HY D 、HY.HZ.HX
的
D
能使酚酞
酸性的是
B
是
的溶液
列溶液
A
练
溶液的酸碱性及pH
水的电离及溶液酸碱性
下节再见
